猪圆环病毒2型Cap蛋白特异性纳米抗体的原核表达研究
王长江,曲光刚, *,武曰星,赵中伟,郭广君,全洪坤,韩 强,沈志强, *
>(1.山东绿都生物科技有限公司,山东滨州 256600;2.山东省滨州畜牧兽医研究院,山东滨州 256600;3.中国农业大学,北京 100000)
猪圆环病毒(Porcine circovirus,PCV)属于圆环病毒科、圆环病毒属,病毒粒子呈20面体对称结构,无囊膜[1]。目前已发现的猪圆环病毒有PCV1、PCV2和PCV3三种基因型,以PCV2对养猪业造成的危害最为严重,是断奶仔猪多系统衰竭综合征、皮炎和肾病综合征等疾病的主要病原[2-3]。PCV2基因组全长约1.76 kb,包括11个开放性阅读框[4](Open Reading Framework,ORF),其中ORF2编码的Cap蛋白是PCV2主要的结构蛋白和免疫相关蛋白[5]。Cap蛋白相对分子质量约27.8 ku,具有很好的免疫原性[6-7],在PCV2的感染和机体免疫过程中起重要作用,因此Cap蛋白是研制亚单位疫苗或使用免疫学方法检测PCV2的首选靶抗原。
目前已经报道的可供Cap蛋白抗原表位分析、PCV2鉴别诊断的特异性抗体均为传统的全分子抗体[8-11],这类抗体蛋白相对分子质量大且热稳定性较差,通过哺乳动物细胞制备导致生产成本较高。1993年比利时科学家Hamers报道在骆驼体内存在一种天然缺失轻链的重链抗体[12],克隆其可变区可得到只有重链可变区的单域抗体(Variable domain of heavy chain of heavy chain antibody,VHH),相对分子质量约15 ku,仅为传统全分子抗体相对分子质量的1/10,也被称为纳米抗体。与传统全分子抗体相比,纳米抗体具有相对分子质量小、结构简单、热稳定性好、能在大肠杆菌和酵母细胞中快速大量表达的优点[13],因此受到越来越多的关注。纳米抗体的这些特点使其成为PCV2抗原检测或治疗性抗体药物的理想选择。本研究利用大肠埃希菌原核表达系统对淘洗获得的PCV2 Cap蛋白特异性纳米抗体序列(vhhcap)进行了克隆表达,以期为PCV2检测、治疗用新型纳米抗体工具开发提供实验依据。
1 材料与方法
1.1 菌株与载体E.coliDH5α感受态细胞、E.coliBL21(DE3)感受态细胞、原核表达载体pCold-SUMO、pET32a(+)均由山东省滨州畜牧兽医研究院保存。
1.2 主要试剂 2×Taq PCR MasterMix 购自天根生化科技有限公司;T4 DNA连接酶、BamH I限制性内切酶、Hind III限制性内切酶均购自NEB公司;DL 2000 Marker购自宝生物工程(大连)有限公司;质粒小量提取试剂盒和胶回收试剂盒购自Omega Bio-Tek公司;Unstained Protein MW Marker购自赛默飞世尔公司;氨苄青霉素(Ampicillin)为SIGMA公司产品;Ni2+-NTA亲和层析柱为常州天地人和生物科技有限公司产品;Anti His-tag (HRP)鼠源单抗购自康为世纪生物科技有限公司;猪圆环病毒Cap蛋白由山东绿都生物科技有限公司制备;ECL发光试剂为北京赛智产品;其他试剂均为进口或国产分析纯。
1.3 方法
1.3.1vhhcap基因片段扩增 根据前期淘洗筛选获得的60株PCV2 Cap蛋白纳米抗体基因(vhhcap)序列,使用Primer premier 5.0软件设计一对通用vhhcap特异性扩增引物,引物上、下游5’端分别加入BamH I和Hind III限制性内切酶酶切位点,用于扩增克隆到pCold-SUMO和pET-32a(+)载体上的vhh片段。引物送上海捷瑞生物工程有限公司进行合成。
以其中1株vhhcap为模板,利用上述引物进行PCR扩增。PCR反应体系为:vhhcap模板1 μL、上下游引物各1 μL、2×Taq PCR MasterMix 25 μL、ddH2O 22 μL。PCR反应条件为:95 ℃ 5 min,95 ℃ 30 s、60 ℃ 30 s、72 ℃ 45 s,30 cycles,72 ℃ 10 min。PCR反应结束后将 PCR产物进行琼脂糖凝胶电泳,鉴定片段大小;将鉴定正确的PCR产物割胶回收。
1.3.2vhhcap-pCold-SUMO和vhhcap-pET32a(+)重组表达载体构建 将vhhcap目的基因和pCold-SUMO质粒分别用BamH I和Hind III双酶切,纯化后使用T4 DNA连接酶连接,构建vhhcap-pCold-SUMO重组质粒;连接产物转化E.coliDH5α感受态细胞,涂布Amp抗性平板,过夜培养后挑取单菌落,进行菌液PCR鉴定。从菌液PCR鉴定为阳性的重组菌中提取质粒,即为构建成功的vhhcap-pCold-SUMO重组质粒。
vhhcap-pET32a(+)重组表达载体的构建方法同上。
1.3.3 VHHcap重组蛋白诱导表达 将vhhcap-pCold-SUMO和vhhcap-pET32a(+)重组质粒分别转入E.coliBL21(DE3),按1%比例将过夜培养的重组菌转接到5 mL新鲜LB液体培养基中,37 ℃ 振荡培养至OD600约0.6时进行诱导表达,以不加诱导剂的菌液作为阴性表达对照。vhhcap-pCold-SUMO/BL21诱导条件为:IPTG终浓度1 mmol/L,16 ℃ 160 r/min诱导表达5 h;vhhcap-pET32a(+)/BL21诱导条件为:IPTG终浓度1 mmol/L,30 ℃ 160 r/min诱导表达5 h。诱导表达完成后收集菌体沉淀并超声破碎,将超声破碎后的样品离心,分离上清和沉淀,分别变性处理后进行SDS-PAGE分析。
1.3.4 VHHcap重组蛋白纯化vhhcap-pCold-SUMO/BL21和vhhcap-pET32a(+)/BL21重组菌同时进行诱导表达,按1%比例分别将过夜培养的重组菌接种到500 mL新鲜LB培养基中,诱导表达条件同1.3.3。表达完成后将菌体超声破碎,离心分别收集上清和沉淀;超声上清采用Ni2+-NTA亲和层析柱进行纯化,操作方法参考产品说明书进行。对纯化后重组蛋白进行SDS-PAGE分析并用BCA试剂盒测定浓度。
1.3.5 Western blotting分析 采用Western blotting对表达的纳米抗体重组蛋白鉴定。将纯化后的重组蛋白进行SDS-PAGE电泳后转移至醋酸纤维素膜上,用5%脱脂奶粉封闭2 h后洗涤5次,加入1∶2000稀释的Anti His-tag (HRP)鼠源单抗,室温孵育1 h,0.05% PBST洗涤5次后使用ECL化学发光显色液显色1 min并拍照观察。
1.3.6 VHHcap纳米抗体ELISA效价分析 两种载体表达的VHHcap重组蛋白纯化后使用BCA试剂盒测定浓度,通过间接ELISA法对两种VHHcap重组蛋白进行效价分析,并做对比分析。以PCV2 Cap蛋白作为抗原包被96孔酶标板,包被浓度为10 μg/mL,每孔加入200 μL 3% MPBS进行封闭,两种VHHcap重组蛋白分别调整至相同浓度水平后进行梯度稀释,分别以梯度稀释的两种VHHcap重组蛋白作为一抗,分别以未诱导的vhhcap-pCold-SUMO/BL21和vhhcap-pET32a(+)/BL21超声上清稀释50倍作为阴性对照,37 ℃孵育1 h;洗涤后使用1∶2000稀释的Anti His-tag(HRP)鼠源单抗37 ℃孵育1 h;洗涤后加入TMB底物显色液室温显色15 min,显色完成后加入终止液,酶标仪读取450 nm波长处吸光值。
2 结果与分析
2.1vhhcap目的基因扩增 测序结果表明,淘洗获得的该株vhhcap序列长度为408 bp,编码136个氨基酸,CDR3区域包含19个氨基酸残基,与NCBI数据库序列比对结果显示匹配序列均为羊驼或骆驼重链抗体可变区序列。PCR产物电泳结果显示,扩增条带大小约400 bp,与预期条带大小一致(图1)。

M:DL 2000 DNA Marker;Nc:PCR 阴性对照;1-6:vhhcap PCR扩增产物M: DL 2000 DNA Marker; Nc: negative control;1-6: PCR products of vhhcap segment图1 vhhcap基因片段PCR扩增结果Fig 1 Agarose gel electrophoresis results of PCR products
2.2 重组表达载体构建vhhcap目的片段分别与pCold-SUMO和pET32a(+)载体连接,连接产物分别转化E.coliDH5α感受态细胞,从过夜培养后的平板上随机挑取单菌落进行PCR鉴定,阳性重组菌PCR产物出现约400 bp的特异性扩增条带(图2)。
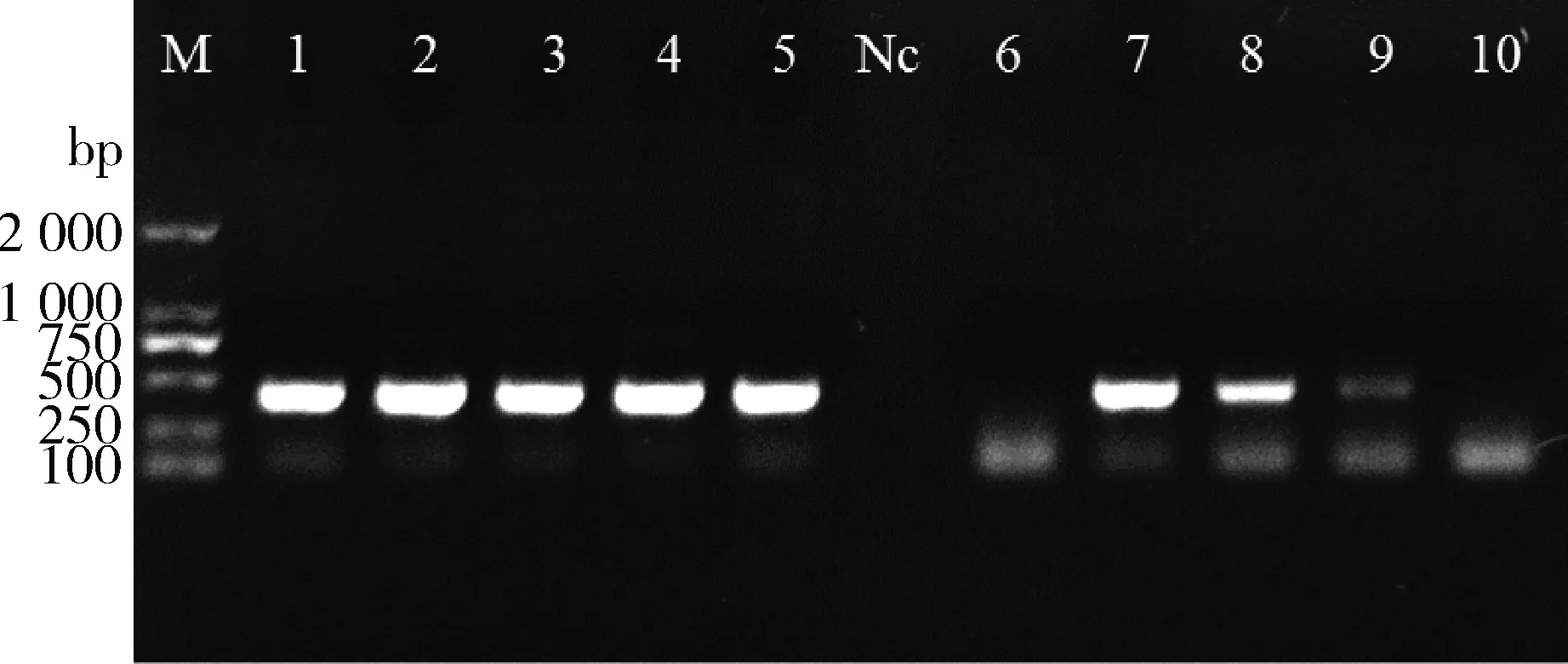
M:DL 2000 DNA Marker;Nc:PCR阴性对照;1-5:vhhcap-pCold-SUMO/DH5α重组菌PCR鉴定产物;6-10:vhhcap-pET32a(+)/DH5α重组菌PCR鉴定产物M: DL 2000 DNA Marker; Nc: PCR negative control;1-5: PCR products of vhhcap-pCold-SUMO/DH5αrecombinant bacteria;6-10: PCR products of vhhcap-pET32a(+)/DH5α recombinant bacteria;图2 重组菌菌液PCR鉴定结果Fig 2 Identification of recombinant bacteria by PCR method
2.3 VHHcap纳米抗体蛋白表达、纯化 经鉴定正确的vhhcap-pCold-SUMO和vhhcap-pET32a(+)重组质粒分别转化E.coliBL21(DE3)进行诱导表达。SDS-PAGE结果显示,VHHcap-pCold-SUMO重组蛋白为可溶性表达,在聚丙烯酰胺凝胶上呈现为约30 ku的蛋白条带(图3,泳道3),与预期目的蛋白大小相符;而未诱导菌在该位置无蛋白条带(图3,泳道1和2);VHHcap-pET32a(+)重组蛋白同样为可溶性表达,表达产物相对分子质量大于VHHcap-pCold-SUMO重组蛋白,蛋白条带位置略低于35 ku(图3,泳道6)。
按优化后的最佳表达条件分别利用pCold-SUMO和pET32a(+)载体对VHHcap纳米抗体重组蛋白进行大量表达,并使用Ni2+亲和层析柱进行纯化。取纯化前样品、流穿液以及纯化后的蛋白样品进行SDS-PAGE分析,结果显示,经亲和层析纯化后蛋白条带与未纯化的纳米抗体重组蛋白大小一致(图4-图5),流穿液中虽有少量目的蛋白存在,但大量VHHcap纳米抗体重组蛋白存在于洗脱液中,表明VHHcap-pCold-SUMO和VHHcap-pET32a(+)重组蛋白均纯化成功。

M:蛋白Marker;1:未诱导vhhcap-pCold-SUMO/BL21超声上清;2:未诱导vhhcap-pCold-SUMO /BL21超声沉淀;3:诱导vhhcap-pCold-SUMO /BL21超声上清;4:诱导vhhcap-pCold-SUMO超声沉淀;5:未诱导vhhcap-pET32a(+)/BL21;6:诱导vhhcap-pET32a(+)/BL21超声上清;7:诱导vhhcap-pET32a(+)/BL21超声沉淀M: Protein Marker; 1: supernatant after ultrasonication of non-induced vhhcap-pCold-SUMO/BL21;2: precipitation after ultrasonication of non-induced vhhcap-pCold-SUMO/BL21;3: supernatant after ultrasonication of induced vhhcap-pCold-SUMO/BL21;4:precipitation after ultrasonication of induced vhhcap-pCold-SUMO/BL21;5: non-induced vhhcap-pET32a(+)/BL21;6: supernatant after ultrasonication of induced vhhcap-pET32a(+)/BL21;7: precipitation after ultrasonication of induced vhhcap-pET32a(+)/BL21图3 两种表达载体对VHHcap重组蛋白表达结果SDS-PAGE分析Fig 3 SDS-PAGE analysis of VHHcap protein expressed by different vector
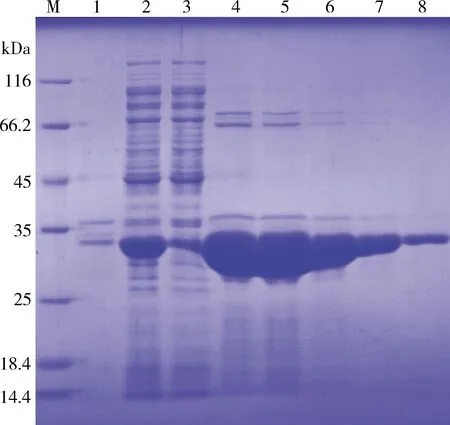
M:蛋白Marker;1:菌体超声破碎后离心沉淀;2:菌体超声破碎后离心上清;3:蛋白过柱流穿液;4-8:亲和层析纯化后的VHHcap蛋白M: Protein Marker; 1: precipitation after ultrasonication of induced vhhcap-pCold-SUMO/BL21;2: supernatant after ultrasonication of induced vhhcap-pCold-SUMO/BL21;3: flow-through of supernatant of cell lysate during loading;4-8: VHHcap recombinant protein after affinity purification图4 VHHcap-pCold-SUMO重组蛋白纯化结果SDS-PAGE分析Fig 4 SDS-PAGE analysis of VHHcap-pCold-SUMO recombinant protein after purification
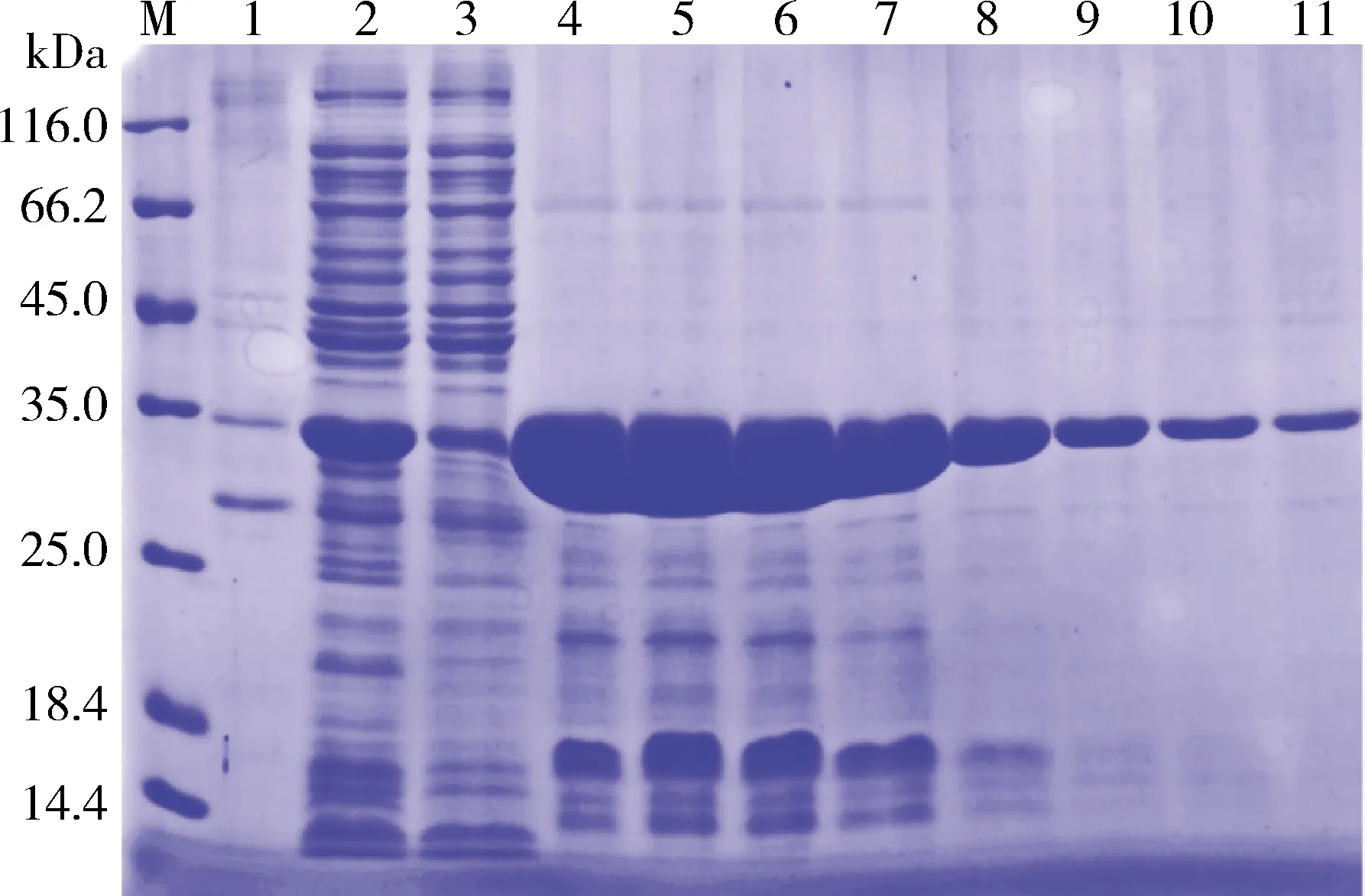
M:蛋白Marker;1:菌体超声破碎后离心沉淀;2:菌体超声破碎后离心上清;3:蛋白过柱流穿液;4-11:亲和层析纯化后的VHHcap蛋白M: Protein Marker; 1: precipitation after ultrasonication of induced vhhcap-pET32a(+)/BL21;2: supernatant after ultrasonication of induced vhhcap-pET32a(+)/BL21;3: flow-through of supernatant of cell lysate during loading;4-11: VHHcap recombinant protein after affinity purification图5 VHHcap-pET32a(+)重组蛋白纯化结果SDS-PAGE分析Fig 5 SDS-PAGE analysis of VHHcap-pET32a(+) recombinant protein after purification
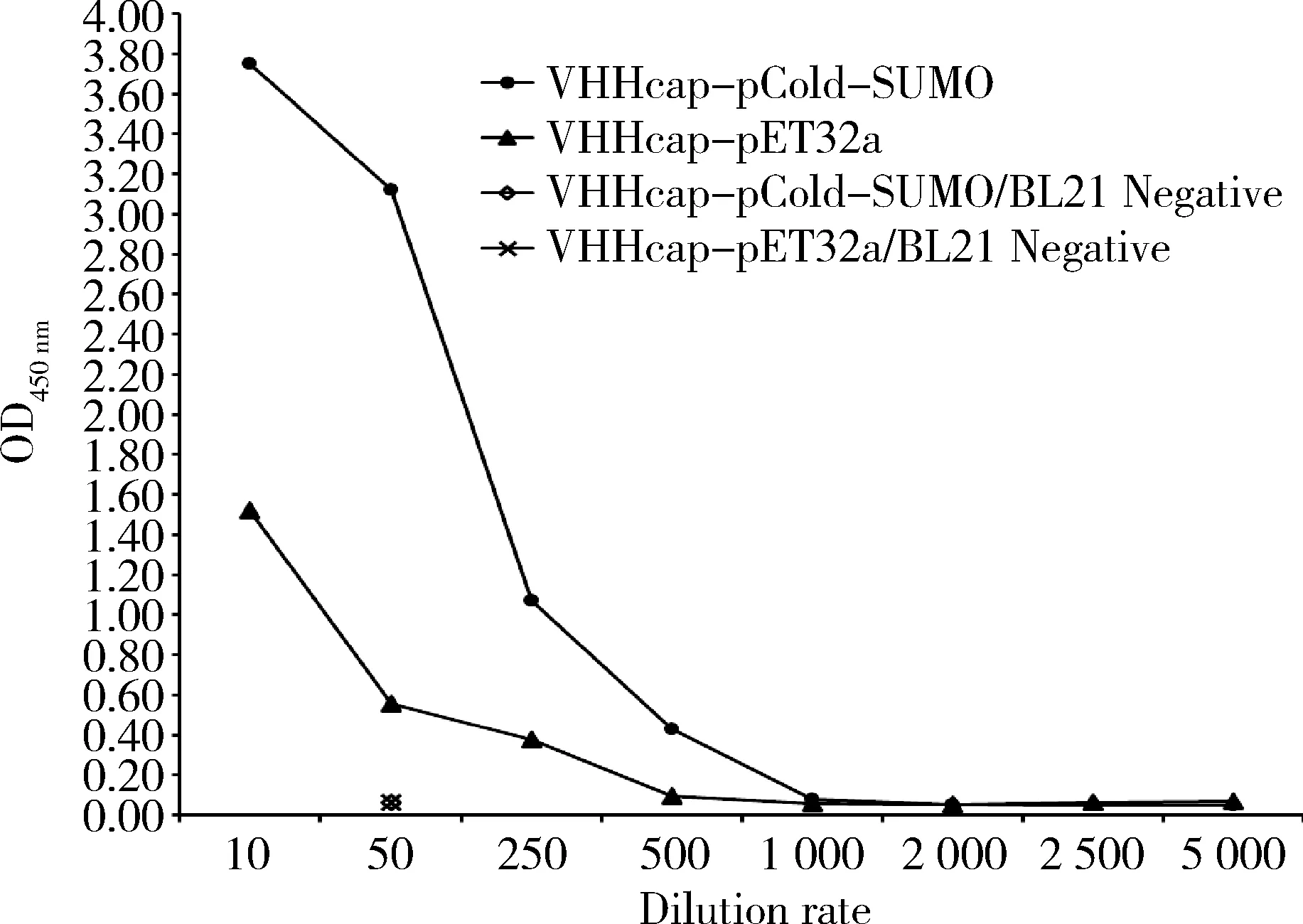
图7 不同载体表达的VHHcap ELISA反应效价鉴定Fig 7 ELISA titer identification of VHHcap expressed by different vector
2.4 Western blotting分析 将纯化后的VHHcap-pCold-SUMO和VHHcap-pET32a(+)纳米抗体重组蛋白分别进行Western blotting分析,结果显示,两种原核表达载体表达的VHHcap纳米抗体重组蛋白与抗His单克隆抗体反应活性良好,VHHcap-pCold-SUMO在约30 ku处可见一条明显的条带(图6,泳道2),VHHcap-pET32a(+)重组蛋白条带大小约35 ku(图6,泳道1、3和4),蛋白条带位置与SDS-PAGE结果一致,进一步确认纯化后的蛋白为含His-Tag的VHHcap纳米抗体重组蛋白,同时也表明可以利用His-Tag通过间接ELISA方法测定重组纳米抗体的反应活性。

M:预染蛋白Marker;1:VHHcap-pET32a(+)重组蛋白;2:VHHcap-pCold-SUMO重组蛋白;3-4:VHHcap-pET32a(+)重组蛋白;5:阴性对照M:prestained Marker;1:VHHcap-pET32a(+)recombinant nanobody;2: VHHcap-pCold-SUMO recombinant nanobody;3-4: VHHcap-pET32a(+) recombinant nanobody;5: Negtive control图6 VHHcap纳米抗体重组蛋白Western blotting分析Fig 6 Western blotting analysis of VHHcap recombinant protein
2.5 不同表达载体对VHHcap纳米抗体活性的影响纯化后的VHHcap-pCold-SUMO和VHHcap-pET32a(+)重组蛋白分别经BCA方法测定浓度,并将两种重组蛋白调整至相同初始浓度水平后再进行梯度稀释,然后与固相包被的Cap蛋白进行抗体—抗原反应。以OD450大于阴性对照吸光值3倍以上作为阳性判定标准,间接ELISA试验结果显示,VHHcap-pCold-SUMO纳米抗体重组蛋白ELISA效价为1∶500,而VHHcap-pET32a(+)纳米抗体重组蛋白效价为1∶250(图7)。相同浓度水平下VHHcap-pCold-SUMO重组蛋白的效价水平均高于VHHcap-pET32a(+)重组蛋白,推测不同原核表达载体可能对纳米抗体重组蛋白与抗原的结合活性产生影响。
3 讨论与结论
PCV2导致的猪圆环病毒相关疾病每年给养猪业造成巨大经济损失[1, 14],因此建立高效的PCV2诊断和治疗方法对该病毒的综合防控具有重要意义。纳米抗体技术的发展为PCV2的检测与治疗提供了有力工具。纳米抗体相对分子质量更小[15]的特点使其能够识别传统全分子抗体无法识别的隐蔽表位或小表位;同时,纳米抗体对热和酸碱有更强的抵抗力,稳定性更强[16],克服了传统抗体在使用过程中必须低温存储的劣势。将高密度纳米抗体固定于固相载体,良好的特异性使其具有避开复杂样本中的干扰因素结合更多配体的能力[17],能够捕捉微量抗原,可以极大提高检测的灵敏度。
本研究利用原核表达系统对PCV2 Cap特异性纳米抗体进行了表达制备,并比较了两种不同原核表达载体对纳米抗体ELISA效价的影响。结果显示,该纳米抗体片段在pCold-SUMO和pET32a(+)载体中均为可溶性表达,但两种不同载体表达的纳米抗体重组蛋白的ELISA效价存在差异:相同浓度条件下,VHHcap-pCold-SUMO重组蛋白的ELISA效价大于VHHcap-pET32a(+)重组蛋白。本研究中两种载体表达的纳米抗体重组蛋白均通过His标签进行纯化,SUMO蛋白作为重组蛋白表达的融合标签和分子伴侣,能够促进靶蛋白的正确折叠、提高重组蛋白的可溶性。有研究表明SUMO标签与MBP和His标签相比更适合作为纳米抗体原核表达的标签[18],本研究得到的结果与之相符。
由于纳米抗体基因为真核序列,利用大肠埃希菌表达纳米抗体基因过程中,大肠埃希菌与真核生物在密码子偏好性方面的差异可能导致纳米抗体重组蛋白不能正常表达。例如李玲霞等[19]利用大肠埃希菌表达抗CD133纳米抗体过程中多个纳米抗体序列未能表达,而冯凡等[20]利用大肠埃希菌表达了抗黄曲霉素B1独特型纳米抗体,表达产物主要以包涵体形式存在。本研究过程中也出现Cap蛋白特异性纳米抗体序列未能表达的现象,对于这部分纳米抗体序列,可以尝试通过密码子优化的方法使其正确表达。另外,从Cap特异性纳米抗体的ELISA反应效价来看,本研究制备的纳米抗体效价最高仅能到1∶500,后续研究需要进一步对淘洗出的纳米抗体序列进行表达与活性筛选,并将其制备成双价或多价纳米抗体,以进一步提高其亲和活性。
总之,纳米抗体由于其分子量小、特异性强、稳定性好、免疫原性低等独特优势,在疾病检测和治疗等方面已经被广泛应用[21],而在畜牧兽医及食品安全领域的应用则刚处于起步阶段。本研究通过大肠埃希菌原核表达系统实现了PCV2 Cap蛋白特异性纳米抗体的高效可溶性表达,为PCV2的检测及治疗提供了新型抗体工具。

