甜菜色素合成关键基因的克隆及不同光质对其表达的影响
(哈尔滨工业大学化工与化学学院,哈尔滨 150080)
0 前言
食用甜菜的栽培历史远远早于糖甜菜,早已成为欧美国家的重要蔬菜之一。甜菜中主要含有两种色素,即甜菜红色素和甜菜黄色素,这两种色素均为水溶性含氮生物碱类色素。到目前为止,已经从17 种植物中鉴定出了75种甜菜色素结构[1-3]。研究发现甜菜色素与同为植物天然色素的花青素相互排斥。甜菜色素作为天然色素在食品、饮料、化妆品、医药等领域均有广泛应用。特别是由于其具有抗氧化、清除自由基功效及潜在的抗肿瘤、保肝等作用而越来越受到人们的重视[4-5]。在甜菜色素合成途径中,酪氨酸酶(Tyrosinase,TYR)和UDP-葡糖基转移酶(UGT)是两个重要的色素合成基因。酪氨酸酶(TYR)是一类重要的、特殊的酚氧化酶(PO),具有单酚酶(MPO)活性[6]。研究发现多酚氧化酶(PPO)类型的酪氨酸酶(TYR)可能与甜菜色素合成的第一步酶促反应密切相关,酪氨酸酶(TYR)的活性可精确地高度调控甜菜色素的形成。酪氨酸酶(TYR)的转录已在某种植物中检测到[7]。糖基转移酶(GTs)是生物有机体催化特定的糖基与受体之间形成糖苷键的多成员的转移酶家族,是广泛存在于内质网和高尔基体内的一大类酶类[8]。UDP-葡糖基转移酶(UGT)是甜菜红色素合成过程中的关键酶,当甜菜苷配基生成甜菜苷时必须借助糖基转移酶催化。葡萄糖作用于甜菜苷配基中两个羟基中的一个便可以生成甜菜苷[9]。另外,对紫茉莉的研究显示,UDP-葡糖基转移酶(UGT)也参与甜菜色素的代谢。证明糖基与其转录物的积累和色素形成存在相关性[10]。糖基转移酶的活性和酶转录物数量均与甜菜苷的积累呈正的相关关系。鉴于这两个酶在甜菜色素合成过程中的众多作用,本文试图进一步探明UDP-葡糖基转移酶基因(UGT)、酪氨酸酶基因(TYR)在甜菜苗期的表达及不同光质对基因表达和甜菜色素合成的影响,进而明确甜菜色素合成的机理。
1 材料与方法
1.1 材料
供试甜菜:食用甜菜品种‘工大食甜1号’。
引物:本试验所用引物及序列见表1,均参考Genbank上已知的基因序列设计(由上海生工生物工程技术服务有限公司合成)。

表1 试验所用引物Table 1 Primers used in the experiment
1.2 方法
1.2.1 甜菜UGT及TYR基因的生物信息学分析
利用在线软件对试验中获得的甜菜UGT和TYR基因序列进行生物信息学分析(Bioinformatics analysis)。利用ExPASy ProtParam 工具进行蛋白理化性质和氨基酸序列分析;利用BLASTP 软件分析UGT 和TYR 氨基酸序列同源性高的序列;利用Plant-mPLoc 软件和Conserved Domain Search工具对两种蛋白的亚细胞定位情况和保守区进行预测与分析;利用NetPho 2.0 Serve(http://www.cbs.dtu.dk/services/NetPhos)、SignaIP4.1 Server及TMpred Server 软件(http://www.ch.embnet.org/software/TMPRED-form)对两种蛋白磷酸化位点、信号肽及跨膜结构进行预测分析[11]。
1.2.2 甜菜UGT及TYR基因的启动子克隆
启动子的克隆对于构建基因工程载体、表达目的蛋白具有重要意义。本试验启动子克隆采用的是染色体步移技术,即由生物基因组或其文库中的已知序列开始逐步探知其邻近呈线性关系的目的序列核苷酸,可有效克隆己知序列侧翼未知序列[12]。利用在线软件Promoter 2.0(http://www.cbs.dtu.dk/services/promoter)和plantCARE预测UGT和TYR基因启动子可能的转录起始位点和顺式作用元件。
1.2.3 不同光质下甜菜幼苗的培养与甜菜色素的测定
甜菜幼苗置于培养箱中在温度24~27℃、16 h/d 光照条件下培养;设自然光(NL)、红(RL)、绿(GL)、蓝(BL)4种不同光质(光强14 W)进行处理,自然光(NL)为对照。
在甜菜播种后第七天进行第一次取样,随机选取10株甜菜幼苗冻存(-80℃冻存),用于检测;之后,每隔7 d取样一次,共取样5次。将各样品进行甜菜红色素提取与测定,方法参照文献[13]。
1.2.4 qRT-PCR分析
试验所用qRT-PCR 仪型号为ABI 7300;所用试剂为:SYBR®Premix Ex Taq II(Tli RNaseH Plus),方法参照试剂盒说明书;每个样品进行3次生物重复和2次技术重复。采用生物学软件Primier5.0设计引物,内参基因为BvICDH。
2 结果与分析
2.1 甜菜UGT和TYR基因的测序
基因组是一个物种所有基因的整体组成,基因是遗传信息的物理和功能单位,包含一条多肽链及功能RNA 所必需的所有核苷酸序列。根据NCBI中数据库查找得到甜菜UGT、TYR基因序列,并进行1.0%琼脂糖凝胶电泳(AGE)PCR 扩增。由图1 可知,PCR 扩增结果所得片段的大小与目的基因基本一致,因此进行下一步试验,将PCR后胶回收、连接载体、转化感受态,PCR后选择阳性样品进行测序。

图1 甜菜UGT和TYR基因PCR电泳结果Fig.1 Electrophoresis results of UGT and TYR gene PCR of beet
再通过NCBI的BLAST软件进行序列比对,得到甜菜UGT和TYR基因与测序结果的相似性,结果相似度较高(98%~99%)。据此推断所得基因为目的基因序列,可进行下一步试验。UGT基因的具体测序结果及TYR基因具体的测序结果略。
2.2 甜菜UGT、TYR基因及启动子的生物信息学分析
2.2.1 甜菜UGT及TYR基因cDNA核苷酸序列分析
对甜菜UGT基因的cDNA 序列进行生物信息学分析(Bioinformatics analysis)表明,该基因cDNA 全长1 878 bp,ORF 长1 461 bp,5′、3′-UTR分别为194 bp 和223 bp。TYR 基因cDNA 全长为2 049 bp,ORF 长181 bp,5′、3′-UTR分别为89 bp 和149 bp。两基因的起始和终止密码子分别为ATG 和TGA,表明该阅读框架是完整的。
2.2.2 甜菜UGT及TYR基因编码蛋白的同源性分析
大部分已测序的植物其重复序列都达到或超过整个基因组的50%[14]。经过BLAST 进行序列同源性分析,得到甜菜UGT、TYR基因序列与其他植物序列的同源性,其中与鸡冠花(Celosia cristataL.)的同源性为80%,籽粒苋(Amaranthus hypochondriacusL.)76%,三色苋(Amaranthus tricolor)75%,叶子花(Bougainvillea spectabilis)70%。甜菜TYR基因与盐地碱蓬[Suaeda salsa(L.)Pall.]的同源性为73%,甜橙[Citrus sinensis(L.)Osbeck.]1%,马齿苋(Portulaca oleraceaL.)和胡杨(Populus euphratica)均为67%。均不是很高。
2.2.3 甜菜UGT及TYR基因编码的氨基酸序列分析
通过ExPASY 网站UGT 氨基酸序列分析可知,其蛋白分子量为154 248.20,属酸性蛋白,其等电点(pI)4.99,分子式为C5713H9550N1878O2425S340,属于稳定疏水性蛋白,脂肪指数为27.96。TYR氨基酸序列的蛋白分子量为172 451.35,属于酸性蛋白,其等电点(pI)4.91,分子式为C6311H10575N2049O2619S480,属于稳定疏水性蛋白,脂肪指数为29.04。
2.2.4 甜菜UGT及TYR基因编码蛋白保守区预测和分析
利用在线分析工具Conserved Domain Search 对甜菜UGT及TYR基因编码蛋白保守区预测和分析(见图2),该序列属于Glycoyltransferase GTB type家族基因一员,编码477 个氨基酸。氨基酸序列与NCBI家族成员PLN02863相似度较高。糖基化反应是自然界最为广泛的一类化学发应,UGT可催化糖从活化的供体分子转移到特定受体分子位点形成糖苷键[10]。所形成不同结构的糖缀合物(Glycoconjugates)多样性非常丰富,各执行不同的生物学功能。该家族的成员具有常见的GTB拓扑结构,其是针对核苷酸糖依赖性UGT观察到的两种蛋白质拓扑之一。
由图3 可以看出TYR基因序列与Tyrosinase家族基因的相似度最高,编码209 个氨基酸,氨基酸序列与NCBI 中家族成员pfam00264相似度较高。该家族含有血蓝蛋白(KLH)和多酚氧化酶(PPO),将3 个组氨酸(His)绑定两个Cu2+。该家族也与pfam00372相关。编码131 个氨基酸,氨基酸序列与PPO1-KFDV基因编码的pfam12143序列相似。通常这种结构域家族只存在于真核生物中,其长度为138~152 个氨基酸。有研究表明,该家族成员多为PPO,包含有一个高度保守的序列基序:KFDV。该基序为氧化酶的C-末端结构域。该基因序列编码51个氨基酸,与PPO1-DWL基因序列相似。其结构域属于PPO的中间结构域。
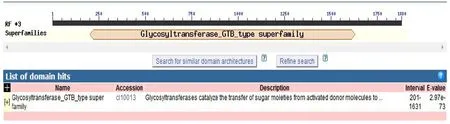
图2 甜菜UGT基因编码蛋白保守区预测和分析Fig.2 Prediction and analysis of conserved region of UGT gene-coding protein of beet

图3 甜菜TYR基因编码蛋白保守区预测和分析Fig.3 Prediction and analysis of conserved region of TYR gene-coding protein of beet
2.2.5 甜菜UGT及TYR基因编码蛋白亚细胞定位预测
通过在线氨基酸分析工具TargetP 1.1(http://www.cbs.dtu.dk/services/TargetP)对甜菜UGT、TYR基因编码蛋白进行亚细胞定位预测分析(表2)可知,序列含有叶绿体转运肽(cTP)、线粒体靶向肽(mTP)、分泌信号肽(SP);可信度(RC)等级为1~5,5表示RC最低;甜菜UGT、TYR基因编码蛋白的预测可信度(RC)分别为5和3级,二者可能存在于叶绿体、线粒体或其他组织中。

表2 甜菜UGT 基因和TYR 基因编码蛋白亚细胞定位预测Table 2 Prediction of UGT gene and TYR gene encoding protein subcellular localization of beet
2.2.6 甜菜UGT及TYR基因编码蛋白信号肽预测
SignalP 是信号肽预测服务器,可预测给定的氨基酸序列中是否存在潜在的信号肽剪切位点。通过该软件对甜菜UGT 蛋白进行信号肽预测,UGT基因的Y 值最高点位于22 bp 处,S 均值和D 均值分别为0.734 和0.575,因此属于分泌信号肽(SP)。TYR基因的Y 值最高点位于39 bp 处,S 均值和D 均值分别为0.451 和0.355,D 值较低,不属于信号肽。
2.2.7 启动子测序
测序结果分析表明,所获得UGT基因的启动子序列,其3′端1 136~1 158 bp的23 bp与甜菜UGT基因5′端156~178 bp 处的序列完全一致,因此判定该序列为UGT基因启动子序列。获得了该UGT基因起始密码子上游1 202 bp 的全长序列。通过Promoter2.0 软件测定分析可知,UGT基因启动子可能的转录起始位点处于起始密码子上游约500 bp,其可信度值(0.718)很高。甜菜TYR基因启动子序列的3′端1 052~1 099 bp的48 bp 与其5′端1~48 bp 处的序列完全相同,由此可推测此为甜菜TYR基因启动子序列。据此获得了甜菜TYR基因起始密码子上游1 163 bp的全长序列。
使用Plantcare对UGT及TYR基因启动子序列进行在线分析可知,使用Plantcare软件对UGT及TYR基因启动子序列进行分析可知,UGT基因测得TATA-box、CAAT-box、ABRE、W-box、ACE、G-Box、AE-box、MNF1、Sp1、ATCT-motif、CG-motif、GA-motif、GATA-motif、TCT-motif 共14 个启动子元件;TYR基因测得TATA-box、CAAT-box、ABRE、W-box、ACE、G-box、Box I、GT1-motif、TCA-element 共9 个启动子元件。两基因启动子序列中共有的响应元件为:TATA-box、CAAT-box、ABRE、W-box、ACE、G-box,其中TATA-box 和CAAT-box 为核心响应元件;ACE 和G-box 为光响应元件;ABRE 和W-box 为酸类化学调节物质响应元件。由此推测出甜菜UGT、TYR基因的表达对不同光质和有机酸类化学调节物质较为敏感。
2.3 不同光质对甜菜生理指标的影响
研究发现,红光(RL)、绿光(GL)和蓝光(BL)处理均会对甜菜幼苗的生长产生抑制作用。不同光质对甜菜幼苗鲜重和株高方面的影响,RL 的抑制作用最为明显,生长几乎停滞;GL 和BL 相比,抑制作用差异不显著。幼苗叶面积方面,RL 的抑制作用最为明显,叶面积生长几乎停滞,这也与鲜重及株高的生长停滞相一致;而GL和BL的抑制作用差异不显著。
研究表明,不同光质对不同植物的影响效应不尽相同,总体上对高等植物的光合速率影响大小为:RL>BL>GL[15]。BL 和NL 可诱导苋菜分化出红色愈伤组织,BL 最有利于愈伤组织中甜菜色素的合成[16]。本试验如图4,不同的光处理对甜菜色素含量有显著影响,其总体变化趋势均为先上升后下降。RL处理下降的拐点在21 d,而蓝、绿、自然光处理下降是在28 d后。色素含量在BL和NL处理下较高,而在RL和GL处理下则明显降低,其中BL处理最高,RL处理最低,BL处理是RL处理的5倍左右,这说明短波长有利于色素的积累。

图4 不同光质对甜菜幼苗色素含量的影响Fig.4 Effects of light type on pigment content of beet seedlings
2.4 不同光质对甜菜幼苗期UGT及TYR基因表达的影响
2.4.1 不同光质对UGT基因表达量的影响
在不同光质的处理下,UGT基因表达量差异较大。GL和BL处理下,UGT基因表达量的变化趋势几乎一致,这可能是由于二者的波长差别相对较小,在甜菜幼苗28~35 d期间UGT基因表达量呈增长趋势;BL处理下的UGT基因表达量略高于GL,甜菜幼苗在21 d前,UGT基因的表达量均低于NL,但之后则表现上调;说明较短波长的光有利于基因的表达。GL处理下的UGT基因表达量直到28 d后才迅速上升,高于NL处理。RL处理下,幼苗初期就具有很高的UGT基因表达量,可达到NL的约1.6倍,推测甜菜幼苗初期可能就具备了基因表达途径中的某种关键物质,其在长波长光条件下被激发,促进了基因表达量的上调;随着幼苗的生长,该物质量减少,因此表达量急剧下降,至14 d低于NL 处理,之后表达量便进入平稳期,与BL、GL处理下的变化趋势一致。另外,光敏色素(Phytochrome,Phy)是RL的光受体,也是光调节色素累积的一个途径[17],这也可能是UGT基因在RL处理下上调表达的机制。
此外,可以看到,在3种光的照射条件下,甜菜幼苗在14 d和28 d时,UGT基因表达量均出现了增速明显减慢或者下调的现象,3种光均出现了同种现象,由此推测可能是由于幼苗生长发育阶段本体生长代谢因素所致[18]。
2.4.2 不同光质对TYR基因表达量的影响
在不同光质的处理下,甜菜TYR基因表达量区别较大,但总体上均处于上升趋势。RL和BL处理下TYR基因表达量上调趋势均较缓慢,BL 处理下幼苗在7~14 d 增长快速;RL处理下在21~28 d增长快速,之后基因表达呈现下调。GL 处理下,甜菜TYR基因表达量在幼苗初期上升缓慢,14 d 后上升速率明显直到35 d,TYR基因表达量可达NL的约20倍,说明GL处理可有效地促进该基因的表达。
在3种光处理条件下,甜菜TYR基因的表达量不同于UGT基因,几乎一直高于NL处理,说明3种单色光均可有效激发甜菜TYR基因的表达,其中GL处理效果最佳。
2.4.3 甜菜UGT与TYR基因表达量差异
以上结果表明,UGT、TYR基因在甜菜色素合成途径中发挥着重要的作用,其表达水平受光调控明显。BL 处理下,甜菜色素含量显著增加,同时UGT、TYR基因的表达量也出现明显的上调,这说明短波长光质有利于甜菜色素的积累和UGT、TYR基因的表达。有研究发现BL处理促进苋红素的累积,而远红光(FR)却能逆转合成的色素,本试验结果与此一致[19]。本试验,GL 处理下,TYR基因表达量明显上调,而UGT基因前期一直处于下调阶段,后期才出现了上调,与NL处理比甜菜色素的含量明显下降,说明较长波长不利于甜菜色素的合成。在RL 处理下,TYR基因表达量明显上调,而UGT基因呈现抛物线形上调特点,色素含量明显下降至所有处理最低,此时UGT基因后期显著上调,可能是由于色素含量减少引起的反馈调节[19-20]。综上所述,UGT基因表达量的变化与色素含量的变化趋势较为一致,而TYR基因表达量则一直处于上调阶段,这可能是由于酪氨酸是合成醛氨酸(Betalamic acid)的起始底物,酪氨酸酶活性虽在色素合成的初期发挥重要作用,但由于后续反应中的关键物质缺失等因素,导致了色素含量并未上升[21-22]。
3 结论
(1)甜菜UGT、TYR基因的启动子序列中均包含有典型的启动子核心元件TATA-box 和CAAT-box,调控有机酸的顺式作用元件W-box 和ABRE,G-Box 和ACE 等与光响应和调节紧密相关的响应元件。推测甜菜UGT及TYR基因的表达对光照及各种激素类化学物质较为敏感。
(2)在不同的光质处理下,红光(RL)、绿光(GL)和蓝光(BL)均会对甜菜幼苗的生长产生抑制作用,红光(RL)处理的抑制作用最强;绿光(GL)和蓝光(BL)处理的抑制作用差异不显著。
(3)甜菜色素含量及UGT、TYR基因的表达水平受光调控明显。短波长光质有利于色素的积累,蓝光(BL)处理下,甜菜色素含量明显上升,UGT、TYR基因的表达量也呈现显著上调;绿光(GL)处理下,甜菜色素的含量相比自然光(NL)明显下降,TYR基因表达量显著上调,而UGT基因前期表现为下调,后期才呈现上调,说明较长波长不利于甜菜色素的合成。红光(RL)处理下,远红光反而逆转合成的色素,色素含量显著下降至各处理最低,UGT基因后期显著上调,可能是由于色素含量减少引起的反馈调节。

