依托咪酯胶束溶液的制备及体内麻醉效果*
吴爱玲,王滢莹,刘浩
(1.四川省内江市第一人民医院麻醉科,内江 641000;2.西南医科大学临床医学院临床医学系,泸州 646000;3.西南医科大学药学院,泸州 646000)
依托咪酯(etomidate)是一种快速催眠性麻醉药,相比于丙泊酚、咪达唑仑等其他多种静脉麻醉药物,其对人体循环和呼吸系统的影响较小[1-3],且安全剂量范围更宽[4-5],尤其适用于老年、高血压、冠心病及休克患者。但依托咪酯水溶性差,不宜直接静脉注射,限制了其临床应用。另外,依托咪酯能与11β-羟化酶紧密结合,可抑制肾上腺皮质激素生物合成[6-7]。因此,临床不推荐长时间持续输注依托咪酯以维持麻醉。与其他全身麻醉药相比,该药主要用于单次静脉注射麻醉诱导。依托咪酯是一种水溶性较差的酯类小分子药物,不宜直接用于注射。此外,存在于脑微血管内皮细胞膜上的P-糖蛋白(P-glycoprotein,P-gp)可能抑制依托咪酯从血液到脑内的转运,从而影响依托咪酯发挥药效[8]。
目前临床使用的依托咪酯丙二醇溶剂注射液和脂肪乳注射液主要解决了该药物的难溶性问题。但丙二醇可引起一系列不良反应,如注射疼痛、乳酸性酸中毒和血栓性静脉炎等[9]。脂肪乳注射液虽不使用丙二醇,并且对机体刺激更小[10],但笔者前期研究发现,其对药物的释放缓慢,不利于全麻药物所要求的快速起效和快速恢复[11]。因此,提高依托咪酯水溶性并实现药物快速起效和快速恢复是一个重要的课题。
近年来,基于脂质体和聚合物胶束等的纳米制剂已被积极地用于改善疏水性药物的水溶性。这些纳米载体在水性溶液中具有良好的分散性,并可能实现选择性的药物生物分布和控制药物释放,从而提高药效并减少药物副作用[12]。因此,使用适当的纳米载体包封依托咪酯可能是解决该药物问题的方法。但截止目前,仅极少数纳米载体可以很好地满足全身麻醉药的要求,因为亲水性配方由于其亲水性和不合适的尺寸而经常遇到穿透血-脑屏障 (blood-brain barrier,BBB)的问题[11]。一般来说,依托咪酯的理想纳米载体不仅能够对药物增溶,而且应具有良好的生物相容性,能够促进依托咪酯通过BBB,并能以适当速率释放药物。笔者在之前的研究中发现,由普郎尼克(Pluronic®)形成的胶束可能是依托咪酯递送的良好载体。基于普郎尼克的纳米载体长期以来一直被用于各种抗癌药物的增溶和靶向递送[13],近年来,使用不同种类普郎尼克来递送中枢神经系统 (central nervous system,CNS)药物的试验取得了很好效果[14-15]。据报道,普郎尼克能够抑制大脑P-gp和多药耐药蛋白(multidrug resistance-associated proteins,MRPs)等药物外排转运蛋白[16]。这种抑制作用可能是普郎尼克通过促使血脑屏障上膜流态化(抑制P-gp的ATP酶活性)和能源耗竭(降低可供P-gp和MRPs运用的ATP)这两方面实现的[17]。因此,用普郎尼克胶束包封依托咪酯可能是增强药物向脑内递送的一种行之有效的方法,同时还可以减轻该药物不良反应。
笔者在本研究制备一种依托咪酯普郎尼克胶束溶液(EtoPM),并研究其对大鼠的镇静作用,现报道如下。
1 材料与方法
1.1仪器 Nano ZS粒度仪(英国Malvern公司);XR205SM-DR微量电子天平(瑞士Precisa公司,感量:0.01 mg);H-7500透射电子显微镜(日本Hitachi公司);Exceed-Cb-20超纯水机(成都唐氏康宁科技发展有限公司);CJ-882A磁力搅拌器(苏州金怡仪器科技有限公司);KQ5200DE数控超声波清洗器(昆山市超声仪器有限公司);YRE-2000旋转蒸发仪(巩义市予华仪器有限责任公司);ZRS-8GD智能溶出试验仪(天津市天大天发科技有限公司);A390紫外可见分光光度计(上海翱艺仪器有限公司)。
1.2试药 依托咪酯(上海阿拉丁生化科技股份有限公司,含量≥98%,批号:D1706033);依托咪酯乳状注射液(江苏恩华药业股份有限公司,批号:20180724);普郎尼克F68(平均分子质量8400 Da,上海阿拉丁生化科技股份有限公司,批号:J1625069);磷酸盐缓冲液(PBS)干粉(无锡市傲锐东源生物科技有限公司,批号:WK173327-1)。
1.3实验动物与分组 SD大鼠,无特定病原体(SPF)级,体质量(250±20) g,40只,雌雄各半,由西南医科大学实验动物中心提供,实验动物生产许可证号:SCXK(川)2018-017,实验动物使用合格证号:SYXK(川)2018-065。将雌雄大鼠各采用随机数字表法随机分配入EtoPM组和依托咪酯乳状注射液组,每组20只。
1.4方法
1.4.1依托咪酯胶束溶液的制备 采用薄膜水化法[18-19]制备依托咪酯胶束溶液。称取依托咪酯晶体10 mg,普郎尼克F68 240 mg,共同溶解于三氯甲烷2 mL。将所得溶液注入50 mL圆底烧瓶,利用旋转蒸发仪除去有机溶剂,于烧瓶内壁形成混合物薄膜。在形成薄膜的圆底烧瓶中加入PBS(pH值7.3) 10 mL,适当振荡并以超声(200 W)促溶,使薄膜完全溶解,形成胶束增溶的依托咪酯溶液,再将各样品溶液以孔径0.45 μm微孔滤膜滤过,即得无色澄清EtoPM溶液。
1.4.2载依托咪酯胶束粒径和Zeta电位的检测 将EtoPM溶液样品稀释2倍后,粒度仪测定胶束粒径分布和Zeta电位,相同实验条件下重复3次。
1.4.3载依托咪酯胶束的形态观察 利用透射电子显微镜 (transmission electron microscope,TEM)观察胶束颗粒形态。将EtoPM胶束溶液稀释5倍后,滴于镀有碳膜的铜网上,待自然干燥后,通过TEM观察,记录图像。
1.4.4依托咪酯标准曲线的绘制 精密称取不同质量依托咪酯,置25 mL量瓶,用PBS (pH值7.3)定容,得到5,10,15,20,30和40 mg·L-1依托咪酯溶液。以PBS (pH值7.3)作为参比,通过全波长扫描得依托咪酯于243 nm波长处有最大吸收峰,因此将波长固定在243 nm处,测量各浓度样品溶液在该波长下的吸光度(A)。通过线性回归,得到A值相对于依托咪酯浓度(C)的标准曲线方程。
1.4.5胶束载药量与包裹率检测 采用离心超滤法,取新制的EtoPM胶束溶液4 mL于离心过滤管(截留分子量3000 Da)中,3500 r·min-1(r=7.5 cm)离心5 min。将滤液吸出,并以PBS (pH值7.3)稀释适当倍数后测定其在243 nm波长下吸光度,并根据标准曲线计算出游离药物的浓度,从而得到包裹的药量,相同实验条件下重复3次。根据以下公式计算载药量与包裹率:载药量(%) = 包裹药量/(包裹药量+投入载体材料量) × 100%;包裹率(%)=包裹药量/投入总药量×100%。由于离心过程可能对胶束包裹率造成不利影响,另以加压超滤法验证胶束载药量与包裹率。取新制的EtoPM胶束溶液10 mL于Amicon超滤杯(Millipore 8050型,配截留分子量3000 Da超滤膜)中,以杯盖封口后,从杯盖上方气孔通入氮气加压(保持气压在约500 kPa)。取滤液1 mL,并以PBS稀释适当倍数后,按照上述方法检测游离药物浓度。相同实验条件下重复3次,并按照上述公式计算载药量与包裹率。
1.4.6体外药物释放行为 透析法考察样品中依托咪酯释放速度。将适量EtoPM样品溶液或依托咪酯乳状注射液(各含依托咪酯10 mg)以PBS (pH值7.3)稀释至等体积后注入纤维素透析袋(截留分子量为2500 Da)中密封好。置于37 ℃恒温水浴溶出仪,以PBS (pH值7.3)为释放介质,100 r·min-1搅拌。于0.25,0.5,1,2,3和4 h,分别取透析外液2 mL,同时补充新鲜释放介质2 mL。测定透析外液在243 nm波长下吸光度,并根据标准曲线计算释放出透析袋的累积药量,进而得到各时间点药物释放百分比,相同实验条件下重复3次。
1.4.7动物实验 通过大鼠翻正反射实验评价依托咪酯胶束溶液体内麻醉效果[20-21]。取“1.3”项下两组大鼠,分别通过尾静脉一次性注射EtoPM溶液或市售依托咪酯乳状注射剂(以药物计,2.85 mg·kg-1)麻醉,10 s内注射完毕,并迅速置于仰卧位,以注射完毕到大鼠前爪翻正反射消失时间为起效时间。以前爪翻正反射消失到前爪翻正反射恢复时间为自然苏醒时间。

2 结果
2.1EtoPM胶束粒径、形态与Zeta电位 粒度仪检测结果表明,EtoPM胶束平均粒径 (85.53±10.25) nm(图1),Zeta电位(-4.31±1.04) mV。透射电镜图像(图2)显示,载依托咪酯胶束成形良好,外观形态圆整,粒径大小较均匀。
2.2依托咪酯标准曲线 根据各浓度样品溶液在波长243 nm下A值,通过线性回归,得A值相对于依托咪酯浓度(C)的标准曲线方程:A=0.045 9C+0.005 0(r2=0.999 9)。结果依托咪酯浓度在5~40 mg·L-1内与C线性关系良好。

图1 EtoPM胶束粒径分布图
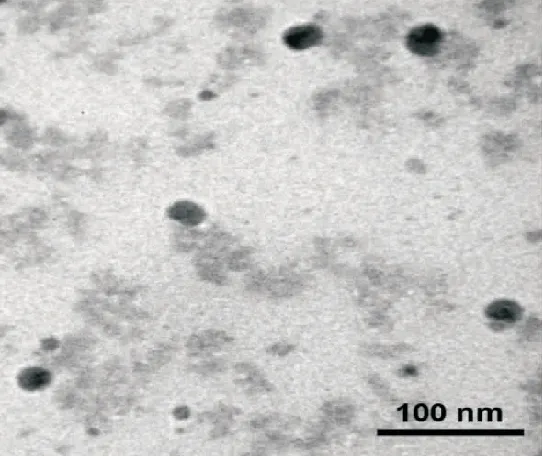
图2 EtoPM胶束透射电镜图像
2.3EtoPM胶束载药量与包裹率 采用离心超滤法所得胶束载药量为(2.96±0.07)%,胶束对药物包裹率为(73.14±1.85)%。采用加压超滤法所得胶束载药量为(3.01±0.06)%,胶束对药物包裹率为(74.49±1.62)%。两种方法所得结果之间差异无统计学意义(P>0.05),说明离心超滤法中的离心过程对胶束包裹未产生显著影响。
2.4胶束溶液的体外药物释放 EtoPM溶液和市售依托咪酯乳状注射液在不同时间点的药物累积释放百分数见图3。通过t检验分析两组在第4小时时药物释放百分数之间的差异。结果表明,市售依托咪酯乳状注射液药物释放较慢,其在4 h后平均累积释放量仅约28%。而EtoPM胶束溶液对依托咪酯释放速度较快,4 h后平均累积释放量接近80%,显著高于依托咪酯乳状注射液累积释放量(P<0.01)。因此,EtoPM溶液比市售依托咪酯乳状注射液有显著更快的释药速度。
2.5EtoPM溶液的体内药效 EtoPM组(n=20)和依托咪酯乳状注射液组(n=20)起效时间分别为(8.65±1.46)和(9.15±2.25) s。t检验分析显示,两组起效时间差异无统计学意义(P>0.05)。两组大鼠单次尾静脉注射后前爪翻正反射均迅速消失,表明EtoPM与依托咪酯乳状注射液均能在体内快速起效。EtoPM组和依托咪酯乳状注射液组麻醉后苏醒所需时间分别为(514.7±77.9)和(587.3±57.4) s。通过t检验分析两组麻醉后苏醒所需时间差异,结果表明,与依托咪酯乳状注射液比较,EtoPM溶液显著缩短了大鼠麻醉后苏醒所需平均时间(P<0.01)。此外,EtoPM组内雄性大鼠与雌性大鼠麻醉后苏醒时间分别为(547.6±75.6)和(481.7±68.4) s,差异无统计学意义(P>0.05)。依托咪酯乳状注射液组雄性大鼠与雌性大鼠麻醉后苏醒时间分别为(611.6±58.6)和(563.0±47.1) s,差异无统计学意义。因此,本实验条件下,大鼠性别对两组药物麻醉后苏醒所需时间均无显著影响。
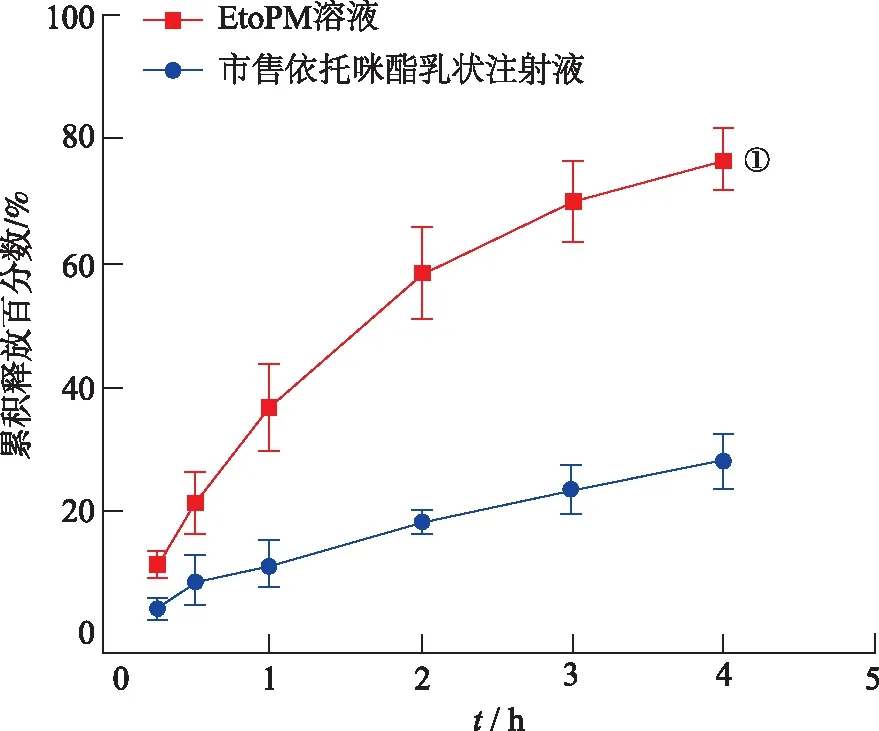
①与市售依托咪酯乳状注射液比较,t=13.22,P<0.01。
图3 依托咪酯的体外释放曲线(n=3)
①Compared with commercially available etomidate emulsion injection,t=13.22,P<0.01.
Fig.3 Invitrorelease profile of etomidate(n=3)
3 讨论
依托咪酯是临床应用最广泛的静脉麻醉药物之一。依托咪酯水溶性较差,提高依托咪酯水溶性是增强其药效的关键。胶束适用于疏水性药物的增溶,且随着胶束浓度的增加,药物的表观溶解度通常会相应增加。在20 ℃的PBS中,12 mg·mL-1普郎尼克F68即可以使依托咪酯表观溶解度增加至1 mg·mL-1。为保证胶束溶液稳定性,笔者在本研究采用较为过量的普郎尼克制备依托咪酯胶束溶液EtoPM。
同时,笔者对EtoPM溶液理化性质进行了研究。粒度仪测量结果显示,EtoPM胶束平均粒径约85 nm。电子显微镜下所观察到的胶束粒径(约25 nm)比粒度仪所测数据明显更小,这主要是因为粒度仪利用动态光散射 (dynamic light scattering,DLS)原理测量在溶液状态下的胶束粒径,其值包含了颗粒表面附着的溶剂化层;而透射电子显微镜下观察到的是干燥后的胶束颗粒,无溶剂化层,颗粒在干燥过程中可能发生一定程度的收缩,故而其数值比粒度仪所测值更小。此外,EtoPM胶束表面略带负电,这主要是由普郎尼克分子两端的羟基在水中发生部分解离产生的。
笔者在本研究考察普郎尼克胶束增溶后药物的释放行为。结果表明,与目前市售依托咪酯乳状注射液相比,普郎尼克胶束溶液能更快地释放药物。乳状注射液释药缓慢的主要原因可能与制含大豆油有关。大豆油不溶于水,在乳剂中作为油相,能较好地溶解依托咪酯,但其与药物之间较强的疏水相互作用也会使得药物难以离开油相而释放到水相中。与大豆油相比,普郎尼克分子具有一定的亲水性,与依托咪酯的疏水相互作用更小。此外,胶束增溶后的药物分子状态并不是静止的,而是动态平衡的,即药物分子仍可相对自由地从水相进入到胶束相以及从胶束相再逃逸到水相中[22],因此普郎尼克胶束在有效增溶依托咪酯的同时能够保证快速释药。与缓释药物制剂不同的是,尽管普郎尼克胶束对药物的包裹率达到73%,但由于药物在胶束相和水相中分布是动态平衡的,载药胶束在漏槽条件下会迅速释放药物,因此将载药胶束与未包裹的游离药物完全分离开来较困难,而将EtoPM溶液整体作为一种注射液来研究则更合适。此外,由于普郎尼克投入量较大,尽管药物包裹率较高,但载药量还不理想。因此在今后的研究中,有必要对药物/包裹材料投入比例进行优化,以期在维持较高包裹率的同时获得更高的胶束载药量。
笔者在本实验通过大鼠前爪翻正反射实验考察了EtoPM溶液体内麻醉效果,同时与市售依托咪酯乳状注射液进行比较。实验结果显示,两组大鼠单次尾静脉注射后前爪翻正反射均迅速消失,大鼠快速进入完全麻醉状态并可顺利置于仰卧位,表明EtoPM与依托咪酯乳状注射液均能快速起效。值得注意的是,目前制备的EtoPM胶束溶液药物浓度较低,可能使得给药后脑内药物不能较快达到有效浓度,因此导致EtoPM胶束溶液较市售脂肪乳注射液起效速度提升不明显。由于普朗尼克胶束能够较大程度地对依托咪酯进行增溶,因此笔者将对EtoPM胶束溶液的药物浓度进行优化提升,以期加快其起效速度,同时也使其满足对全麻制剂快速起效的要求。另一方面,EtoPM溶液比乳状注射液显著缩短了大鼠麻醉后苏醒的时间,这可能是由于普郎尼克胶束能够促进药物向脑内的转运以及药物的快速释放,因为这两种性质能有效减少依托咪酯在血液循环中的滞留,使药物更快地进入脑内发挥作用以及被代谢。相比之下,乳状注射液没有脑靶向作用,且释药速度较缓慢,因而体内药物会有更长作用时间,不仅造成麻醉后苏醒时间的延长,同时也使药物有更大的机会随血液流动分布到体内其他部位,从而产生一定毒副作用。
综上所述,普郎尼克胶束在有效增溶依托咪酯的同时能够快速释药。EtoPM溶液在体内可以迅速起效。与市售依托咪酯乳液注射剂相比,EtoPM溶液麻醉后恢复苏醒时间显著更短,可能更满足全麻药物快速恢复苏醒的要求,因此是一种很有潜力的依托咪酯注射液。此外,普郎尼克胶束有望促进依托咪酯向脑内的转运,从而在一定程度上降低药物对体内其他部位的毒副作用,但该功能还有待进一步体内外研究证实。

