慢性痛风性关节炎患者跟腱病变的超声学特征的探讨
张俊霞,周贵明
(1.天津医科大学总医院超声科,天津300052;2.天津港口医院超声科,天津300456)
近年来,世界范围内的痛风性关节炎(gouty arthritis,GA)的发病率呈明显上升的趋势,最常好发部位为第一跖趾关节[1]。临床上,GA 表现为急性关节炎、痛风石形成、关节损伤和肌腱及韧带功能结构的改变[2]。痛风石的形成已被定义为肌肉骨骼病变和关节运动功能障碍的危险因素,可直接导致生活质量的下降[3-4]。高频超声成像技术在软组织损伤诊断中具有极高的精确性和敏感性,操作简单方便,可以实时动态检测肌肉的损伤情况、恢复情况,极大的避免了恢复不彻底而造成的二次损伤,备受学者青睐[5]。本研究旨在探讨慢性GA 患者跟腱(achilles tendon,AT)损伤的超声特征的分布及频率特点。
1 对象与方法
1.1 研究对象 GA 组纳入对象为2018 年5 月—2019 年5 月我院收治的36 例GA 患者(其中33 例男性,3 例女性),共72 条跟腱。GA 组患者均满足1977 年美国风湿病协会诊断标准,在检查期间无急性关节炎发作,对患者双侧跟腱进行高频超声灰阶多切面扫查及能量多普勒检查。所有患者均填写问卷调查、联系方式及其流行病学资料(姓名、性别、年龄、民族等)饮食习惯、与GA 相关的疾病特征(包括:痛风病史、发作史、血尿酸值及痛风石的数量)及其他合并症(包括高血压、糖代谢紊乱、心脑血管疾病);同时进行体格检查,测量身高、体重、血压等;将上述资料录入Excel 数据库,整理并分析。
GA 组入选标准:(1)能配合检查无禁忌。(2)至少有1 处可触性痛风结节。(3)在研究阶段未发生急性关节炎。
对照组纳入对象为随机选取同期于我院就诊的年龄、性别匹配的36 名可排除痛风性关节炎的患者。
1.2 仪器与方法
1.2.1 仪器 采用东芝A300 彩色多普勒超声诊断仪进行检查,探头14L5,频率为5~14 MHz,选择浅表条件探查。
1.2.2 方法 患者取俯卧位,躯干贴于检查床,足踝部放松悬在床尾边缘,膝关节尽可能伸展。在进行跟腱超声检查时,嘱患者尽可能做踝关节背伸动作,使跟腱被拉直,声束尽量与被检查肌腱垂直,排除人为的低回声伪像[6],依据风湿病超声工作组规定,使用二维灰阶及能量多普勒模式,对双侧跟腱各段进行横断面、纵切面的扫查[7]。两组患者的跟腱检查均采用双侧对照检查,进行二维灰阶超声检查,纵切观察跟腱起止点、边缘及内部纤维结构回声,测量附着点跟腱厚度(前后径)。
跟腱分区:每条跟腱分为近、中、远3 段。近段指肌肉连接处的1/3,远段指跟骨插入处的1/3,中段指中间的1/3,即跟骨插入处上方约2~6 cm[8]。本研究中近段记为1 区,中段记为2 区,远段记为3 区。
1.3 统计学方法 参与者数值由均值(SD)或频率(%)表示。因为超声特征在受试者中是嵌套关系(例如,要评估双侧及3 个分区的特征),使用广义评估方程(GEE)用来判断痛风组及对照组的超声特征是否具有明显差异。跟腱各区间的超声特征也由GEE方法来分析。所得实验数据均运用统计软件SPSS20.0 进行统计学处理。所有检验均为双侧检验,P<0.05 表示差异有统计学意义。
2 结果
2.1 受试者人口统计学及临床特点 GA 组大多数为中年人(平均61.9 岁),男性(33 例,92%)。GA 组有长年病史,平均血尿酸水平约0.37 mmol/L。高血压和心血管疾病于GA 组明显高发(均P<0.05)。大多数GA 组患者经过降尿酸治疗(33 例,92%),见表1。
2.2 尿酸盐沉积的特征 GA 组跟腱内痛风石的出现较对照组更常见(53 例,74%vs. 0,0,P<0.01),如图1 所示。GA 组跟腱内强回声点较对照组也常见(59 例,82%vs. 15 例,20%,P<0.01),如图2 所示。跟腱内局部强回声区、滑囊内痛风石、滑囊内暴风雪征不常见且用GEE 不能统计,见表2。
2.3 炎症的特征 GA 组跟腱内能量多普勒信号较对照组更常见(59 例,81.9%vs.12 例,16.6%,P<0.01)。跟骨后滑囊炎及滑囊内多普勒信号不常见且用GEE 不能统计,见表3。
2.4 结构损伤的特征 GA 组中有5 例(6.9%)出现AT 部分撕裂,对照组中为0 位,同时两组都没有出现跟腱断裂。两组跟腱增厚(4.7 mmvs.4.3 mm,P=0.85)无明显差异,见表4。
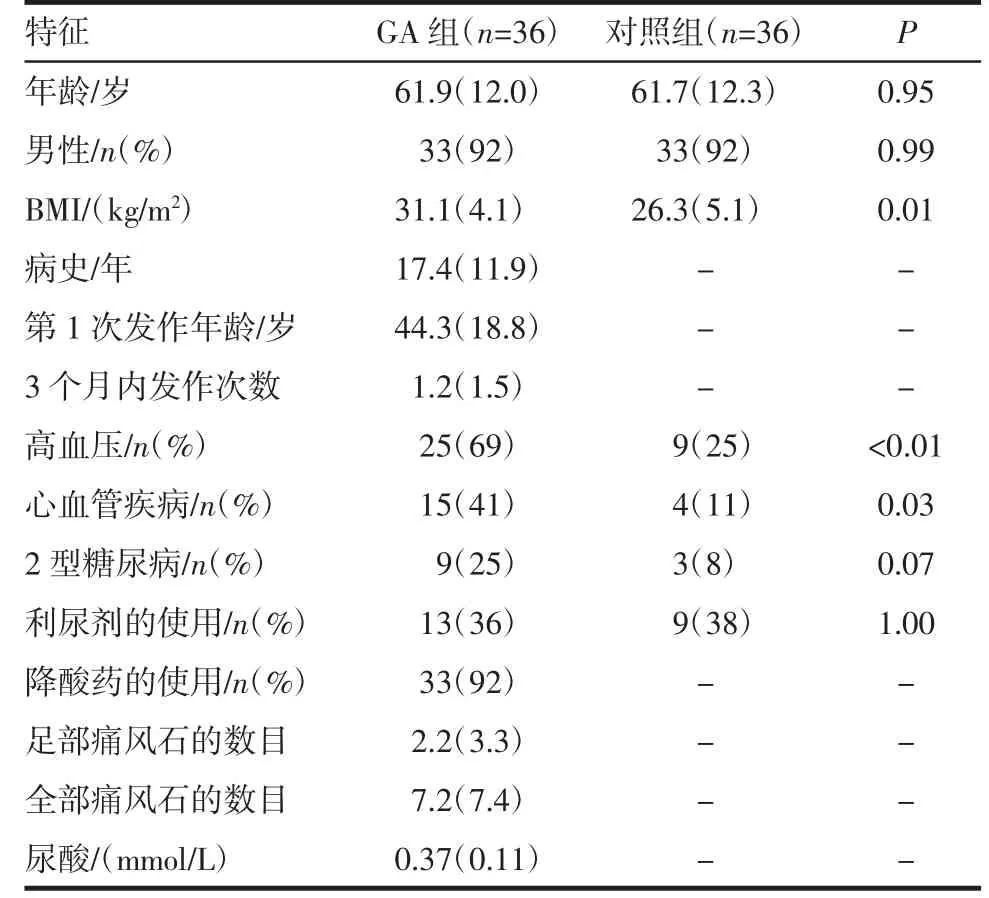
表1 受试者人口统计学及临床特征Tab 1 Participant demographic and clinical characteristics
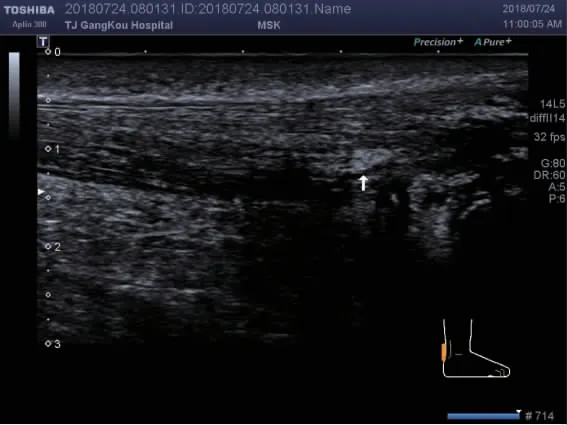
图1 白色箭头为跟腱内痛风石形成Fig 1 The white arrow points the tophus of the AT
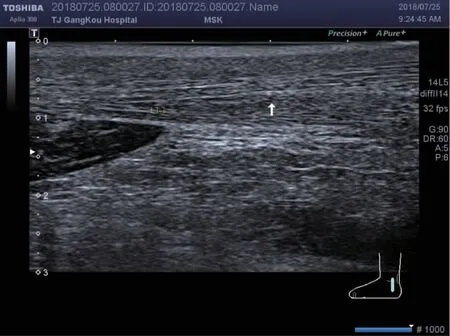
图2 白色箭头为跟腱内点状强回声Fig 2 The white arrow points the hyperechoic spots of the AT
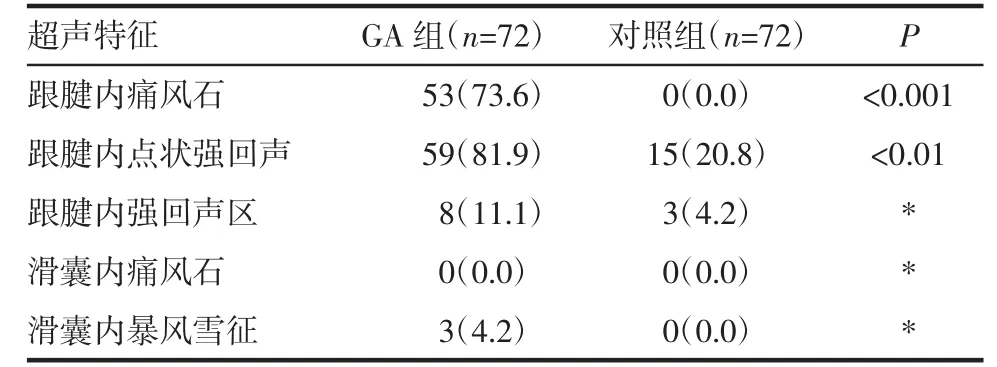
表2 尿酸盐沉积的特征[n(%)]Tab 2 Features of urate deposition[n(%)]
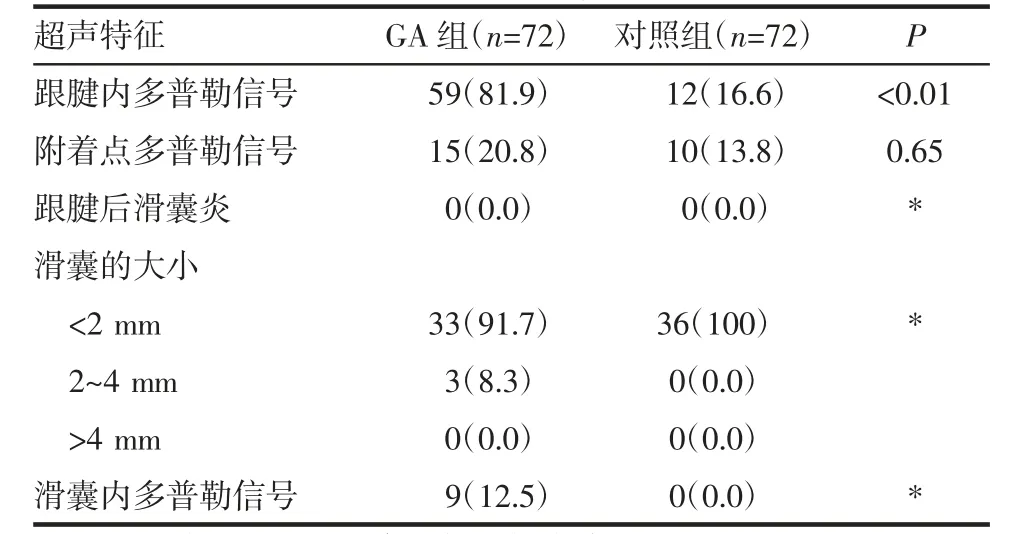
表3 炎症的特征[n(%)]Tab 3 Features of inflammation[n(%)]
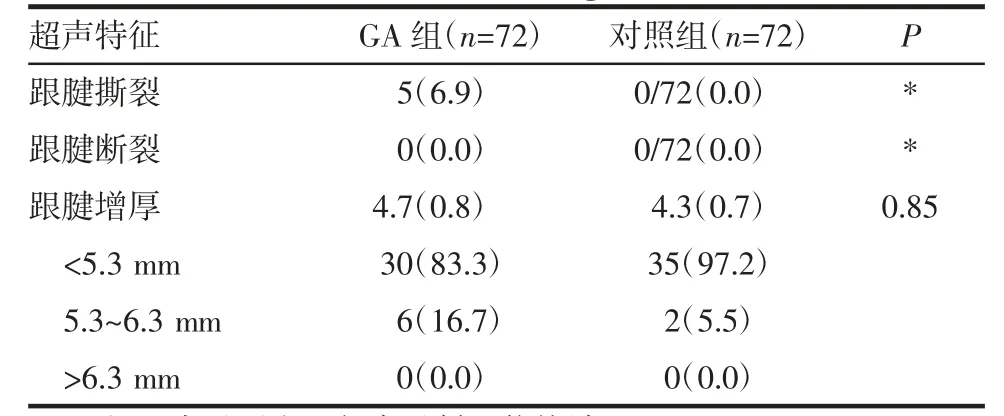
表4 结构损伤的特征[n(%)]Tab 4 Features of structure and damage[n(%)]
2.5 跟腱各区的超声特征 AT 分区的超声特征:GA 组患者跟腱3 区痛风石的出现(P=0.07)及能量多普勒信号(P=0.60)无明显差异。AT 内强回声点的出现有明显差异(P<0.01)。对比3 区,1 区的强回声点更常见(P<0.01),如表5 所示。
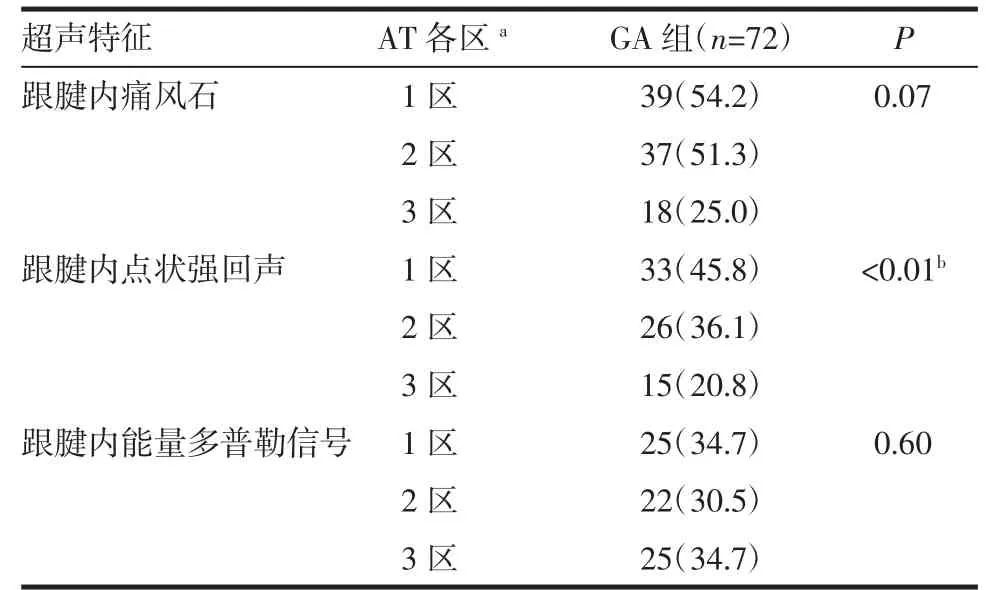
表5 跟腱各区的超声特征Tab 5 Ultrasound characteristics of zone of Achilles tendon
3 讨论
GA 是由于血清尿酸长期高于正常水平导致血尿酸钠(MSU)晶体形成而引起的关节炎性病变。之前对于GA 分级标准的敏感性和/或特异性并不理想,随着各种影像技术的发展,尤其是超声学的发展,GA 的分级标准也有所完善。在2015 年欧洲抗风湿联盟(EULAR/ACR)提出了新的痛风分级标准,新标准纳入了超声及DECT 影像学诊断技术。有两项特异性及敏感性高的超声特征列为基本标准:软骨表面双轨征及软组织尿酸盐沉积征[9]。肌腱中MSU晶体沉积是痛风患者关节外受累的常见表现,微晶体可能沉积在肌腱的体部、周围、甚至附着点处,但通常在多部位出现。MSU 晶体对跟腱功能的影响尚没有论证。在Chhana 等[10]的动物模型研究中,MSU 晶体对基质金属蛋白酶2、3、13、胶原蛋白的产生和肌腱细胞的存活具有抑制作用,因为这些细胞可诱导肌腱细胞凋亡,因而可得出结论,MSU 晶体会直接影响肌腱细胞,使其寿命及功能减低,这些影响因素会使晚期GA 患者肌腱受损。
Dalbeth 等[11]通过使用DECT 影像技术评估GA患者足部肌腱及韧带受累的频率和模式,发现10.8%的患者出现肌腱受累,频率最高的为跟腱。其中,38%跟腱受累只出现在非附着点,40%出现在附着点和非附着点,22%只在附着点区。本研究结果与其接近,在体部(2 区,51.3%)及附着部(1 区,54.2%)出现痛风石沉积的比例明显高于非附着点(3 区,25.0%)。Ventura-Rios 等[12]通过使用超声技术对跟腱病变的研究发现,超过一半的GA 组患者肌腱内出现痛风石及强回声点,检出率明显高于对照组,其结论与本研究结果一致。本研究中GA 组患者同时有疾病的特异性和非特异性,痛风石、肌腱内的能量多普勒信号、肌腱内的强回声点具有较高的检出率。GA 患者的结构损伤最小。痛风石沉积物在GA 组患者3 个区均有出现,在AT 附着点及中段更普遍。GA 组患者74%跟腱内出现痛风石,高于之前的报道[12-13]。然而,在之前的研究中,可触性痛风结节并不是试验设计的基本要求之一,这也可能是导致这一差异出现的原因,也在另一方面说明病程长的GA 患者更容易在跟腱内出现MSU 晶体沉积。GA组患者肌腱内强回声点的检出率也明显高于对照组。强回声点是在纤维聚集形式或钙化性痛风石的典型表现。研究报道,对照组也出现了跟腱内强回声点,分析原因,考虑健康人群跟腱内强回声改变和钙化可能与药物性原因及无症状性钙化的跟腱病理改变相关[12]。GA 组患者肌腱内能量多普勒的检出并非特异性表现,阳性的多普勒信号不仅提示痛风的炎性特征,也可延伸到提示结构的改变。在本研究中多普勒信号普遍出现,在对照组也出现同样的情况,故能量多普勒的出现并非GA 的特异性表现。GA 患者结构性损伤,包括跟腱断裂、撕裂及跟腱增厚,检出率极低,与对照组无明显差异。尽管GA 组跟腱内痛风石的检出较高,但内部结构的损伤并非主要特征。
本研究的一些局限性应考虑在内。患者提供手术病例组织活检或抽取关节液检出的金标准对照病例较少。尽管研究包含了尿酸盐沉积和血流信号,但在跟腱特性的定义及评分还有待标准化验证。另外,对照组没有进一步筛查有无高尿酸血症患者,这也可能影响了超声特征的检出结果[14]。未来的研究将通过与其他先进的肌肉骨骼成像(包括双能源CT 及MRI 检查)相比较、相联合,使研究结果更加完善。
总之,通过对跟腱内痛风石及强回声点的检出有助于进一步认识GA 对跟腱破坏的情况,及其引起的尿酸盐沉积情况,对GA 疾病的临床认识及尿酸盐沉积的负荷情况有了更客观、更全面的评价,从而为疾病的治疗及降尿酸治疗提供了有价值的信息。

