微球菌MicrococcusNT_1001解磷特性研究
蒋学剑 王志强 王志清

摘要 从汤沟酒厂的酒醅样品中分离得到一株解磷细菌,为革兰氏阳性(G+)菌,菌落表面呈金黄色,且形态圆整,边缘整齐,成堆排列。经16S rDNA序列比对,该菌株为微球菌,被命名为Micrococcus NT_1001。分别以KH2PO4和蛋黄卵磷脂(PC)为底物,考察Micrococcus NT_1001对无机磷和有机磷的分解性能。结果表明,Micrococcus NT_1001可降解无机磷和有机磷,且可转化PC生产甘油磷酸胆碱(GPC);培养温度、pH和培养基中的初始磷浓度对磷分解率、GPC收率有显著影响;Micrococcus NT_1001的最适生长条件为37 ℃,pH 为8.0;初始KH2PO4浓度为60 mg/L時,KH2PO4的分解率最高,为97.89%;初始PC浓度为10 g/L时,GPC收率最高,为1.33%;KH2PO4和PC都对Micrococcus NT_1001存在底物抑制作用。
关键词 酒醅;微球菌;解磷;PC;GPC;底物抑制
Abstract A wild grampositive (G+) phosphatedissolving bacteria was isolated from the fermented grains samples of Tanggou Distillery.The colony surface was golden yellow,and the colony shape was round.The colony edges were neat and arranged in piles.The aligned 16S rDNA sequence indicated that this strain belonged to Micrococcus sp,which was named as Micrococcus NT_1001.The decomposition performance of Micrococcus NT_1001 on inorganic phosphorus and organic phosphorus was investigated separately by using KH2PO4 and egg yolk lecithin (PC) as substrate.The results showed that Micrococcus NT_1001 could degrade effectively inorganic phosphorus and organic phosphorus,and also convert PC to glycerol phosphate choline (GPC);culture temperature,pH and initial phosphorus concentration in the medium had significant effects on the phosphorus decomposition rates and GPC yields;the optimal growth condition of Micrococcus NT_1001 was 37 ℃,pH 8.0;when the initial concentration of KH2PO4 was 60 mg/L,the highest decomposition rate of KH2PO4 was obtained,the corresponding value was 97.89%;when the initial PC concentration was 10 g/L,the highest GPC yield (1.33%) was obtained;both KH2PO4 and PC had substrate inhibitory effects on Micrococcus NT_1001.
Key words Fermented grains;Micrococcus;Phosphate dissolving;PC;GPC;Substrate inhibition
磷既是水体富营养化的关键性限制因子,也是微生物细胞生长的必需元素之一。因此,解磷不仅是环保领域的研究热点,也是生物催化过程的研究重点之一[1]。
具有解磷作用的微生物种类较多,主要包括芽孢杆菌、沙雷氏菌、假单胞杆菌、微球菌、固氮菌、埃希氏菌、霉菌等[2-9]。无机磷和有机磷在这些微生物细胞内的降解、转化途径不同。其中,微生物对无机磷的降解途径通常包括:①乳酸、氨基乙酸、草酸、延胡索酸、琥珀酸、2-葡糖酮酸和柠檬酸等有机酸溶解磷酸盐[10-12];②通过呼吸作用降低环境pH,引起磷酸盐溶解[13-15];③释放H2S,并使其与磷酸铁反应,生成硫酸亚铁和可溶性的磷酸盐等[16-17]。而微生物细胞对有机磷的分解是通过胞外磷酸酶的分泌和酶解过程实现。微生物从含磷有机物中的碳(C)中获得能量,而有机物中的磷(P)则以代谢产物的形式被释放出来[18-19]。同时,细菌具有负责转运有机磷酸酯的G-3-P,即sn-3-磷酸甘油结合蛋白依赖性UgpBAEC转运系统,其中UgpB是周质空间结合蛋白,UgpA和UgpE是膜内嵌蛋白,而UgpC为渗透酶。因此,解磷细菌还可能将有机磷酸酯先转运入胞内,再进行酶解[20]。
课题组前期从汤沟酒厂的酒醅样品中富集、筛选出若干株微生物,并分离得到一株解磷细菌。笔者拟通过形态观察、16S rDNA序列比对对该菌株进行种属鉴定,同时优化该菌株的培养条件,分析菌株代谢产物。
1 材料与方法
1.1 菌株 酒醅样品采集于江苏汤沟两相和酒业有限公司,经富集分离后获得单菌落。
1.2 试剂 牛肉膏、蛋白胨、NaCl 、KH2PO4、NaOH、琼脂等生化试剂均为分析纯,购自西陇科学股份有限公司;蛋黄卵磷脂(纯度99.9%),西安泽邦生物科技有限公司。
1.3 仪器与设备
ZHJH-C1109C型超净台(上海智城分析仪器制造有限公司);1290型HPLC(Agilent);SX700型灭菌锅[天美(中国)];MQD-S2R型振荡培养箱(上海旻泉仪器有限公司);5810R型台式高速冷冻离心机(Eppendorf);PHS-3C型精密pH计(上海精密仪器有限公司);BS124S型电子天平[赛多利斯科学仪器(北京)有限公司];NTL-16G型高速台式离心机(上海安亭科学仪器)。
1.4 方法
1.4.1 培养基。
斜面培养基:牛肉膏 3 g/L,大豆蛋白胨 10 g/L,NaCl 5 g/L,琼脂 2 g/L,pH 7.4~7.6。
平板培養基:牛肉膏 3 g/L,大豆蛋白胨 10 g/L,NaCl 5 g/L,琼脂 2 g/L,pH 7.4~7.6。
液体培养基:牛肉膏 3 g/L,大豆蛋白胨 10 g/L,NaCl 5 g/L。
将培养基分装至500 mL锥形瓶中,121 ℃灭菌20 min,冷却后使用。
1.4.2 培养条件。
种子培养:从保存的菌株上挑取一环菌种接种于斜面培养基上,37 ℃活化24 h,500 mL三角瓶中分装牛肉膏蛋白胨培养基100 mL,121 ℃灭菌20 min;将斜面培养基上的菌种挑取一环接入液体培养基,置于摇床培养24 h,培养条件为37 ℃,200 r/min。
发酵培养:250 mL三角瓶分装牛肉膏蛋白胨培养基50 mL,121 ℃灭菌20 min,加入KH2PO4母液或蛋黄卵磷脂母液,用已灭菌的吸管吸取1 mL种子液至含磷的培养基中。
1.4.3 蛋黄卵磷脂母液配制。
蛋黄卵磷脂试剂为固体,不易灭菌和添加,故选择将其配制成一定浓度的母液,以便取用。取蛋黄卵磷脂15 g,加入Milli-Q水成150 mL,得到浓度为100 g/L的蛋黄卵磷脂母液,105 ℃灭菌20 min,冷却后放入4 ℃ 冰箱备用。
1.4.4 KH2PO4母液配制。称取4.387 g KH2PO4,加纯水溶解后定容至100 mL,得到磷浓度为10 g/L的KH2PO4母液,121 ℃灭菌20 min,冷却后放入4 ℃冰箱备用。
1.4.5 电镀废水样品处理。
采集的电镀废水样品中含有较多不溶性杂质,在使用前进行离心。将水样分别装入200 mL离心罐中,称重配平离心,800 r/min离心10 min;离心后的上清液收集起来,放至4 ℃冰箱备用。
1.4.6 培养温度。
250 mL三角瓶内装50 mL牛肉膏蛋白胨培养基,121 ℃灭菌20 min,接种1 mL 种子液,分别置于20、30、37、40 ℃摇床培养,转速为200 r/min,培养24 h,每隔一定时间取样,测定OD600。
1.4.7 pH。250 mL三角瓶内装50 mL牛肉膏蛋白胨培养基,利用酸碱调pH分别为6、7、8、9,121 ℃灭菌20 min,接种1 mL种子液后置于摇床培养,转速为200 r/min,培养24 h,每隔一定时间取样,测定OD600。
1.4.8 无机磷浓度。
250 mL三角瓶内装50 mL牛肉膏蛋白胨培养基,分别加入不同量的KH2PO4母液,使其浓度分别为0、20、40、60、80、100、120 mg/L,121 ℃灭菌20 min,接种1 mL 种子液,摇床培养,转速为200 r/min,每隔一定时间取样1 mL至2 mL离心管中,测定OD600;另取5 mL培养液至玻璃试管中,测定磷含量。
测定电镀废水样品中总磷浓度,向电镀废水中加入牛肉膏、蛋白胨、NaCl,测定OD600和磷含量。
1.4.9 有机磷浓度。将已灭菌的蛋黄卵磷脂(PC)按计算数值加入已灭菌的牛肉膏蛋白胨培养基中,混合均匀,使其浓度分别为0、5、10、20、30 g/L,每瓶接种1 mL种子液,摇床培养,转速设定为200 r/min,测定OD600和磷含量。
1.4.10 分析。蛋黄卵磷脂(PC)和甘油磷酸胆碱(GPC)测定:用ES 2000高效液相色谱仪搭配Alltech 2000蒸发光检测仪,采用三元梯度洗脱(表1),流动相A为正己烷(含0.04%三乙胺),流动相B为异丙醇,流动相C为13%乙酸溶液,洗脱流速为1.5 mL/min,柱温25 ℃。蒸发光检测器采用分流模式,以空气作为雾化气,气体流速为1.7 L/min,漂移管温度为45 ℃。待测样品按照一定浓度溶解于HPLC级正己烷-异丙醇(体积比为3∶1)混合液中。使用前用0.22 μm孔径的有机相滤膜过滤。
采用钼酸铵分光光度法测定样品中的磷含量[21]。
采用天根生化科技(北京)有限公司的细菌基因组DNA提取试剂盒,按试剂盒操作流程提取NT_1001基因组DNA。
2 结果与分析
2.1 解磷细菌NT_1001的鉴定
菌落表面呈金黄色,形态圆整,边缘整齐,成堆排列(图1),且革兰氏染色结果呈阳性(G+)(图2)。
以NT_1001的DNA作为模板,利用通用引物27F和1492R进行 PCR扩增,扩增体系为60 μL:10 ng/μL的引物27F和1492R各3 μL,DNA模板3 μL,2×Taq mix 30 μL,无菌水补足至60 μL。反应条件为95 ℃预变性5 min;94 ℃变性45 s,55 ℃复性90 s,72 ℃延长90 s,30个循环;72 ℃延长10 min。PCR产物测序后,通过Blast将该序列与 GenBank 数据库中序列进行同源性比对。结果表明,解磷细菌NT_1001与微球菌Micrococcus luteus 的同源性最高,其同源性系统进化树如图3所示。综合形态特征和基因序列同源性分析,将菌株NT_1001鉴定为微球菌(Micrococcus sp.) 。
2.2 Micrococcus NT_1001生长条件优化
2.2.1 温度。从图4可以看出,培养温度从20 ℃增加至37 ℃时,Micrococcus NT_1001的生长速率随着温度增加而逐渐增加;而当培养温度为40 ℃时,Micrococcus NT_1001的生长速率降低。37 ℃是Micrococcus NT_1001生长的最适温度。
2.2.2 pH。从图5可以看出,pH从6.0增加至8.0时,Micrococcus NT_1001的生长速率随着pH增加而逐渐增加;而当pH大于8.0时,Micrococcus NT_1001的生长速率降低。这表明,Micrococcus NT_1001生长的最适pH为8.0。
2.3 Micrococcus NT_1001的解磷性能
2.3.1 无机磷。
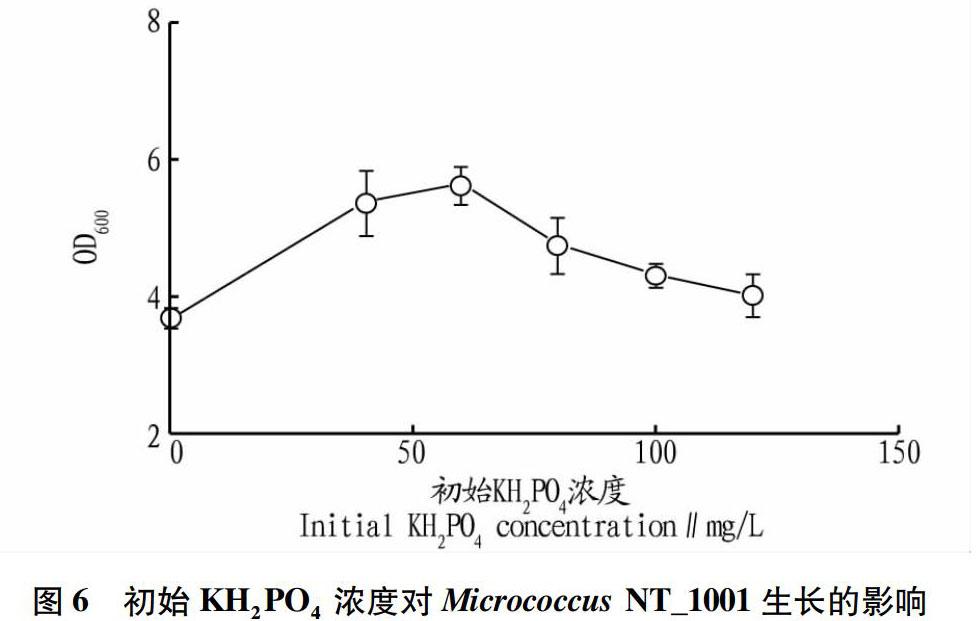
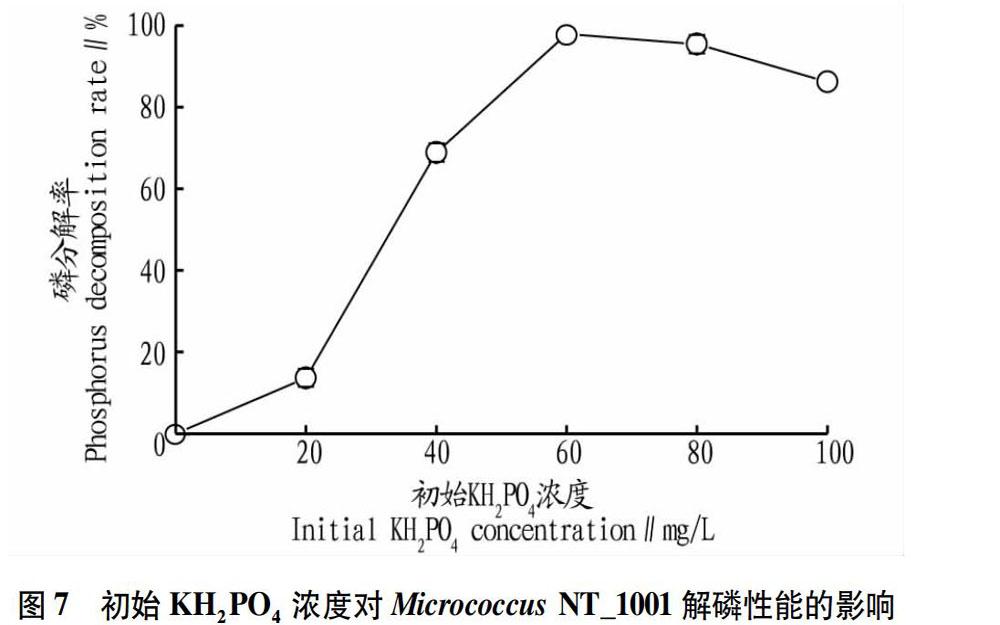
由图6可知,培养基中KH2PO4含量对Micrococcus NT_1001生长有明显的影响。菌体量随着KH2PO4浓度的增加而增加。KH2PO4浓度低于60 mg/L时,Micrococcus NT_1001的生长量随着KH2PO4浓度增加而增加;KH2PO4浓度为 除此之外,初始KH2PO4浓度对磷分解率的影响如图7所示。从图7可以看出,当初始KH2PO4浓度低于60 mg/L时,KH2PO4的消耗率随着初始KH2PO4浓度增加而增加;而当初始KH2PO4浓度大于60 mg/L时,KH2PO4的消耗率逐渐降低。这表明,60 mg/L是Micrococcus NT_1001解磷时的最佳初始KH2PO4浓度,得到的KH2PO4分解率为97.89%。
由图8可知,Micrococcus NT_1001在工业电镀废水中也可以生长,且生长情况良好。但是,菌株在工业电镀废水中的磷分解率仅为46.13%(图9),而菌株在KH2PO4培养基中的解磷率能接近100%。与污水样品相比,Micrococcus NT_1001在含磷液体培养基中生长情况较好。这可能是由于电镀废水中含有其他杂质和抑制因子,对菌株的代谢途径产生了抑制作用。
2.3.2 有机磷。
从图10可以看出,Micrococcus NT_1001能够分解PC。当初始PC浓度小于20 g/L时,PC分解率随着初始PC浓度增加而显著增加;而当初始PC浓度大于20 g/L时,PC分解率降低。这表明PC对Micrococcus NT_1001可能存在底物抑制作用。最佳初始PC浓度为20 g/L。
在Micrococcus NT_1001降解PC的代谢产物中检测出GPC。GPC是一种重要的神经递质和磷脂前体,具有较高的市场价值。考察了不同初始PC条件下,Micrococcus NT_1001的GPC产量(图11)。
从图11可以看出,在初始PC浓度低于20 g/L時,GPC产量随底物PC浓度增加而增加;当初始PC浓度大于20 g/L时,GPC产量降低。这一结果与图9中PC的分解率变化趋势一致。同时,通过计算不同条件下GPC收率,得到初始PC浓度对GPC收率的影响(图12)。
从图12可以看出,当初始PC浓度超过10 g/L时,GPC收率明显降低。这表明Micrococcus NT_1001在PC浓度达10 g/L时,就已经受到底物抑制作用。当初始PC浓度为10 g/L时,GPC收率为1.33%。
3 讨论与结论
磷元素是生物体所需的重要营养元素之一,也是原生质的重要组分之一。高能磷酸键同时也是微生物所需能量的载体。因此,包括微生物在内的生物细胞体内生化过程正常进行都必须有磷元素的加入和作用。该文首次从我国传统白酒酿造工艺中取样,富集、筛选和分离出了一株高效的解磷微生物Micrococcus NT_1001,分析了其培养条件和对无机磷、有机磷原料的分解和转化性能,初步优化了其生产附加值高的GPC产品的条件。但是,Micrococcus NT_1001在分解和转化中的作用机制尚不明确,且Micrococcus NT_1001在其他生理生化过程中产生的作用和功效仍需要进行深入研究和挖掘。
从汤沟酒厂酒醅中筛选出一株具有良好解磷性能的微球菌,命名为Micrococcus NT_1001,该菌株在37 ℃和pH 8.0条件下的菌体生长量最高。同时,考察了Micrococcus NT_1001对无机磷KH2PO4和有机磷PC的降解性能。当初始KH2PO4浓度为60 mg/L时,Micrococcus NT_1001对KH2PO4的分解率最高;当初始PC浓度为10 g/L时,GPC收率最高。
尽管如此,无机磷和有机磷都对Micrococcus NT_1001具有底物抑制作用。
参考文献
[1] 李阜棣,胡正嘉.微生物学[M].5版.北京:中国农业出版社,2000:228.
[2] 王光华,赵英,周德瑞,等.解磷菌的研究现状与展望[J].生态环境,2003,12(1):96-101.
[3] 赵小蓉,林启美.微生物解磷的研究进展[J].土壤肥料,2001(3):7-11.
[4] KUCEY R M N,JANZEN H H,LEGGETT M E.Inorganic phosphate solubilizing microoganisms:Microbially mediated increases in plant available phosphorus[J].Advances in agronomy,1989,42:199-208.
[5] ASEA P A,KUCEY R M N,STEWART J W B.Inorganic phosphate solubilization by two Penicillium species in solution culture and soil [J].Soil Boil Biochem,1988,20:459-464.
[6] CEREZINE P C,NAHAS E,BANZATTO D A.Soluble phosphate accumulation by Aspergillus niger from fluorapatite [J].Appl Microbiol Biotechnol,1988,29:501-505.
[7] NAHAS E,BANZATTO D A,ASSIS L C.Fluorapatite solubilization by Aspergillus niger in vinasse medium [J].Soil Biol Biochem,1990,22:1097-1101.
[8] 王富民,刘桂芝,张彦,等.高效溶磷菌的分离、筛选及在土壤中溶磷有效性的研究[J].生物技术,1992,2(6):34-37.
[9] 范丙全,金继运,葛诚.溶磷草酸青霉菌筛选及其溶磷效果的初步研究[J].中国农业科学,2002,35(5):525-530.
[10] KUCEY R M N.Effect of Penicillium bilaji on the solubility and uptake of P and micronutrients from soil by wheat [J].Canadian journal of soil science,1988,68(2):261-270.
[11] JUMA N G,TABATABAI M A.Distribution of phosphomonoesterases in soils [J].Soil science,1978,126(2):101-108.
[12] LAURO F M,MCDOUGALD D,THOMAS T,et al.The genomic basis of trophic strategy in marine bacteria[J].PNAS,2009,106:15527-15533.
[13] 劉乐然,苏秀榕,李太武.沿海微生物资源开发利用研究进展[J].河北渔业,2003(4):14-15.
[14] 朱凤玲.海洋细菌新属种的分类鉴定及解磷菌解磷特性的分析[D].青岛:国家海洋局第一海洋研究所,2011.
[15] 郝柏林.基因组学和生命的进化——分子进化和细菌分类[J].科学中国人,2004(5):48-50.
[16] ZOBELL C E.Marine microbiology:A monograph on hydrobacteriology [J].Science,1946,103:715-716.
[17] HUGENHOLTZ P,GOEBEL B M,PACE N R.Impact of culture-independent studies on the emerging phylogenetic view of bacterial diversity[J].Journal of bacteriology,1998,180(18):4765-4774.
[18] 庞坤,韩立强,李维琳.卵磷脂的性质及其应用[J].安徽农业科学,2006,34(9):1772-1773.
[19] 吴胜芳,顾小红,张灏,等.卵磷脂的功能特性及其应用[J].食品科技,2001(4):36-38.
[20] 王锐萍,陈玉翠.海口东湖降解磷细菌研究初报[J].海南师范学院学报(自然科学版),2001,14(1):84-88.
[21] 袁玉璐,姚元.中华人民共和国国家标准 水质总磷的测定 钼酸铵分光光度法:GB 11893—89[S].北京:中国环境科学出版社,1989.

