一株耐Cd罗尔斯通氏菌的分离、鉴定及其对Cd2+的吸附特性研究
林晓敏,朱 健,汤思敏,麻淳雅,程钰莹,姚 璐,倪楚盛,王 平,王玉竹
(1.中南林业科技大学 环境科学与工程学院,湖南 长沙 410004;2.稻米品质安全控制湖南省工程实验室,湖南 长沙 410004)
镉(Cd)是一种对人类与动植物具有极强毒性的重金属元素[1]。由于工矿业的发展和农药化肥的不合理使用,造成Cd 废水日益增多,一旦含Cd废水未达标处理直接排放到河流中,就会成为水生食物链的污染源。Cd 能在动植物体内富集,通过食物链传递进入人体,Cd 与体内蛋白质分子结合,进而破坏蛋白质分子的分子结构导致其失活,最终引起人体急性、慢性中毒,如Cd 会干扰人体对Ca、P 的吸收,造成维生素D 异常代谢,从而引起肾脏和骨头的病变(痛痛病)等[2-3]。含Cd 废水主要来源于尾矿排水、金属矿山开采等,水质来源不同毒害程度也有很大的差异,其严重侵犯人类享受健康、清洁、安全生存空间的合法权益[4-6]。目前Cd 污染废水的处理方法包括化学沉淀法、离子交换法、膜分离法、电解法和微生物吸附法[7-8],在实际应用中,化学沉淀法存在试剂投放量大,易造成二次污染等问题;离子交换法、膜分离法、电解法均存在处理成本较高的局限。与之相比,微生物吸附法具有效率高、速度快、无二次污染等优点[9-10]。微生物吸附法是利用生物体本身的化学结构和成分特性对溶液中的金属离子进行吸附,吸附的过程主要是羟基、羧基、疏基等多种配位基团起作用,这些配位基团通过与金属离子络合来完成对金属离子的吸附[11-12]。罗尔斯通氏菌最初被应用于苯代污染物的降解和PHB 的合成方面的研究[13],而付瑾等[14-15]从铜矿土壤中筛选了一株皮氏罗尔斯通氏菌,发现了其具有极高的耐镉性,并且初步探究了其富集镉机理,拟合了饱和吸附量为16.7 mg/g。目前关于利用罗尔斯通氏菌株干菌体吸附去除Cd2+的研究已有报道,付瑾分离的皮氏罗尔斯通氏菌吸附能力较弱,不同种类的罗尔斯通氏菌存在各项差异。本研究从镉污染土壤中筛选了一株吸附能力较强的耐镉罗尔斯通氏菌,将其制成菌粉,研究了其对Cd2+的吸附能力以及吸附机制,以期为微生物吸附含镉废水提供功能菌株和奠定基础。
1 材料与方法
1.1 试验材料
1.1.1 菌株来源
菌株源自湖南省长沙市北山试验基地土壤(采样深度0~20 cm),土壤基本性质:pH 值5.2,Cd 浓度1.6 mg/kg,土壤CEC 33.4 cmol/kg,OM值28.1 g/kg。
1.1.2 培养基
牛肉膏蛋白胨(液体)培养基(g/L):牛肉膏5 g,氯化钠5 g,蛋白胨10 g,琼脂20 g(固体培养基添加)。121℃,灭菌20 min 后使用。
1.1.3 菌悬液的制备
在无菌条件下,使用接种环从固体培养基中挑选纯化好的菌株接种至液体培养基,120 r/min,30 ℃的条件下培养20 h,5 000 r/min 条件下离心15 min 后弃去上清液,无菌水洗涤菌体,离心,重复洗涤3 次,收集菌体制成菌悬液。于4 ℃冰箱保存备用。
1.1.4 耐Cd 菌株的分离、纯化
将10 g 土样加入90 mL 无菌水中,设置摇床转速150 r/min、温度28℃,振荡45 min 后静置30 min 取上清液。采用稀释涂布法分别取100 μL均匀涂布在Cd2+含量为50 mg/L 的牛肉膏蛋白胨固体培养基平板上,于28℃恒温倒置培养2~3 d,观察其生长状况,每个浓度设置3 个平行。将平板上形态各异的单菌落挑选出接种于Cd2+含量为100 mg/L 的牛肉膏蛋白胨固体培养基平板上并划线,以100 mg/L 为增量逐次递增培养基中Cd2+含量,以确定各菌株的耐受阈值。将分离出来的耐Cd 菌株进行多次划线纯化,保存备用。
1.1.5 菌粉的制备
配制牛肉膏蛋白胨液体培养基,按接种量1%接种后在30 ℃、120 r/min 下培养48 h。采用冷冻高速离心机离心收集菌体,灭菌锅灭菌后60 ℃恒温烘干,用研钵磨成粉末状后用密封袋保存备用。
1.2 试验方法
1.2.1 耐Cd 菌株的鉴定
16S rDNA 序列分析:采用Ezup 柱式 细菌基因组DNA 抽提试剂盒(购自生工生物工程股份有限公司)提取优选菌株的总基因组DNA,扩增优选菌株的16S rDNA,设计引物 为:27F,AGTTTGATCMTGGCTCAG;1492R,GGTTACCTTGTACGACTT。PCR 反应体系为:0.5 μL Template,2.5 μL10×Buffer,1 μL dNTP,0.2 μL 酶,0.5 μL F,0.5 μL R,总反应体系为 25 μL。总反应体系为20 μL,PCR 条件为:94 ℃预变性4 min,94 ℃变性45 s;55 ℃退火45 s,72 ℃延伸1 min,共30 个循环;72℃修复延伸10 min,4 ℃终止反应。回收PCR 扩增产物,交由生工生物工程公司完成测序,将测序结果在NCBI 上进行BLAST 分析,并利用MEGA 5.0 构建系统发育树。
1.2.2 菌粉对Cd2+的吸附影响因素及规律
1)温度对菌粉吸附Cd2+的影响
按照0.2 g/L 投加量向Cd2+浓度为100 mg/L 的溶液投加菌粉,调节体系初始pH 值为7.0,设置摇床转速为120 r/min,分别于10、20、30、40、50 ℃下吸附3 h,离心收集上清液,测定Cd2+含量。
2)初始pH 值对菌粉吸附Cd2+的影响
按照0.2 g/L 投加量向Cd2+浓度为100 mg/L 的溶液投加菌粉,设置摇床环境30℃、120 r/min,调节初始pH 值分别为3.0、5.0、6.0、7.0、9.0,吸附3 h 后离心收集上清液,测定Cd2+含量。
3)时间对菌粉吸附Cd2+的影响
按照0.2 g/L 投加量向Cd2+浓度为100 mg/L的溶液投加菌粉,调节体系初始pH 值为7.0,设置摇床环境30 ℃、120 r/min,分别吸附30、60、90、120、180、240 min 后离心收集上清液,测定Cd2+含量。
4)初始浓度对菌粉吸附Cd2+的影响
按照0.2 g/L 投加量分别向Cd2+初始浓度为50、100、200、300、400 mg/L 的溶液投加菌粉,设置摇床环境30℃、120 r/min,调节初始pH 值分别 为7.0,吸附3 h 后离心收集上清液,测定Cd2+含量。
5)投加量对菌粉吸附Cd2+的影响
分别按照0.2、0.4、1、1.6、2 g/L 投加量向Cd2+浓度为100 mg/L 的溶液投加菌粉,调节体系初始pH 值为7.0,设置摇床环境30 ℃、120 r/min,吸附3 h 后离心收集上清液,测定Cd2+含量。
1.2.3 菌粉对Cd2+的吸附条件优化
通过正交试验优化了菌粉对Cd2+吸附条件。选择菌粉投加量(g/L)、吸附时间(h)、pH 值、温度(℃)4 个因素,每个因素设计3 个水平进行正交试验L9(34),试验设计见表1。

表1 正交试验各因素水平Table 1 Scope of the factors
1.2.4 菌粉对Cd2+等温吸附属性分析
配制Cd2+浓度分别为10、50、200、400、500、600、800 mg/L 的废水,按0.2 g/L 投加量加入菌粉。吸附条件为:120 r/min、30 ℃、pH 值6.0。每个梯度设置3 组平行以及空白对照。摇床震荡3 h 后离心收集上清液,用原子吸收测定Cd2+含量。采用Langmuir、Freundlich 等温吸附模型对试验数据进行拟合,分析LC 菌粉对Cd2+的吸附机制。
Langmuir 等温线方程:

Freundlich 方程:

式中:qmax为饱和吸附量(mg/g);qe为平衡吸附量(mg/g);Ce为平衡质量浓度(mg/L);KL为Langmuir 吸附特征常数;C0表示初始Cd2+质量浓度最大值(mg/L);KF和n为Freundlich 吸附特征常数。
1.2.5 吸附前后菌粉表征分析
分别采用扫描电镜(SEM)、能谱(EDX)、红外光谱(FTIR)分析了吸附前后菌体微观结构、元素构成、官能团组成的变化。
1.3 数据处理
菌粉对Cd2+的吸收量(q)的计算公式分别为:

式中:C0为对照组上清液Cd2+质量浓度(mg/L);Ct为试验组上清液Cd2+质量浓度(mg/L);V为溶液的体积(L);M为菌粉投加量(g)。所有试验处理设置3 个平行,取均值进行分析。
2 结果与分析
2.1 菌株鉴定
分离纯化后得到了一株耐镉菌株,命名LC。通过平板划线试验最终确定了LC 菌株对Cd2+的耐受阈值为850 mg/L。经16S rDNA 测序后将测序结果通过NCBI(NCBI 登录号为MK418966)进行BLAST 比对,构建系统发育树(图1)。LC 菌株与Ralstoniaspp.亲缘关系最近,与Bacillus vietnamensispartial 关系较远,结合形态观察和序列分析初步鉴定LC 菌株为罗尔斯通氏菌Ralstoniaspp.。
2.2 菌粉对Cd2+吸附的影响因素及规律分析
2.2.1 溶液温度的影响

图1 LC 菌株系统发育树Fig.1 LC strain phylogenetic tree
溶液温度对LC 菌粉吸附量的影响见图2(a)。由图2可知,随着温度的升高,菌粉对Cd2+的吸附量呈现先上升后下降的趋势,在30 ℃时达到最大值(100.4 mg/g)。说明菌粉Cd2+的吸附量受温度影响,温度过低(10 ℃)和过高(50 ℃)都不利于吸附的进行。温度过低,溶液自由扩散速度减慢,菌粉表面离子交换速率降低。在一定的范围内,温度的升高可以促进菌粉的吸附,温度越高,其溶液中的离子扩散速度加快,菌粉表面吸附位点与Cd2+的接触机会增多[16-17]。
2.2.2 溶液初始pH 值的影响
溶液初始pH 值对菌粉吸附Cd2+的影响见图2(b),随着pH 值的升高,吸附量呈现先上升后下降的变化规律。LC 菌粉的吸附最佳点在pH 值6.0,吸附量为145.9 mg/g。初始pH 值是一个重要的吸附参数,对溶液有很大的影响,Cd2+的状态会随着pH 值的变化而改变。溶液呈酸性时,大量H+会和Cd2+竞争吸附剂表面的自由位点,使菌粉表面质子化,导致吸附降低;随着pH 值的升高,H+占据的吸附位点被释放出来,吸附量不断上升;而在pH 值呈碱性时,Cd2+与OH-形成Cd(OH)2沉淀[18-19],溶液中可吸附的Cd2+减少,吸附量下降。
2.2.3 吸附时间的影响
时间对菌粉吸附的影响见图2(c)。随着吸附时间的延长,菌粉对Cd2+的吸附量呈逐渐上升的趋势,当吸附时间为180 min 时,吸附量达到110.7 mg/g,而后有所下降。菌粉的生物吸附一般很快,但具体时间受环境变化的影响,最初由于溶液的混合作用,一部分Cd2+迅速占据菌粉表面吸附位点,之后依靠水溶液的传输作用,帮助菌粉吸附Cd2+,但Cd2+与细胞壁的官能团发生配位作用以及螯合作用[12,20]需要时间,因此随着时间的延长,菌粉的吸附量逐渐增加。但过长的吸附时间会使吸附位点出现解析,吸附量下降,反而对吸附无益。因此菌粉吸附Cd2+的最佳时间是180 min。
2.2.4 初始质量浓度菌粉吸附Cd2+的影响
初始Cd2+质量浓度对菌粉吸附值得影响见图2(d)。随着初始Cd2+质量浓度上升,吸附量先上升后保持稳定。在初始Cd2+质量浓度为300 mg/L 时,吸附量最大(195.2 mg/g)。随着溶液中初始Cd2+质量浓度的增加,一方面溶液中Cd2+基数增加,与菌粉表面的可吸附位点碰撞的机率增大[21],因此吸附量不断增大。另一方面,当Cd2+质量浓度达到一定程度时能提供驱动力,以克服固相和液相的传质阻力,从而提高吸附剂的吸附量[20]。但当Cd2+质量浓度继续上升,吸附位点出现饱和状态时,吸附量将不会再出现较大的变化。因此,最佳吸附点在Cd2+质量初始浓度为300 mg/L。
2.2.5 投加量对菌粉吸附Cd2+的影响
投加量对菌粉吸附Cd2+的影响见图2(e)。随着菌粉投加量的增多,菌粉的吸附量先急速下降后趋于稳定。在投加量为0.2 g/L时菌粉出现最高点,LC 菌粉吸附量为105.6 mg/g。这是因为在Cd2+含量相同的溶液中,菌粉投加量越大,单位菌粉吸附Cd2+降低,并且在菌粉浓度较高时,Cd2+的有限、可吸附位点的相互干扰、甚至是静电作用都会影响吸附过程,从而降低吸附量[22-23]。研究结果与Atena[24]的研究结果相似,最佳吸附点是投加量最少的点,随着投加量的增多,吸附量反而降低。
2.3 LC 菌粉对Cd2+吸附条件优化
正交试验结果见表2。由表2可知,A 因素中K1>K2>K3,B 因素中K2>K3>K1,C 因素中K2>K3>K1,D 因素中K2>K3>K1,优化吸附量应选每个因素中最大的水平,R越大表示该因素水平变化对实验结果影响越大,反之越小[25]。从而最佳方案是A1B2C2D2,即最佳方案为:投加量0.1 g/L,时间2 h,温度30 ℃,pH 值6.0。主次因素为A>B>D>C,即投加量的影响对菌粉吸附Cd2+的影响最大,时间次之,温度的影响最小。
2.4 菌粉对Cd2+的等温吸附特性
LC 菌粉对Cd2+的吸附等温线如图3所示。随着Cd2+质量浓度的升高,吸附量逐渐增大,当Cd2+质量浓度上升到400 mg/L 时,吸附量趋于稳定。采用Langmuir 和Freundlich 等温线模型进行拟合[26],结果见图3,相关拟合参数列于表3。

图2 菌粉对Cd2+吸附的影响因素及规律分析Fig.2 Analysis of factors and regularity of bacterial powder adsorption on Cd2+
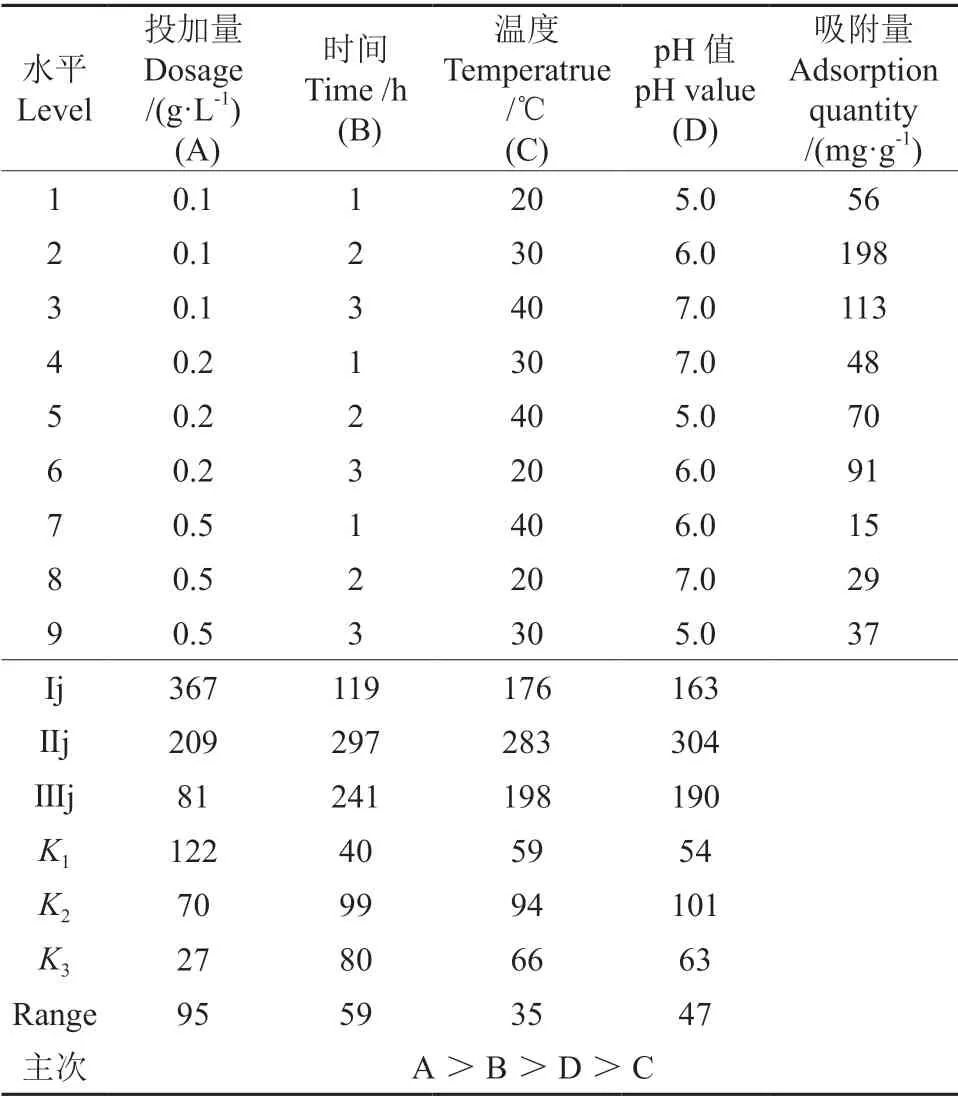
表2 正交试验设计及结果Table 2 Orthogonal experimental design and results

图3 LC 菌粉对Cd2+吸附的Langmuir 和Freundlich 模型拟合Fig.3 Fitting of Langmuir and Freundlich models of Cd2+ adsorption by LC powder

表3 菌粉吸附Cd2+的等温方程及相关参数Table 3 Isothermal equations and related parameters of adsorption of Cd2+ by bacterial powder
Langmuir 等温吸附模型假设的是单层吸附,离子之间没有相互作用,KL是表征结合位点与金属离子的亲和力相关的常数,常数越小,吸附亲和力越大。生物吸附过程由qmax和KL共同决定的,一个好的生物吸附剂往往KL较低、qmax较高[27-28]。其还可以定义一个无量纲的分离因子
[29],当RL=0,为非可逆吸附,RL=1 为可逆吸附。当0<RL<1,有利;当RL>1,不利。对于Freundlich 等温吸附模型,KF代表吸附常数,1/n与金属离子浓度有关,值越大,表明吸附剂与吸附质之间的作用越强,1/n处于1~10 之间,吸附过程更加有利进行[30-31]。
LC 菌粉对Cd2+的吸附等温线非线性拟合结果表明,两种等温线方程均能较好地拟合吸附过程。其中Langmuir 方程拟合效果更好,说明LC 菌粉表面的吸附位点分布均匀并对Cd2+的亲和力相同,是一个单层面吸附的过程。本研究对LC 菌粉的Langmuir 模型拟合结果中qmax为221 mg/g,KL为0.007,0<RL(0.151 5)<1,Freundlich 模型拟合常数KF为6.573 9,1/n为1.842 9,共同印证了LC 菌粉是一种良好的吸附剂,具有较强的吸附能力。黄飞[16]发现Langmuir 模型更适合模拟死细胞的吸附过程,采用Langmuir 模型拟合Bacillus cereus对Cd2+的吸附过程,得到吸附最大值 31.95 mg/g,与本研究LC 菌粉拟合等温线模型结果一致。沈秋悦[21]通过Langmuir 模型拟合Bacillus的吸附得到了菌株的吸附最大值1.83 mg/g。Loukidou[32]利用Aeromonas caviae作为生物吸附剂吸附溶液中的Cd2+,其最大吸附量可达155 mg/g。以上研究表明菌株类型不同,吸附量差异性较大。Bacillus、Bacillus cereus属于革兰氏阳性菌,Aeromonas caviae和LC 菌是革兰氏阴性菌,革兰氏阴性菌细胞壁含有脂多糖,其属于聚合电解质,带有较强的负电荷,可以通过静电作用吸附Cd2+,而革兰氏阳性菌细胞壁较厚,且外膜成分缺失,吸附能力有所减弱[33]。
2.5 菌粉吸附Cd2+前后表征分析
2.5.1 扫描电镜(SEM)分析
菌粉吸附Cd2+前后扫描电镜结果如图4所示,图4a 为吸附前,图4b 为吸附后,菌粉表面吸附前后出现变化。由图4a 可知,吸附前菌粉表面较为平滑且饱满,而吸附后图4b 显示菌粉表面部分凹凸不平,表明菌粉表面吸附Cd2+。

图4 菌株吸附Cd2+前后电镜扫描结果(10 000×)Fig.4 Electron microscopy results before and after adsorption of Cd2+ by strain (10 000×)
2.5.2 能谱(EDX)分析
吸附前后菌粉的能谱分析图谱见图5。由图5可知:吸附前,菌粉表面存在C、O、Cl、Na、P、Mg 峰,菌粉表面的吸附位点被Mg2+与Na+占据。吸附后,菌粉表面出现了新Cd 峰,Na、Mg 峰消失,出现一个不明峰。表明Cd2+与Mg2+、Na+发生离子交换,吸附位点被Cd2+取代。吸附后出现的不明峰与吸附前P 峰的位置一致,且变强。这是因为P 存在与Cd2+的络合作用,产生的基团占据了表面吸附位点。

图5 菌粉吸附Cd2+前后的能谱Fig.5 Energy spectrum of bacterial powder before and after adsorbing Cd2+
2.5.3 红外光谱(FTIR)分析
LC 菌粉吸附前后红外光谱见图6,根据相关文献[30-35],对比图中LC 菌粉对Cd2+吸附前后的红外光谱图可知,吸附Cd2+后,位于 3 404.63 cm-1处的-OH 最大的吸收峰变窄,迁移至3 300.36 cm-1。在1 644.88 cm-1的吸收峰,是细胞蛋白质酰胺Ⅰ带,迁移至1 654.80 cm-1且吸收峰变强,是酰胺基的 C=O 的伸缩振动引起。位于 1 541.65 cm-1是由于N-H 键弯曲振动产生,吸附后迁移至1 534.86 cm-1且吸收峰增强。位于1 235.34 cm-1处吸收峰可能是C-O、O-H、C-N 键伸缩振动引起,吸附后迁移至1 232.08 cm-1且吸收峰变窄变强。在1 078.24 cm-1处的吸收带主要是由P=O、P-OH、PO43-等伸缩引起,吸附后迁移至1 064.04 cm-1且吸收峰变窄,相关研究表明磷酸基团只在死菌中参与对Cd2+的吸附,具有特异性[33]。位于 546.66 cm-1处的吸收峰是由C-N-S 的剪式弯曲振动引起,吸附后迁移至619.66 cm-1且吸收峰峰强度减弱。吸附前位于2 960.11、2 925.56 和2 853.33 cm-1的吸收峰是由蛋白质、糖类和物质中的C-H 键伸缩振动引起的,吸附后基团位置迁移不大,迁移至2 925.54 cm-1的吸收峰变强。综上分析,菌粉中含有的羟基、羰基、酰胺基、磷酸基等基团均参与了Cd2+的吸附过程。
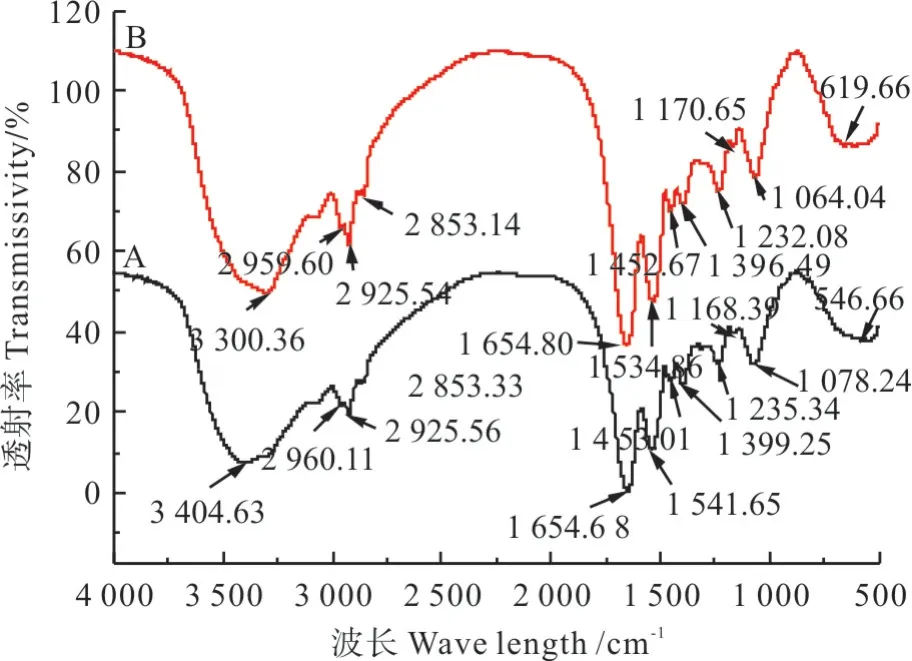
图6 LC 菌粉吸附Cd2+前后的红外光谱图Fig.6 Infrared spectra before and after Cd2+ adsorption by LC bacterial powder
3 结论与讨论
从镉污染土壤中筛选了一株耐镉菌株,经16S rDNA 测序鉴定为罗尔斯通氏菌Ralstoniaspp.,菌株对Cd2+质量浓度的耐受阈值为850 mg/L。通过单因素试验确定了菌粉对Cd2+的吸附规律,LC 菌粉对Cd2+的吸附量随着溶液温度的升高先增大后减小。随着溶液初始pH 值的增大,其吸附量先增大后减小。随着时间的延长,其吸附量先上升而后略微下降。随着Cd2+初始质量浓度的增加,其吸附量先增大后基本稳定。随着投加量的增多,其吸附量先减少后趋于平衡。菌粉对Cd2+的最佳吸附条件为:投加量0.1 mg/L,吸附时间2 h,pH 值6.0,温度30 ℃,在此条件下菌粉对Cd2+的吸附量可达198 mg/g。其中,投加量对菌粉吸附Cd2+的影响最大,温度最小。LC 菌粉对Cd2+的吸附过程更符合Langmuir 等温吸附模型,表明LC菌粉对Cd2+是一个单层面的吸附,饱和吸附量为221 mg/g。EDX 分析显示吸附后LC 菌粉表面检测到Cd2+的存在,表明LC 菌粉对Cd2+的吸附主要通过Cd2+与Na+、Mg2+发生离子交换;FTIR 分析表面LC 菌粉中含有的羟基、羰基、酰胺基、磷酸基等基团与Cd2+发生络合作用。菌株的耐受阈值在耐镉菌株中相对较高[19,21],但不如皮氏罗尔斯通氏菌[14],若研究活性菌株对Cd2+的生物积累作用,皮氏罗尔斯通氏菌将更具优势。而在本研究中,菌粉的吸附无须考虑菌株对重金属的耐性,LC 菌粉的吸附量高达198 mg/g,在已有的干菌体研究中具有较高的吸附量[16,20],为微生物修复提供了吸附能力强的功能菌株,但在实际应用中缺乏实践,对于综合废水的污染修复能力有待考察,还需进行进一步试验。

