四溴双酚A诱导大鼠肝脏氧化损伤机制的研究
何建波, 张杭君
(杭州师范大学 生命与环境科学学院,浙江 杭州 311121)
四溴双酚A(tetrabromobisphenol A, TBBPA)是目前使用较为广泛的典型溴化阻燃剂,是一种持久性环境污染物[1]。近几十年的研究[2]显示,TBBPA已在河流、水生生物甚至人体血液中检出。在日本大阪的水生动物中,鱼类体内和贝类动物体内TBBPA的浓度分别达到0.8 μg/kg·ww和4.6 μg/kg·ww。英国海域的海豚脂肪样品检测结果显示TBBPA的浓度范围为6~35 ng/kg·ww[3]。在美国波士顿的妇女母乳样品中,35%的样品检测到了TBBPA,浓度范围为0~11 ng/g·fat[4]。挪威某一电子拆解厂电子拆解工人血浆中的TBBPA浓度要高于实验室人员[5]。近年来,国际癌症研究机构(IARC)对TBBPA的毒性进行了评估[6],因具有致癌作用,TBBPA已被列入2A类致癌物。TBBPA在环境中广泛存在,动物和人类可通过呼吸吸入、皮肤接触和摄入等途径接触到TBBPA,这对环境中的动物和人类的健康造成巨大威胁[7]。
目前,大量的研究主要关注TBBPA对水生动物的影响,对哺乳动物的影响研究较少,尤其是对哺乳动物肝脏的损伤及其作用机制还尚未阐明。已有研究[8]发现,溴代阻燃剂容易在肝脏中富集。鲫鱼暴露于TBBPA 12周后发现,TBBPA能够引起鲫鱼肝脏中脂质积累、肝细胞出现空泡化、细胞间隙增大等现象[9]。Wikoff等[10]认为TBBPA在鱼体产生的毒性效应与氧化应激有关。TBBPA暴露可导致幼龄卿鱼抗氧化系统中超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)活力的降低,还原型谷胱甘肽(GSH)水平呈时间和剂量依赖性下降,造成机体氧化应激[6]。黑斑蛙暴露于TBBPA后,精巢组织出现空泡、生精细胞排列紊乱、生精细胞不同程度的分散脱落等明显病变;同时,黑斑蛙精巢组织中的总超氧化物岐化酶(T-SOD),GSH-PX活性降低,GSH含量明显降低,表明TBBPA暴露扰乱了黑斑蛙抗氧化系统[11]。本文以TBBPA为目标污染物,以雄性SD大鼠为研究对象,采用体内暴露方法研究TBBPA对雄性SD大鼠肝脏损伤的效应及其作用机制,为阻燃剂的生态健康风险研究提供依据。
1 材料与方法
1.1 试验动物 选取42只7周龄Sprague-Dawley雄性大鼠,体质量为(222.2±2.5)g,由杭州师范大学实验动物中心提供。大鼠饲养于SPF级实验动物饲育室:环境光照周期为12 h光照和12 h黑暗,温度为(23±2)℃,湿度为(50±10)%,自由饮食。正式试验前饲养1周适应新环境。所有实验程序均按照杭州师范大学实验动物中心实验动物伦理规定进行。
1.2 主要试剂与仪器 TBBPA(tetrabromobisphenol A,化学式:C15H12Br4O2,纯度>98%,CAS:79-94-7)标准品和玉米油(CAS:8001-30-7)购自上海阿拉丁生化科技股份有限公司,活性氧(ROS)、SOD、GSH和GSH-Px检测试剂盒均购自南京建成生物工程研究所。超薄切片机(Leica EM UC7)、烘片机(Leica HI 1220)和石蜡切片机(Leica RM 2235)均购自德国徕卡公司,透射光显微镜(Olympus BX 51)购自日本Olympus公司,酶标仪(Thermo Fisher Multiskan FC)购自美国Thermo公司,高度冷冻离心机(KDC-140 HR)购自安徽中科中佳科学仪器有限公司。
1.3 大鼠饲养与暴露 将42只SD大鼠随机分为4个处理组: 0、10、100、1 000 mg/kg;2个恢复组: 0(R)mg/kg(空白恢复组)、1 000(R)mg/kg(1 000 mg/kg剂量恢复组),每组7只。给药时,将TBBPA溶解于食用玉米油中,保存于冷藏条件下(约4℃),每周更换1次,保证给药溶液稳定性。每天上午9时对各组大鼠进行灌胃,对照组给予等量玉米油,连续灌胃35 d。暴露结束后,4个处理组进行解剖采样。2个恢复组停止灌胃,正常进食,自然恢复1周后进行解剖采样。每日准确记录体重,观察大鼠的生长发育情况。
1.4 大鼠肝脏组织样品采集 最后一次灌胃24 h后称重,4个处理组进行解剖采样,静脉注射0.5 mL70%乙醇使大鼠死亡后立即解剖。取出各器官组织,用滤纸吸干血水后准确称重。2个恢复组的大鼠自然恢复1周后进行解剖采样。肝脏系数=(肝脏质量/体质量)×100%
1.5 HE染色与观察 取各组新鲜肝脏组织样本1份,经中性缓冲液福尔马林(pH 7.4)固定12~24 h,用水冲洗30 min后脱水。用75%~100%乙醇梯度脱水后,放入85%、95%及100%二甲苯中透明。经过浸蜡、包埋后进行切片。切片厚度3 μm,然后经过脱蜡、HE染色、封片后,在光学显微镜下观察、拍照(×100),分析最大截面,观察肝脏组织形态。
1.6 活性氧与抗氧化相关指标检测 SOD测定(羟胺法):按试剂盒说明书应用黄嘌呤氧化酶法测定样品中的SOD活力,用U/mg蛋白表示;ROS测定(化学荧光法):按试剂盒说明书应用DCFH-DA法测定样品中的ROS活性,用荧光度量/毫克蛋白表示;GSH-Px测定:按试剂盒说明书应用黄嘌呤氧化酶法测定样品中的GSH-Px活力,用μmol/g蛋白表示;GSH测定:按试剂盒说明书应用黄嘌呤氧化酶法测定样品中的GSH含量,用μmol/g蛋白表示。
1.7 统计学分析 采用GraphPad Prism 7.00和 SPSS 20.0软件进行数据统计分析。计量资料2组间比较采用t检验,多组间比较采用方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度TBBPA暴露对大鼠肝脏的影响 连续灌胃35 d后,与0 mg/kg组比较,10 mg/kg组、100 mg/kg组、1 000 mg/kg组的大鼠平均体增重均降低;其中1 000 mg/kg处理组大鼠的平均体增重[(142.7±24.8) g]比0 mg/kg组[(218.5±33.3) g]减少了34.7%,差异具有统计学意义(P<0.05),见封三图1A。连续灌胃35 d后,各剂量组大鼠的平均肝脏重与0 mg/kg组比较未表现出明显差异,见封三图2B。经过1周自然恢复后,1 000 (R) mg/kg组平均肝脏重[(13.9±1.7) g]比1 000 mg/kg组[(12.2±1.5) g]增长了13.9%,平均体增重比1 000 mg/kg组增长了29.2%。如封三图1C所示,连续灌胃35 d后,TBBPA对大鼠的肝脏系数无统计学意义影响。
2.2 不同浓度TBBPA暴露对大鼠肝脏组织形态结构的影响 HE染色结果显示,连续灌胃35 d后,0 mg/kg 组肝脏组织形态正常(封三图2A);10 mg/kg组经四溴双酚A暴露后,肝脏细胞出现部分空泡(封三图2B,黑色箭头);100 mg/kg组细胞空泡化现象明显,并伴有细胞边界模糊现象(封三图2C,黑色箭头);1 000 mg/kg组出现空泡化现象的肝细胞数量相对较少(封三图2D,黑色箭头),但细胞膜边界模糊现象加重且细胞间隙增大。与1 000 mg/kg组比较,1 000(R)mg/kg组经1周恢复后,细胞空泡现象减少,肝细胞组织损伤有所减轻,与0(R)mg/kg组(封三图2E)相比,1 000(R)mg/kg组仍存在一定程度的形态学变化(封三图2F)。
2.3 不同浓度TBBPA暴露对大鼠肝脏ROS含量的影响 如图1所示,与0 mg/kg 组ROS含量[(84.3±18.5 )荧光度量/毫克蛋白]相比,经过TBBPA暴露35 d后,10 mg/kg组[(59.5±11.5) 荧光度量/毫克蛋白]、100 mg/kg组[(47.0±7.6) 荧光度量/毫克蛋白]、1 000 mg/kg组[(46.4±7.5) 荧光度量/毫克蛋白]的大鼠肝脏中ROS含量分别降低了29.4%、44.2%、45.0%,差异均有统计学意义(P<0.05)。恢复1周后,1 000(R)mg/kg组的ROS水平[(73.2±9.2 )荧光度量/毫克蛋白]比1 000 mg/kg组升高了57.8%,差异有统计学意义(P<0.05)。

**与0 mg/kg组比较,P<0.01;##与1 000 mg/kg组比较,P<0.01。图1 不同浓度四溴双酚A暴露后大鼠肝脏ROS水平的变化
2.4 不同浓度TBBPA对大鼠肝脏中T-SOD的影响 如图2所示,连续灌胃35 d后,与0 mg/kg 组相比,10 mg/kg组、100 mg/kg组T-SOD的活性升高; 1 000 mg/kg组大鼠肝脏T-SOD活性略低于10 mg/kg组和100 mg/kg组。自然恢复1周后,1 000(R)mg/kg组的T-SOD含量比1 000 mg/kg组降低12.6%,差异有统计学意义(P<0.05)。

#与1 000 mg/kg组比较,P<0.05。图2 不同浓度四溴双酚A暴露后大鼠肝脏T-SOD活性的变化
2.5 不同浓度TBBPA对大鼠肝脏GSH含量的影响 如图3所示,与0 mg/kg 组相比,在TBBPA连续暴露35 d后,10 mg/kg组、100 mg/kg组、1 000 mg/kg组大鼠肝脏组织中的GSH含量随着TBBPA浓度的上升逐渐上升;100 mg/kg组、1 000 mg/kg组的大鼠肝脏GSH含量分别比0 mg/kg 组上升了8.6%、27.3%,差异均有统计学意义(P<0.05)。1周自然恢复后,1 000(R)mg/kg组的GSH含量比1 000 mg/kg组降低了23.4%,差异有统计学意义(P<0.05)。

**与0 mg/kg组比较,P <0.01;##与1 000 mg/kg组比较,P <0.01。图3 不同浓度四溴双酚A暴露后大鼠肝脏GSH含量的变化
2.6 不同浓度TBBPA对大鼠肝脏中GSH-Px活性的影响 如图4所示,与0 mg/kg 组[(73.7±17.2 )μmol/g蛋白]相比,在TBBPA连续暴露35 d后,10 mg/kg组、100 mg/kg组、1 000 mg/kg组大鼠肝脏组织中的GSH-Px活性随着TBBPA浓度的上升逐渐上升;1 000 mg/kg组的大鼠肝脏GSH-Px活性[(106.5±12.83) μmol/g蛋白]比0 mg/kg 组上升了44.5%,差异有统计学意义(P<0.01)。1周自然恢复后,1 000(R)mg/kg组的GSH-Px活性与1 000 mg/kg组比较,差异无统计学意义(P>0.05)。
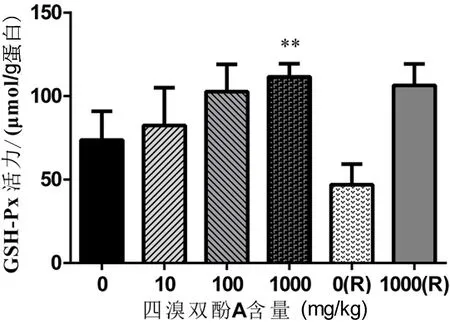
**与0 mg/kg组比较,P<0.01。图4 不同浓度四溴双酚A暴露后大鼠肝脏GSH-Px含量的变化
3 讨论
有研究[12]证实,TBBPA对水生生物的生存、繁殖和生长发育有一定的危害。斑马鱼暴露于TBBPA会导致产卵量和幼鱼存活率下降[13]。也有报道[14]称,TBBPA会干扰斑马鱼胚胎幼体的发育。研究[15]显示,TBBPA暴露导致斑马鱼胚胎孵化率、存活率降低,胚胎畸形率增加。也有研究[16]发现,TBBPA 会抑制蝌蚪尾巴的发育。250 μg/L TBBPA暴露可抑制黑斑蛙蝌蚪的生长发育[11]。本研究结果显示,1 000 mg/kg TBBPA体内灌胃可导致大鼠体增重明显下降,与正常组大鼠体增重相比降低了34.7%,对大鼠的生长发育产生抑制作用。先前的研究[17]显示,长期低剂量暴露于双酚A(BPA)的大鼠体质量和肝脏系数并未受到影响。100 mg/kg BPA染毒6周对大鼠体质量无明显影响[18],200 mg/kg剂量BPA暴露会导致大鼠体质量增长缓慢[19],提示TBBPA对大鼠生长发育的影响要强于化学结构更简单的BPA。
大量生态健康风险研究[20]报道,环境中广泛存在的阻燃剂能够对动物体造成病理性的损伤。接触溴化阻燃剂异氰脲酸酯,能引起小鼠肝脏组织结构受损[21]。有机磷酸酯阻燃剂暴露可造成斑马鱼肝脏细胞肿胀,细胞边界模糊等[22]。黑斑蛙接触全氟辛酸(perfluorooctanoic acid,PFOA)会导致肝脏细胞出现边界模糊及空泡化现象[23]。有研究[11]显示,TBBPA可造成黑斑蛙精巢组织损伤,肝细胞出现空泡等病理学特性。TBBPA可在小鼠肝脏内蓄积,对小鼠肝脏造成潜在危害[24]。本研究结果显示,暴露于TBBPA后,大鼠肝脏组织学出现病理性损伤,包括肝细胞肿胀、细胞空泡化及细胞膜边界模糊等现象;随着TBBPA暴露浓度的升高,大鼠肝脏组织损伤更为明显。Ronn等[25]的研究结果显示,短期高浓度(250 mg/kg)BPA暴露会造成Fischer 344大鼠肝脏氧化损伤,这与本研究结果一致,提示高浓度的阻燃剂对哺乳动物肝脏具有一定损伤作用。
细胞内ROS的稳态是机体正常代谢的保障[26]。在正常情况下,过量的ROS和其他促氧化剂可由抗氧化防御系统相关抗氧化酶分解,以维持生物体内氧化抗氧化的平衡[27]。有研究[28-29]报道,化学试剂等危险因素可能破坏细胞内氧化还原平衡,进一步造成机体损伤。研究[30]显示,TBBPA暴露可诱导鱼类抗氧化系统失衡,最终造成精子质量下降。TBBPA引起的靶器官毒性作用可能是通过诱导机体抗氧化系统紊乱造成的。机体内抗氧化系统通常会通过响应ROS的变化来调节氧化与抗氧化系统的平衡。有研究[11]显示,黑斑蛙暴露于TBBPA后,ROS水平降低,造成黑斑蛙精巢中抗氧化系统的失衡,最终导致精细胞结构损伤。本研究结果显示,TBBPA可造成大鼠肝脏中ROS水平异常,1 000(R)mg/kg组的ROS水平比1 000 mg/kg组升高了57.8%,与 0(R)mg/kg组水平接近;有报道[31]显示,BPA可造成氧化系统失衡,导致大鼠肝脏组织氧化性损伤;提示TBBPA通过影响大鼠肝脏ROS水平破坏氧化还原平衡而肝脏造成氧化损伤。
SOD、GSH-Px活性与GSH含量是反应机体健康的重要指标。SOD可通过歧化反应消除超氧阴离子自由基,生成过氧化氢[32],对机体内氧化抗氧化系统平衡起重要作用,可保护细胞免受损伤。当蚯蚓受到轻度环境胁迫时, 体内SOD酶活性会有所提高, 而当受到重度逆境胁迫时, SOD酶活性通常下降[33-34]。有研究[19]表明,随着BPA剂量的升高,SOD水平会有一定程度的降低,可能与高剂量时GSH-Px无法代偿性增加有关,这与本研究结果一致,表明在高剂量下,TBBPA可能会对大鼠体内存在的SOD酶活性产生影响,使大鼠对氧化胁迫的能力降低[35],减弱大鼠清除氧自由基的能力。GSH可保护细胞免受氧化应激诱导的氧化损伤,提供最佳的氧化还原环境,使细胞内蛋白功能正常进行。研究[24]表明,Wistar大鼠暴露于TBBPA 28 d后,可导致大鼠GSH含量上升,产生肝毒性效应。Zieminska等[36]研究结果与本研究结果一致,TBBPA浓度与GSH呈剂量依赖效应,表明TBBPA会引起GSH水平异常。GSH-Px是机体中重要的抗氧化酶, 是自由基清除系统的重要组成成分。研究[37]表明,暴露于BPA下的大鼠GSH-Px活性升高,与本研究结果一致。本研究结果显示,随着TBBPA浓度的增加,抗氧化酶GSH-Px活性也随之增加,可能导致氧化系统与抗氧化系统失衡,最终导致氧化损伤。
综上所述,1 000 mg/kg TBBPA体内暴露可抑制SD大鼠的生长,大鼠肝脏组织出现病理学损伤。通过对肝脏中SOD、ROS、GSH和GSH-Px活性的影响,TBBPA破环大鼠肝脏中氧化还原系统的平衡,最终造成肝脏的氧化损伤效应,进而抑制其生长发育。本研究可为四溴双酚A生态健康风险评价提供理论依据。

