元宝枫籽对小鼠肠道菌群生态的影响
孙朋浩,薛玉环,吴永继,任 玮,郑 伟,朱晓岩,赵善廷,*
(1.西北农林科技大学动物医学院神经生物学实验室,陕西 杨凌 712100;2.西北农林科技大学资源环境学院,农业农村部西北植物营养与农业环境重点实验室,陕西 杨凌 712100)
元宝枫为槭树科槭属植物,为中国特有树种,其籽仁含油率可高达48%,最近研究发现元宝枫油中含有5%~6%的神经酸[1-4],元宝枫籽是一种营养丰富的天然食品,民间早有炒食元宝枫籽的习惯。2011年3月22日中华人民共和国卫生部第9号文件批准元宝枫籽油为新资源食品,自此元宝枫籽油正式进入我国食用植物油行列。已有研究表明元宝枫籽油具有促进大脑发育、修复受损神经元、抑菌及抗肿瘤的作用[2-4]。
2000年,诺贝尔生理学/医学奖获得者Lederberg提出:人是由人体自身的真核细胞及与人共生的微生物细胞共同组成的“超级生物体”[5]。2016年Sender等重新估算了人体肠道细菌的数量,发现其与人体细胞的数量比约为1.3∶1[6]。这些细菌编码330多万个基因,大约是人类基因组150 倍,可谓人类的“第二基因组”[7]。肠道菌群与宿主进行着活跃的代谢交换和共代谢,参与机体的免疫调剂、神经调节、物质消化和吸收等诸多方面内容[8-9]。肠-脑轴是肠和脑之间的信息交流系统途径,越来越多的研究发现,肠道菌群能够通过脑-肠轴影响脑的活动甚至宿主行为[8]。
将元宝枫籽作为食品,如何影响肠道菌群?肠道菌群在消化系统中扮演了重要的角色,宿主肠道菌群的建立起始于出生后,到了成年时期,肠道菌群已经基本稳定,对非内源性的细菌具备了高度的抗定植能力[9-11]。肠道菌群的结构组成受到多种因素的影响:遗传背景、生活环境、饮食等,其中饮食结构对于菌群结构变化的影响最为深刻[12-15]。饮食可通过多种机制影响肠道菌群的组成和活性,目前认为,饮食可以给予某些特定的能利用其成分的细菌选择性生长优势,从而成为改变肠道微生态的主要驱动力[12-15]。早期的体外实验发现元宝枫籽具有抑菌的作用[3],本实验旨在探究元宝枫籽作为食品对宿主肠道菌群的调整作用以及对有害菌的抑制作用。
如何观察肠道菌群的组成结构及其变化?微生物纯培养技术是研究微生物学的经典方法,然而,微生物的数量和多样性巨大,至今仅有极小部分物种被成功分离培养[16]。随着高通量测序技术的发展和测序价格的下降,标记基因分析方法已经成为微生物组学分析的有力工具[17-19]。本实验通过Illumina HiSeq 2500测序系统对细菌16S RNA编码区域进行扩增注释,以评估元宝枫籽作为食品对小鼠肠道菌群结构的影响以及对肠道内有害菌的抑制作用。
1 材料与方法
1.1 动物、材料与试剂
8 周龄清洁级雄性昆明小鼠,体质量约28~30 g,购于第四军医大学,生产许可证号:SCXK(军)2002-005。
元宝枫籽购于辽宁彰武,炒制。
DNA提取试剂盒 上海MO BIO Laboratories公司;HiSeq Rapid SBS Kit v2测序试剂盒、文库构建TruSeq DNA PCR-Free Sample Prep Kit 美国Illumina公司。
1.2 仪器与设备
Qubit 2.0实时荧光定量聚合酶链式反应仪 美国Thermo Fisher公司;HiSeq 2500系统 美国Illumina公司。
1.3 方法
1.3.1 小鼠分组
将小鼠随机分为对照组(C)和实验组(Y),每组各10 只。在实验组的日粮中每天加入1.5 g元宝枫籽,连续饲喂2 周,对照组正常饲喂。
1.3.2 小鼠粪便的采集
将小鼠置于干净空旷的鼠笼中,待粪便排出后,迅速用无菌镊子夹取粪便于无菌1.5 mL EP管中并置于冰盒中保存;同一批样品采集完成后,统一将装有粪便的EP管用液氮处理,暂时保存于-80 ℃冰箱中。
1.3.3 粪便样品预处理
称取220 mg粪便于2 mL微量离心管中,加入1.4 mL裂解缓冲液,漩涡混匀,70 ℃孵育5 min,重复2 次。吸取1.2 mL上清液至2 mL微量离心管,加入1 片InhibitEX,立即漩涡1 min至InhibitEX片完全悬浮,室温下孵育1 min,吸附破坏样品中的DNA破坏物质和PCR抑制剂,离心3 min,吸取所有上清液至1.5 mL离心管,再离心3 min。
1.3.4 DNA提取
根据试剂盒说明书,从预处理后的样品中提取总细菌DNA。通过A260nm/A280nm和A260nm/A230nm的比率评估DNA质量和数量,然后将DNA储存在-80 ℃条件下,待进一步处理。
1.3.5 16S rDNA测序分析
用通用引物(F:5’-ACTCCTACGGGAGGCAGCA-3’;R:5’-GGACTACHVGGGTWTCTAAT-3’)结合适配序列和条形码序列扩增细菌16S rRNA基因的V3~V4区,进行聚合酶链式反应(polymerase chain reaction,PCR)扩增。最后用Quant-it™dsDNA-HS试剂对所有的PCR产物进行定量,并汇集在一起。在HiSeq 2500平台(2×250 对末端)上对纯化的汇集样本进行高通量测序。
1.3.6 高通量测序数据分析
根据下机序列之间的重叠关系,将HiSeq测序得到的双端序列数据拼接成一条序列Tags,同时对序列的质量和合并的效果进行质控过滤。使用QIIME 1.8.0[20]软件中的UCLUST[21]算法对Tags在97%的相似度水平下进行聚类并获得操作分类单元(operational taxonomic units,OTU),并基于Silva分类学数据库对OTU进行分类学注释。后续结果分析依靠QIIME和R等软件,对不同组间和组内的样本进行Alpha多样性分析和Beta多样性分析。
1.4 数据统计分析
实验数据统计分析以及绘图使用SPSS 25.0以及R 3.5.3软件完成。采用方差分析法进行组间差异显著性比较。
2 结果与分析
2.1 体质量变化
实验过程中,每天记录小鼠体质量,将连续3 d的数据合并取平均值,进而统计实验组和对照组的体质量变化趋势,结果发现实验组和对照组小鼠体质量变化趋势相近,无统计学差异。
2.2 测序数据质量评估
将HiSeq测序得到的双端序列数据使用FLASH 1.2.7软件拼接成一条Tags后,对拼接后的Tags使用Trimmomatic 0.33软件进行过滤,去除过长和过短的序列,得到高质量的Tags;使用UCHIME 4.2鉴定并去除嵌合体,最终得到有效数据。实验组和对照组中每个样本测序后的有效序列数均在6×104条左右,表明本实验的测序质量较高,可以用于后续的分析。
2.3 OTU分析结果
使用QIIME 1.8.0软件中的UCLUST算法对预处理后的Tags在97%的相似度水平下进行聚类、获得OTU。通过聚类后,实验组和对照组的样品聚类后的平均OTU数目均在400以上,表明样品序列的聚类结果比较可靠,可用于下一步样品序列的注释,并且再一次表明本次实验的测序质量比较高。
2.4 Alpha多样性变化分析结果

如图1所示,实验组和对照组的ACE平均指数和Chao1平均指数相近,表明两组内肠道菌群的物种数量比较相近;相比于对照组,实验组的Simpson平均指数要高一些,而Simpson平均指数与Alpha多样性成反比;两组的Shannon平均指数相近。综合这4 个指数可以发现:实验组和对照组中肠道菌群的物种数量比较相近,实验组菌群组成的均匀度要低于对照组。但是对于这4 个指数,组间并未表现出统计学差异。
2.5 Beta多样性变化
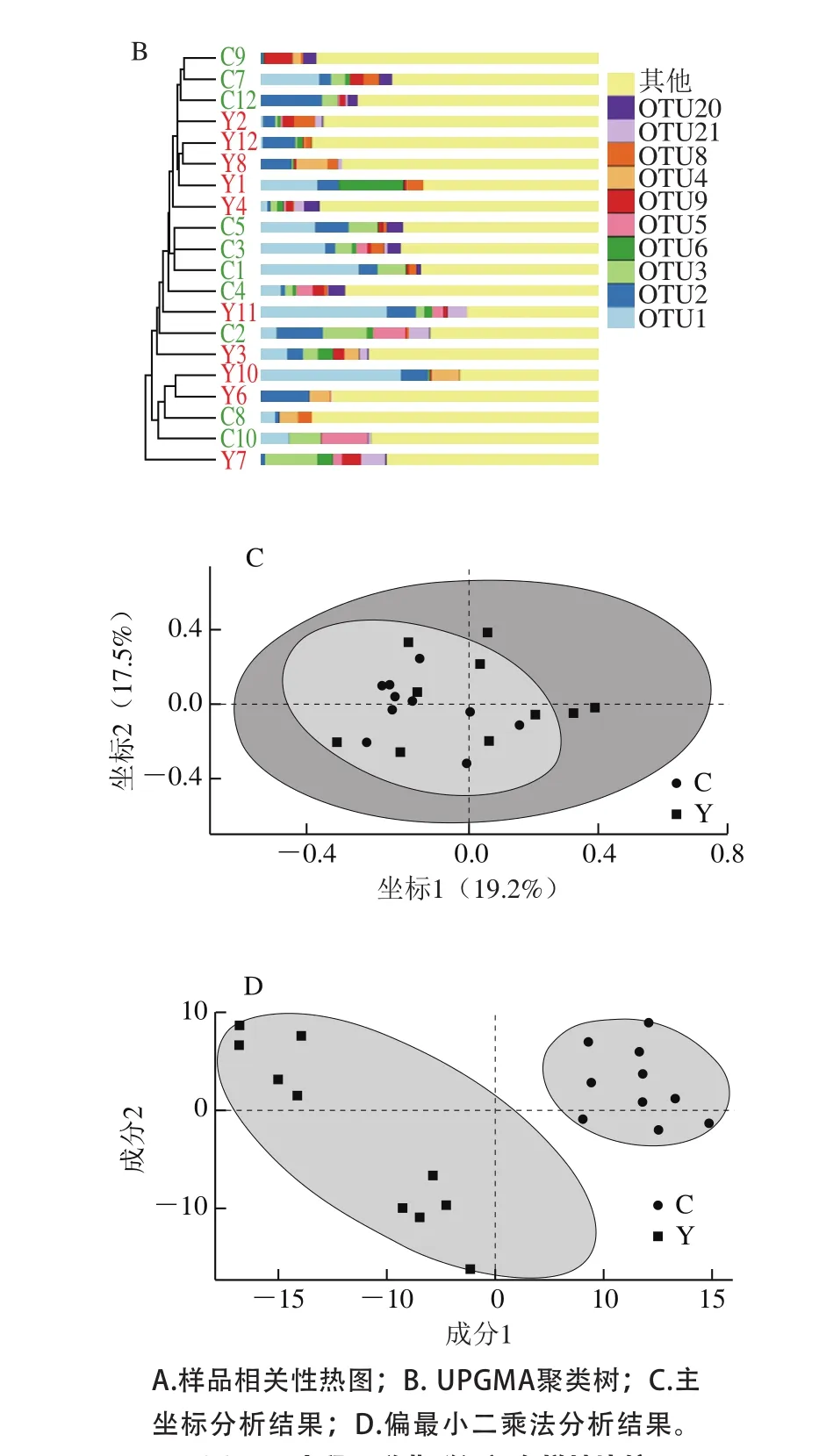
图2 小鼠肠道菌群组间多样性比较Fig. 2 Comparison of the diversity of intestinal flora between groups
使用QIIME软件进行Beta多样性分析,比较不同样品在物种多样性方面存在的相似程度。通过样品相关性热图(图2A)和UPGMA聚类树(图2B)对所有样品进行聚类分析,发现组内个体聚类较为集中统一,而组间聚类分离比较明显,表明在元宝枫籽的干预下,实验组和对照组小鼠的肠道菌群结构发生了比较明显的改变。
为了进一步描述不同样品的物种多样性差异,对数据进行了主坐标分析(principal co-ordinates analysis,PCoA)(图2C)。通过PCoA分析可知,实验组和对照组数据在第一解释因素和第二解释因素构成的象限下发生明显的分离(PERMANOVA:P<0.041;R2=0.0939 46),这表明实验组和对照组的肠道菌群的物种结构组成存在显著性差异。
考虑到实验数据的高维情况,为了弥补PCoA的不足,进行了偏最小二乘法(partial least squares regression,PLS-DA)分析(图2D)。图2D结果发现实验组数据和对照组数据依然可以发生很好的分离,因而认为在元宝枫籽作为食物的影响下,实验组和对照组的肠道菌群的物种结构组成存在显著性差异。
2.6 菌群结构分析
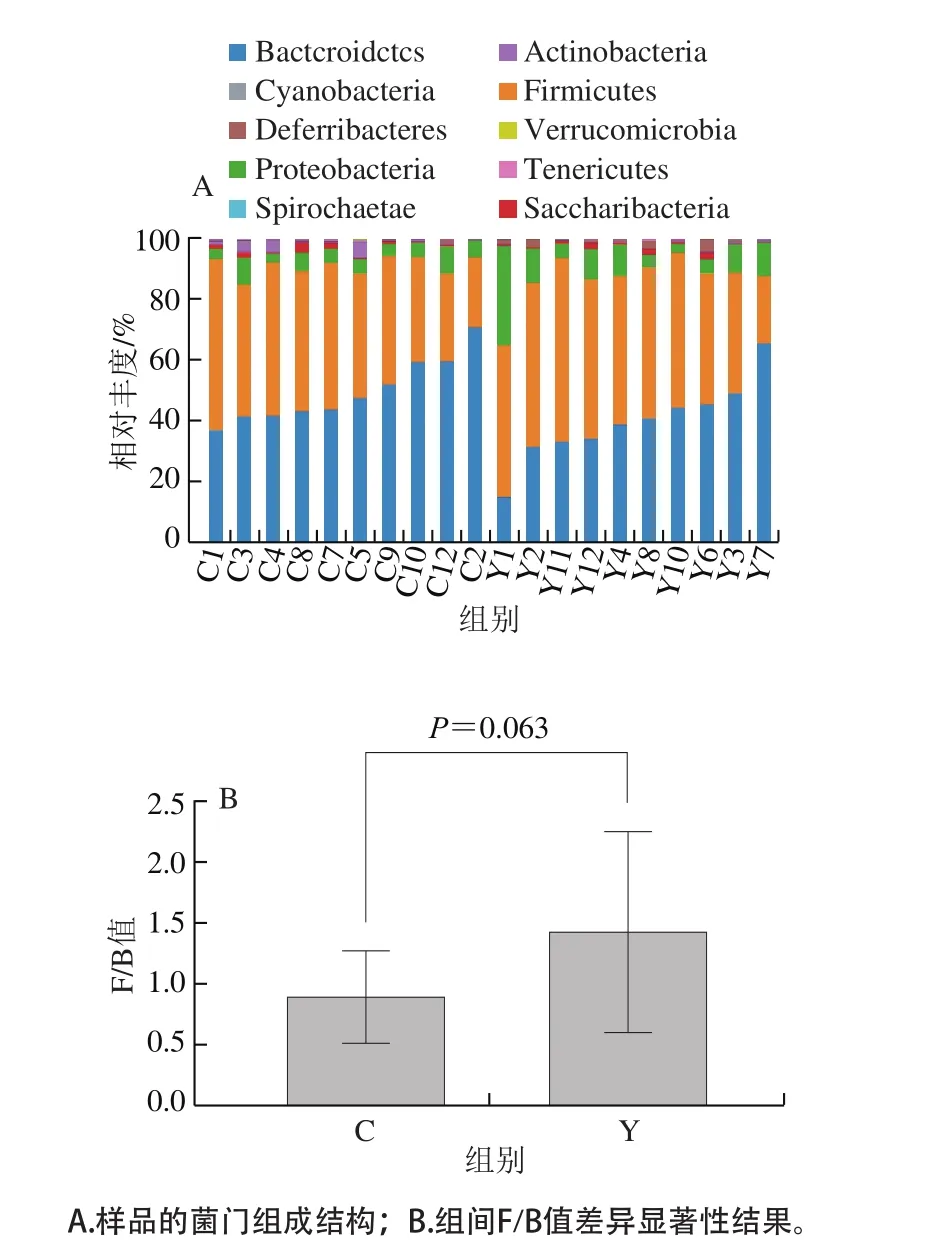
图3 门分类学水平的细菌结构组成Fig. 3 Bacterial community structure at phylum level
将OTU的代表序列与微生物参考数据库(Silva数据库)进行比对,进行分类学注释得到不同分类学水平的结果。图3展示的是门分类学水平的分类结果,可以看出:无论是实验组还是对照组,厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)均为其优势菌门;比较组间丰度变化发现,相比于对照组,实验组中厚壁杆菌门相对丰度上升而拟杆菌门的相对丰度下降,比较厚壁杆菌门和拟杆菌门相对丰度比值(F/B)的变化,发现实验组F/B平均值要高于对照组(P=0.063)。
图4是实验组和对照组中各个样品属水平的分类学结果,比较组间和组内数据发现:首先是组内数据变异比较大,同一菌属在不同样本对象的表达丰度差异变化比较大,因此也难于直接比较组间的数据差异。对于不同组间菌属的表达丰度差异,借助非参数检验统计以及机器学习等方法进行分析,这一点在后面会详述。但是可以看出:Lactobacillus、Lachnospiraccac NK4A136 group、Bacteroides、Prevotella-1以及Alloprevotella菌属在对照组和实验组中均为优势菌属。

图4 属分类学水平的细菌结构组成Fig. 4 Bacterial community structure at genus level
2.7 组间差异物种鉴定
组间差异显著性分析主要用于发现不同组间具有统计学差异的生物对象。图5A为线性判别分析效应量(linear discriminant analysis effect size,LEfSe)分析结果(本次实验分析的LAD值设为2.0)[22-23]。图5B是随机森林分类器筛选后门水平的评分结果,图5C是随机森林分类器筛选后属分类水平的评分结果。将LEfSe和随机森林的分析结果结合,筛选出重要性评分高且存在组间显著性差异的对象,认为这些是存在于组间有意义的差异物种(图6、7)。

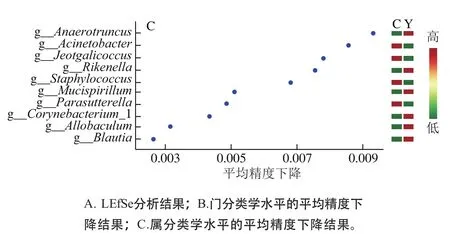
图5 小鼠肠道菌群组间差异显著性分析Fig. 5 Significance analysis of difference in intestinal flora between groups
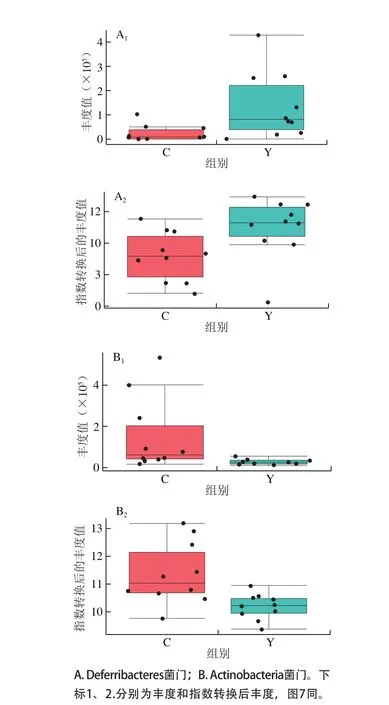
图6 小鼠肠道菌群组间门水平差异物种Fig. 6 Difference in intestinal flora between groups at phylum level
图6 为门分类学水平的组间差异对象结果,分别为脱铁杆菌门(Deferribacteres)和放线杆菌门(Actinobacteria);其中,实验组中脱铁杆菌门的平均丰度要高于对照组,而放线杆菌门的平均丰度要低于对照组。由于门分类学水平下包含许多菌属,且不同菌属对宿主的影响不尽相同,所以尽管发现了这两个差异的门水平对象,却难以直接描述这种差异变化对宿主的影响。但是这种差异现象是应该被注意到的,因为它往往表征的是一种趋势性变化,而这种变化趋势往往具有比较好的表现性和重复性,易于不同的实验结果之间进行比较和解读。

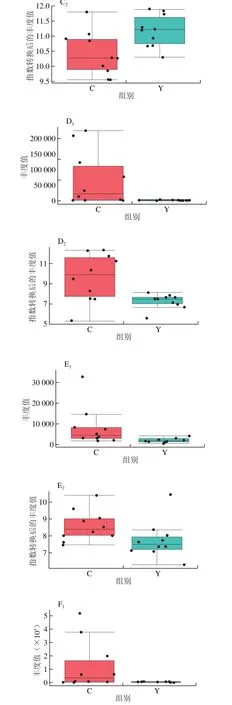

图7 小鼠肠道菌群组间属水平差异物种Fig. 7 Difference in intestinal flora between groups at genus level
图7 为属分类学水平组间差异种属,实验组中Mucispirillum、Rikenella和Anaerotuncus的平均丰度要高于对照组,而Staphylococcus、Acinetobacter和Corynebacterium_1的平均丰度要低于对照组。Mucispirillum被报道作为结肠黏膜层的健康标记物,它在病原微生物感染早期表现为丰度下降,在恢复期(病原体被清除之后)丰度回到正常水平;Staphylococcus和Acinetobacter均是被广泛报道的条件致病菌,当机体抵抗力降低时易引起机体感染,是造成医院内感染的重要机会致病菌之一,在2017年世界卫生组织公布的十二大耐药性细菌中,Acinetobacter赫然排名在级别1——严重耐药性的第一名。
2.8 共性网络分析
共性网络分析通过将不同属性的对象抽象为节点,并用连接来展示不同节点之间的关系,通过量化以节点和连接为组件的网络结构指数,从而能够在统一的框架下寻找复杂系统的共性。在纷杂的共性网络里面,很难确定某几个节点之间确切的关系,但是可以借助其寻找联系紧密的特定群组或者反应群体的结构组成特征。
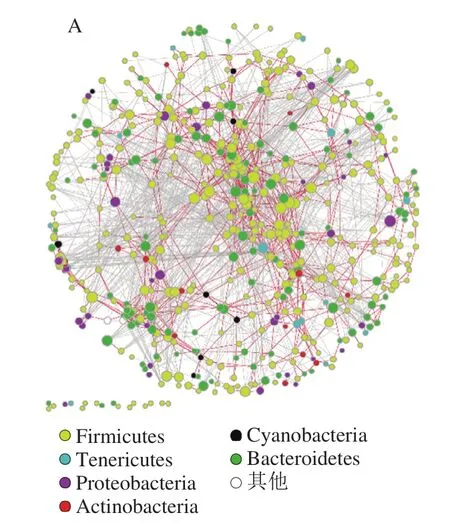
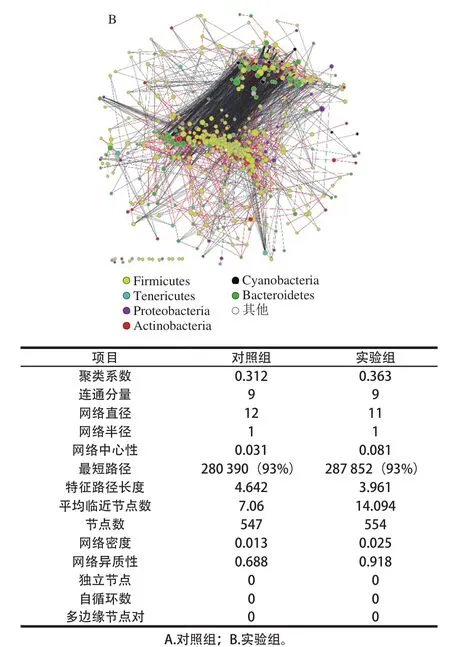
图8 小鼠肠道菌群网络分析图Fig. 8 Network analysis of intestinal flora in mice
由图8可知,无论是对照组还是实验组,厚壁菌门和拟杆菌门构成了主要的节点聚合中心,但是对照组中厚壁菌门和拟杆菌门的节点分布相对比较分散均一,而实验组中拟杆菌门和厚壁杆菌门呈现出两极分离的趋势,这提示实验组中门水平的物种结构关系已经发生了改变。
2.9 肠型的鉴定
按照属水平聚类分析方法划分肠型,根据肠型分类结果发现:在对照组中20%的个体属于1类肠型(ET B),80%的个体属于3类肠型(ET F);在实验组中,40%的个体属于1类肠型(ET B),60%的个体属于3类肠型(ET F)。
3 讨 论
神经酸在大脑和神经组织中含量较高,常作为脑中白质的标志物,神经酸因为能够修复受损的神经元并促进神经细胞再生而备受关注[2-3]。神经酸以往的来源主要依靠鲨鱼,随着国际社会禁捕鲨鱼,各国政府和研究机构开始把方向转向从植物中提取神经酸[24]。欧乞鍼从蒜头果树的种仁油中发现了神经酸,其质量分数高达67%[25]。但因蒜头果树属国家二级保护植物,其开发利用受到一定限制。王性炎教授等从槭树乔木元宝枫的籽中也发现了神经酸,其在元宝枫油中的含量在5%~6%[26]。元宝枫是中国含神经酸木本植物的一个特有树种,目前仍是提取神经酸的主体资源[27]。研究发现,元宝枫油对大肠杆菌、枯草芽孢杆菌和黄曲霉菌具有明显的抗菌作用[3]。
为了研究饮食对肠道菌群的影响,可以通过长期饮食习惯或饮食干预方法分别了解其长期及短期影响[28-32]。饮食作为肠道菌群的一种生态驱动力,使肠道菌群能适应其暴露的饮食结构,有研究发现:肠道菌群能够反映宿主的饮食习惯、肠道结构和生理状况[13-14]。本实验将元宝枫籽作为食物饲喂小鼠,饲喂2 周后,检测小鼠肠道菌群的组成结构的变化。根据高通量测序的结果,发现实验组和对照组之间Beta多样性发生了显著性的差异,这表明在通过元宝枫籽进行饮食干预后,实验组的肠道菌群组成发生了显著性的改变,那么如何去评价这种改变呢?从两个方面去尝试分析:物种分类学上的差异改变,即肠道菌群的物种结构组成;肠道菌群功能组成上的变化。
首先进行LEfSe分析,LEfSe分析是基于非参数检验方法确定不同组间的差异对象,然后进行对象的亚类判定,建立线性判别分析模型,最终得到特定分类水平下的差异物种列表及差异对象的效应值。这种方法是基于统计学的显著性差异来筛选对象的,那是否统计学差异就等同于生物学意义上的差异?为此引入了随机森林分类器,随机森林是基于决策树的集成学习算法,通过对每个基本分类器的分类结果进行组合,来决定待分类样本的归属类别[33]。通过对每一分类学水平内包含的对象进行重要性评分,按照从高到低排序,决定哪些对象是重要的,值得注意的是:这里的重要性不等同于统计学上的差异显著性。通过结合这两种分析筛选方法,在门水平和属水平分别找出了组间差异的物种,在属分类学水平的对象中,实验组中Mucispirillu的平均丰度要高于对照组。正如结果分析部分中提到的,Mucispirillum是一种已经被报道的宿主健康状态下的标志菌属,其丰度变化常与肠道炎症的发展进程相关。Mucispirillum常在结肠远端的外层肠黏膜表面形成集群,在病原菌属进攻损伤肠黏膜的时候,Mucispirillum的丰度往往会下降;黏膜层完整的恢复开始于病原体清除后一段时间内,于此同时,Mucispirillum的丰度也会逐渐恢复到健康水平,因此,Mucispirillum能作为远端结肠表层黏膜层健康水平的标记物,用于表征潜在的炎性结肠炎;其他细菌类型标志物,如梭菌属和乳杆菌属,在病原体消失后这些标志物丰度也会增加。于此同时,实验中Staphylococcus和Acinetobacter的平均丰度要低于对照组,这两种菌属是已经被广泛报道的机会性致病菌,Acinetobacter更是公认的严重耐药菌属。尽管这两种菌属在正常宿主机体内不发病,但是当宿主免疫水平降低或者遭受其他病理性因素影响时,这些菌属往往会成为继发感染的菌属[34-35]。
肠道菌群行使多种代谢分解功能,每个功能的实现往往是多种细菌相互协同拮抗来实现的,因此,在考虑不同分类学水平上单个差异物种的同时,更应该去分析不同因素干预下菌群功能组成上的变化[36]。群体分型是一种有助于更好地理解人类身心健康等复杂生物学问题的有效方法,将这种方法应用于肠道微生物中,可以将不同的群落组成定义为肠型,肠型的意义在哪里呢?个体间微生物群落存在着巨大的差异,同时微生物群落变化还表现出不同的阶段性,目前,在大群体和跨地理研究中,还很难简单地描述如此复杂的生物现象,部分原因是有些菌属在不同个体间表现为单峰,而另外一些菌属又表现出双峰或者更复杂的分布模式,因此确定微生物群落组成的结构模式及其背后的组装机制是非常必要的[37]。对每一种肠型的特性研究,发现共存的微生物网络中心存在一种驱动类群,即这一类微生物与给定的肠型最相关。在人类的微生物组学研究中,一种常用的肠型划分方法是基于肠道菌群的属分类学水平分类进行划分,大致可以分为3 个肠型:肠型1(ET B)、肠型2(ET P)和肠型3(ET F)[38]。尽管动物的肠道菌群与人类不同,但是在控制实验中,聚类方法可以将小鼠的肠道菌群划分成明显的集群,这表明,当没有外部因素影响微生物群落时,更容易出现聚集的群落状态[38]。因此,肠型并不是人体肠道菌群特有的,动物中同样存在这些现象。将数据上传到肠型在线分类器主页(http://enterotypes.org/),得到肠型分类结果,发现实验组中1类肠型的比例上升,3类肠型的比例下降。这个差异变化,在图8中也得到了验证。通过饲喂元宝枫籽影响了实验组中小鼠群体的肠型结构组成,这为其他研究人员做相关平行研究提供了参比数据。

