高温和HgCl2 复合处理对水稻花期生理特性和 水通道蛋白基因表达的影响
胡挺帅,郑梦琪,郑嘉琪,罗心怡,张志友,潘伟槐,郭天荣,莫亿伟
(绍兴文理学院生命科学学院,浙江 绍兴 312000)
近年来,连续高于35 ℃的高温天气已成为中国南方水稻种植的自然灾害之一[1]。2013 年7 月下旬至8 月上旬,江淮稻区出现持续异常高温天气,给水稻产量造成极大损失[2]。前人[3-4]研究发现,水稻抽穗开花期、花粉母细胞减数分裂期和籽粒充实期对高温胁迫最为敏感;高温引起的水分胁迫对籽粒及胚乳的发育影响较大[5],且籽粒形态和产量还受穗期和花期水分亏损程度的影响[6]。稻穗水分和养分主要由剑叶供给[7],水分供应离不开水通道蛋白活性和基因的表达。水通道蛋白主要有质膜嵌入蛋白(plasma membrane intrinsic protein,PIP)、液泡膜嵌入蛋白(tonoplast intrinsic protein,TIP)、类Nod26 嵌入蛋白(nudolin 26-like intrinsic protein,NIP)和膜嵌入小分子碱性蛋白(small basic intrinsic protein,SIP)[8]。研究表明,在稻穗花期,OsTIPs基因家族表达量最高,其次是OsPIP基因家族[9];超表达水通道蛋白基因可提高水稻和烟草对水分胁迫的耐性,增强植物体内的水分运输速率[10-11]。水通道蛋白抑制剂HgCl2处理可导致水分胁迫[12],但对花期水通道蛋白活性及水分运输机制尚不清楚。为此,本研究以转OsPIN1a的基因水稻为材料,探讨高温胁迫及HgCl2处理对水稻花期的生理特性和水通道蛋白基因家族表达的影响,旨在探明花期高温胁迫和水通道蛋白活性与稻穗水分供应的关系。
1 材料与方法
1.1 材料
供试水稻材料中花11为转OsPIN1a基因水稻[13],由绍兴文理学院生物实验中心保存。
1.2 方法
1.2.1 试验设计
2018 年,在绍兴文理学院生物实验基地进行试验。盆栽种植,常规水肥管理。从稻株主茎和次二茎处于幼穗分化第7 期时开始,选取穗型大小基本一致的30 个稻穗挂牌标记发育时期,采用记号笔点颖和挂牌相结合的方法标记开花时间[14]。参考张桂莲等[15]的方法,在开花前6 d 进行高温与水通道蛋白抑制剂处理:对照处理(CK),人工气候箱设置昼夜温度为30 ℃(7: 00—17: 00)/28 ℃(17: 00 至翌日7: 00);高温处理(TR1),昼夜温度为38 ℃(7: 00— 17: 00)/33 ℃(17: 00 至翌日7: 00);复合处理(TR2),高温处理配以 0.1 mmol/L HgCl2处理(每天8: 00,用0.1 mmol/L HgCl2喷施叶片1 次,直到叶片有水滴滴下为止)。处理期间相对湿度控制在80%左右,光照强度为900 μmol/(m2·s)。处理结束后置于自然条件下培养。在花前6 d 至花后6 d 内(称前6 d、前4 d、前2 d、0 d、后2 d、后4 d 和后6 d,盛花期当天标记为0 d),每隔2 d 取稻穗或剑叶,用于试验分析。试验重复3次。
1.2.2 相对含水量的测定
每次随机取新鲜稻穗5~6 个,剑叶10~15 片,分别称量鲜质量(W1);用清水浸泡12 h 后,用吸水纸吸干表面水分,称重(W2);再105 ℃杀青10 min,75 ℃烘干至恒重,称干质量(W3)。计算各处理下稻穗和剑叶的相对含水量C。C=(W1-W3)/(W2-W3)× 100%[9]。试验重复3次。
1.2.3 柱头和花粉粒的线粒体活性染色和淀粉粒结构观察
用50 mmol/L 磷酸缓冲液(pH 7.2)配制0.5%詹纳斯绿B 染液,剪取开花当天的颖花,去掉颖壳后,用詹纳斯绿B 染液对柱头和花粉粒染色10 min,再用磷酸缓冲液浸泡2 次,清洗表面残留染料,在光学镜下观察有活性线粒体的染色情况。成熟籽粒干燥后,参考冯芳玖等[13]的方法,每种处理选取20个稻穗,统计结实率和千粒质量,用扫描电镜(JSM-6360LV)观察不同处理籽粒中部胚乳细胞内的淀粉粒结构。试验重复3次。
1.2.4 水通道蛋白基因的表达分析
经TR1 或TR2 处理后,取剑叶中部的叶片,用RNA 试剂盒(Takara Bio Inc.,Dalian)提取RNA后,反转录获得cDNA,备用。
利用实时荧光定量PCR 分析液泡膜水通道蛋白基因OsTIP1–1、OsTIP2–1、OsTIP2–2、OsTIP3–1、OsTIP4–1、OsTIP4–2、OsTIP4–3、OsTIP5–1和质泡膜水通道蛋白基因OsPIP1–1、OsPIP1–2、OsPIP1–3、OsPIP2–1、OsPIP2–4、OsPIP2–5、OsPIP2–6、OsPIP2–7在处理后相对表达量的变化。荧光定量PCR 试剂盒为Thermo Scientific DyNAmo ColorFlash SYBR Green qPCR Kit (Thermo),仪器为Stratagene Mx3005P 荧光定量PCR 仪,反应体系及条件参照试剂盒说明书,以水稻Actin基因作为内参基因,相应水通道蛋白基因定量表达PCR 引物见表1。
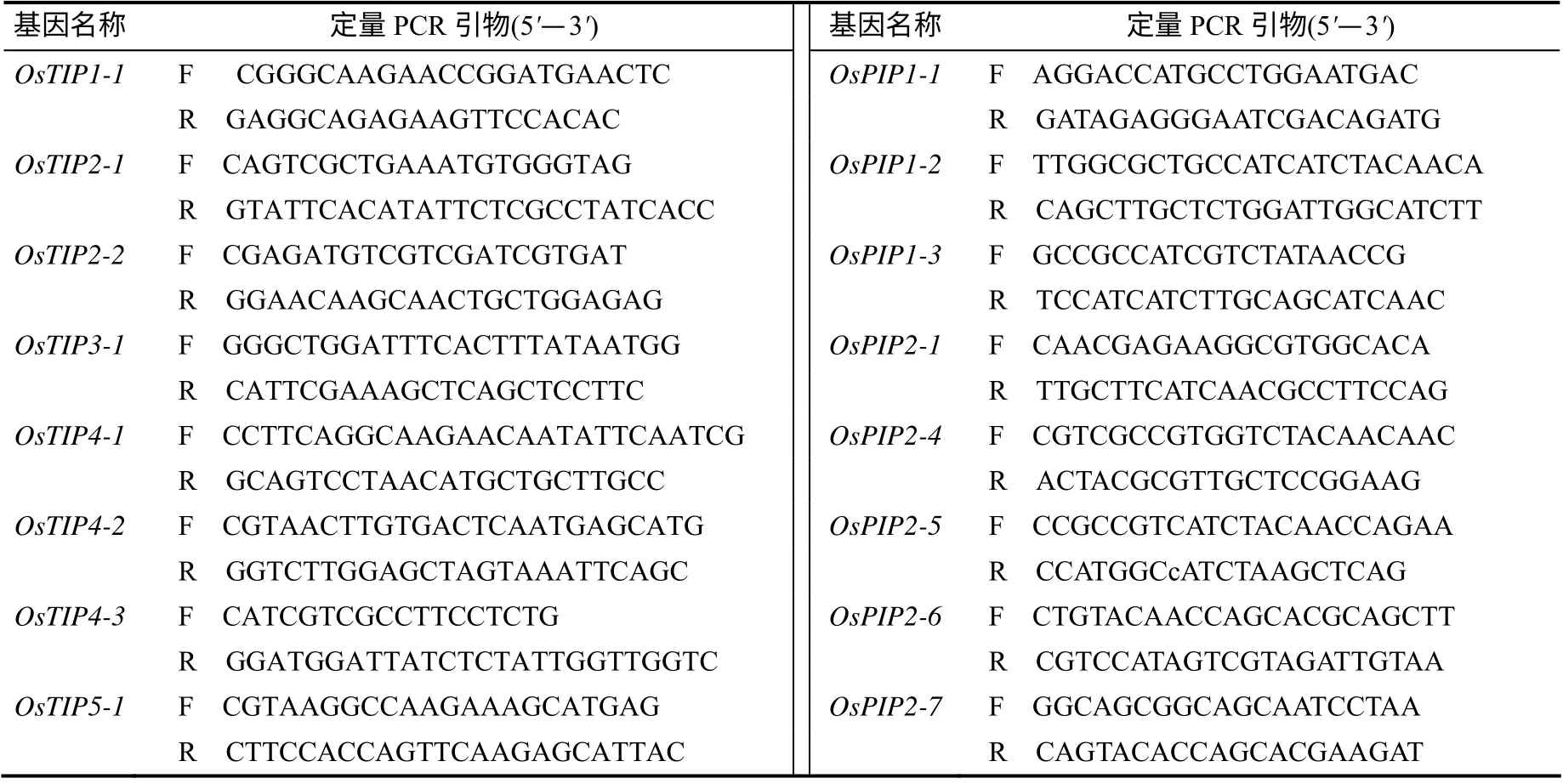
表1 水通道蛋白基因表达定量PCR检测引物序列 Table 1 The primers sequences for real time RT-PCR
1.3 数据分析
采用SPSS 15.0进行单因素方差分析。
2 结果与分析
2.1 高温与HgCl2 处理对稻穗和剑叶相对含水量的影响
从图1-a 可知,花前稻穗相对含水量较高,盛花期稻穗相对含水量较低,TR1 和TR2 处理的相对含水量分别比对照的下降了9.62%和22.25%,差异均达显著水平(P<0.05)。开花当天剑叶相对含水量略有下降,其他时间点内均保持较高的相对含水量,TR1 和TR2 处理的剑叶相对含水量均低于对照的(图1-b)。说明高温胁迫加快了稻穗和剑叶水分的散失;经TR2 处理后,稻穗和剑叶的相对含水量更低,说明高温结合水通道蛋白抑制剂处理能降低稻穗和剑叶的相对含水量。
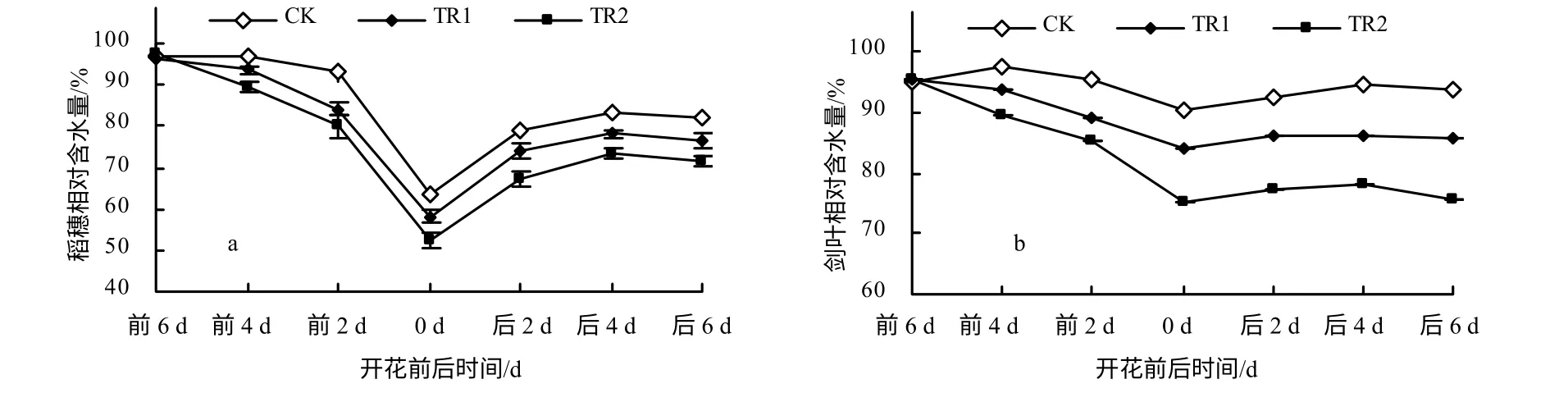
图1 不同处理的稻穗和剑叶相对含水量 Fig.1 The relative water content of different treatments in panicle and flag leaves of rice
2.2 高温与HgCl2 处理对水稻结实率和千粒质量的影响
从表2 可知,TR1 和TR2 的结实率均显著低于CK 的。其中,TR1 的结实率比对照的下降25.48%,TR2 的结实率比对照的下降43.63%。TR1 和TR2的千粒质量也均显著低于CK 的,分别比对照的下降了6.36%和9.33%。说明高温与HgCl2胁迫对结实率和千粒质量均有较大的影响。

表2 不同处理的结实率和千粒质量 Table 2 The seed setting percentage and 1 000 grain weight of rice in different treatments
2.3 高温与HgCl2 处理对柱头和花粉粒线粒体活性的影响
从图2 可知,在适宜温度下,柱头与花粉粒均被詹纳斯绿B 染成深蓝绿色(图2-a、图2-d),有活性的线粒体集中在代谢活跃的花粉管和柱头尖端部分,萌发的花粉管染色远比不萌发的花粉管的染色深。受高温或高温与HgCl2复合处理后,花粉粒与柱头染色明显变浅,整个柱头呈淡紫色(图2-b、图2-c),说明其线粒体的活性明显降低;落在花柱上的花粉粒数量和萌发花粉粒的数量也明显减少(图2-e、图2-f),说明高温或高温与HgCl2复合处理后,线粒体活性降低,导致柱头与花粉粒的活性下降。

图2 不同处理的水稻柱头与花粉粒 Fig.2 The rice pollen and stigma of different treatments
2.4 高温与HgCl2 处理对剑叶液泡膜水通道蛋白基因表达的影响
从图3 可知,花期前后4 d 内,对剑叶OsTIPs家族中的8 个基因表达进行分析,发现适温下OsTIP1–1、OsTIP2–2、OsTIP3–1、OsTIP4–1、OsTIP4–3和OsTIP5–1的表达量均呈先上升后下降的趋势;OsTIP2–1在花前4 d 不表达,在花前2 d 才逐渐表达;OsTIP4–2的表达量则不断下降。说明OsTIPs不同基因间的表达模式不同。受高温胁迫后,除OsTIP4–3和OsTIP5–1外,其他基因的表达量从花前2 d 至花后4 d,均显著低于对照处理的;受高温与HgCl2复合处理后,OsTIPs的各基因表达量下降得更快,说明高温和HgCl2复合处理更能抑制OsTIPs的表达。
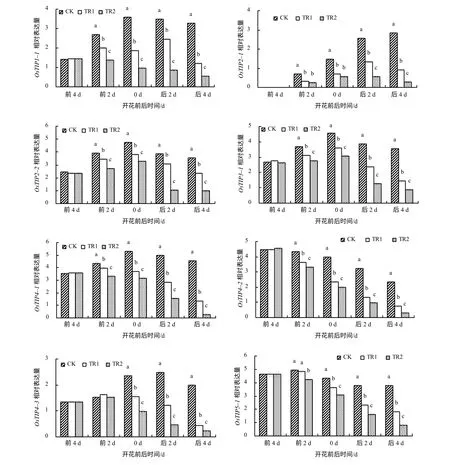
图3 不同处理的剑叶液泡膜水通道蛋白基因的相对表达量 Fig.3 The expression of OsTIPs of rice flag leaves with different treatments
2.5 高温与HgCl2 处理对质膜水通道蛋白基因表达的影响
从图4 可知,适温下,OsPIP1–1、OsPIP1–2、OsPIP1–3、OsPIP2–1、OsPIP2–4和OsPIP2–6的表达量均呈现先上升后下降的趋势,并在开花当天达到最大值。OsPIP2–5在此期间的表达量不断增加,OsPIP2–7在开花前后的表达量较高,开花当天的表达量则较低。经高温处理后,从花前2 d 至花后4 d,各相应基因的表达量均下降;受高温与HgCl2复合处理后,相关基因的表达量下降更为明显。说明剑叶质膜水通道蛋白基因的表达受高温和水通道蛋白抑制剂的影响。
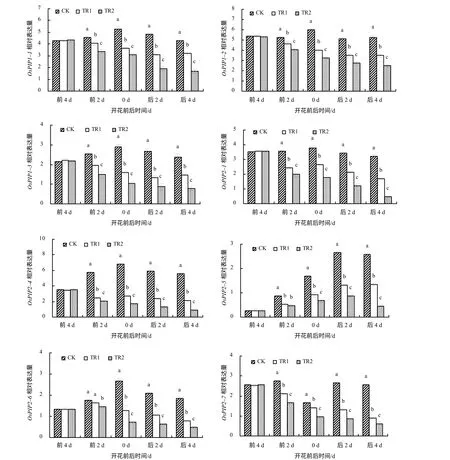
图4 不同处理的剑叶质膜水通道蛋白基因的相对表达量 Fig.4 The expression of OsPIPs of rice flag leaves of different treatments
2.6 高温与HgCl2 处理对稻米淀粉粒结构的影响
从图5 可知,电镜观察发现,适温下,淀粉粒发育良好,各淀粉粒之间结合紧密,胚乳细胞内淀粉粒多边形晶体结构明显(图5–a);受高温胁迫后,淀粉粒间出现明显的空隙(图5–b),说明淀粉粒的发育受到影响;受高温与HgCl2复合处理后,淀粉粒变成圆球形,无法形成规则的晶体结构,各淀粉粒之间不能紧密结合(图5–c),导致充实不良,这可能是导致千粒质量降低的原因。

图5 不同处理的淀粉粒结构 Fig.5 The structure of starch granules of different treatments
3 结论与讨论
本研究发现,开花当天OsTIPs和OsPIPs家族中多个基因的表达量显著高于花前和花后的,表明开花时这2 个基因家族大量表达,这与DING 等[16]的研究结果基本一致。受高温和HgCl2复合处理后,剑叶OsTIPs和OsPIPs家族表达水平均显著低于对照或高温处理的,稻穗和剑叶的相对含水量也降低,这可能与水通道蛋白基因表达及活性降低有关。如:超表达水稻质膜水通道蛋白OsPIP1–1可显著提高水稻根系导水能力[10],超表达TsPIP1–1及TsTIP1–1,可提高转基因植株的相对含水量[17];若敲除AtTIP1–1,转基因植株极易受水分胁迫的伤害[18];可见,OsTIPs和OsPIPs的高表达与高活性的维持对稻穗和剑叶水分供应有着重要作用。本研究发现,高温与HgCl2复合处理,导致柱头上的花粉粒显著减少,这与张桂莲等[15]的研究结果一致。高温胁迫导致花药开裂受阻,散落在柱头上的花粉粒显著减少,而耐热的突变体花粉数量和活性则优于热敏感品种[19]。柱头上花粉粒减少直接影响最终的结实率[20]。
本研究结果表明,高温或高温与HgCl2复合处理后,花粉粒与柱头的线粒体染色较浅或无法染色,说明高温与HgCl2胁迫后,可能使柱头和花粉粒细胞内的线粒体氧化磷酸化过程受到破坏[21],导致柱头和花粉粒活性降低[22]。研究发现,HgCl2结合到水通道蛋白Cys 位点后,通过抑制水通道蛋白活性,降低水分运输速率[23]。散落在柱头上的花粉粒萌发后形成花粉管的过程是快速极性生长过程,需要充足的能量和水分供应[24-25],需要高活性的线粒体通过氧化磷酸化提供ATP。当ATP 供应或水分供应不足时,花粉管生长和受精过程受阻。此外,高温还可能引起光合产物向籽粒运输受阻,从而使结实率降低,淀粉粒充实不良。这与前人[1,3,26]发现高温胁迫导致水稻产量、结实率和千粒质量下降的结果相一致。但高温引起的水分胁迫如何影响柱头和花粉粒活性的生理机制还需作进一步研究。

