脑白质疏松症形成机制探讨及对卒中的影响分析
连勇军 矫娜 付学军 罗晓光 郭毅


摘要:目的 分析腦白质疏松症(LA)的独立危险因素及影像学特点,探讨LA的形成机制及对卒中的发生和预后的影响。方法 回顾性选取某时段行头颅MRI检查的住院患者178例,根据诊断分为非LA 组和LA 组,LA组根据Fazekas分级标准,分LA 轻度、中度、重度3个亚组。将高血压LA患者与可能为脑淀粉样血管病LA患者影像学图像对比分析;LA组与非LA组间危险因素进行多因素logistic回归分析,LA组不同亚组间进行单因素分析;并比较LA组与非LA组间、LA组不同亚组间卒中发生率的差异;采用mRS评分量表比较治疗前、90天后神经功能组间差异。结果 LA组患者102例,占比57.3%,非LA组76例;可能为CAA患者与高血压患者白质高信号范围大致相同;多元回归分析显示性别、年龄、高血压因素组间差异显著(P<0.05);卒中发生率方面LA组84.3%,非LA组51.3%,差异显著(χ2=13.312,P<0.05);不同亚组间,中、高级别LA组卒中发生率为86.1%、84.2%,低级别组为61.7%,差异显著(χ2=7.528,P<0.05);LA组卒中治疗前mRS评分为2.70±0.86,90天后mRS评分1.93±0.94,前后比较差异显著(t=2.11,P=0.038<0.05),非LA组治疗前后mRS分别为2.40±0.62、1.06±0.44,前后比较差异显著(t=7.93,P<0.05)。组间比较非LA组比LA组功能改善更明显(t=5.001,P=0.000<0.05)。结论 性别、年龄、高血压是LA的独立危险因素,我们认为对脑深部末端分支小血管的失调节或失支配是LA形成的启动因子;相比非LA组,LA组更容易出现卒中,LA分级越高,出现卒中的概率越大;LA增加了卒中患者功能恢复的难度。
关键词:脑白质疏松症;脑白质高信号;磁共振成像;脑缺血;危险因素;卒中;
【中图分类号】R651.1 【文献标识码】A 【文章编号】2107-2306(2020)02-123-03
Study on the formation mechanism of leukoaraiosis and its influence on strokeLIAN Yong-jun*, JIAO Na, Fu Xue-jun, LUO Xiao-guang, GUO Yi. *Department of Neurology, Shenzhen Peoples Hospital, shenzhen518100, China
[Abstract] Objective To analyze the independent risk factors and imaging characteristics of leukoaraiosis(LA), explore the formation mechanism of LA and its influence on the occurrence and prognosis of stroke.
Methods 178 patients admitted to our hospital for cranial MRl were divided into non-LA group and LA group.Patients in LA group were further divided into three subgroups according to the Fazekas classification. Comparative analysis of LA images between patients with hypertension and patients who may be cerebral amyloid angiopathy(CAA). Multivariate logistic regression analysis were carried out between LA group and non-LA group, and univariate analysis among different LA subgroups. The incidence of stroke were compared between LA group and non-LA group, and among different LA subgroups. The mRS score scale was used to compare the differences between neurological function groups before and after 90 days of treatment.
Results 102 patients in LA group , accounting for 57.3% , 76 cases of non- LA group. The white matter hyperintensities range of patients who maybe-CAA or with hypertension was approximately the same. Gender, age and hypertension factors between groups showed significantly differences(P<0.05). The stroke incidence rate was 84.3% in the LA group and 51.3% in the non-LA group. The difference was significant (χ2 = 13.312, P <0.05). Among different subgroups, the stroke incidence rates in the middle and high-level LA groups were 86.1%, 84.2%, and The low-level group was 61.7%, the difference was significant (χ2 = 7.528, P <0.05); the mRS score before treatment in the LA stroke group was 2.70 ± 0.86, and the mRS score was 1.93 ± 0.94 after 90 days, and the difference was significant (t = 2.11, P = 0.038 < 0.05). The mRS before and after treatment in the non-LA group were 2.40 ± 0.62 and 1.06 ± 0.44, respectively, and the difference was significant (t = 7.93, P <0.05). Compared with the LA stroke group, the functional improvement was more significant in the non-LA group than b (t = 5.001, P = 0.000 <0.05).
Conclusion Gender, age, and hypertension are independent risk factors for LA. We think that the deregulation or lost control. of small blood vessels in the deep end branches of the brain are the initiating factors for LA formation. Compared with the non-LA group, the LA group is more prone to stroke. The higher LA classification, the greater probability of stroke. LA increases the difficulty of functional recovery in the strokers.
[Key words]:leukoaraiosis;white matter hyperintensities ; magnetic resonance imaging;brain ischemia;risk factors;stroke
脑白质疏松症(1eukoaraiosis, LA)由加拿大神经学家Hachinski等1987年提出,旨在定义影像学上发现的脑室旁或半卵圆中心白质区斑点状及斑片状改变[1] (CT上呈低密度影、MRI-T2WI为高信号)。或称为白质高信号(white matter hyperintensities, WMHs),是一种普遍发生在老年人中的神经影像学现象,归类为脑小血管疾病的其中一种并对其形成机制及对卒中的影响等方面做了广泛研究。LA的形成机制一直存在是由慢性缺血性损害还是血脑屏障破坏所致之争[2]。本研究采用影像学征像对LA形成机制做进一步探讨并回顾性分析LA对卒中的影响。
1 對象和方法
1.1 对象 选择2018年6月~2018年12月时间段在深圳市人民医院神经内科三病区住院行头颅MRI检查的患者178例,主要表现为头痛、头晕、局灶性神经功能障碍、记忆力下降、睡眠障碍、痴呆等常见老年性症状,其中男95例,女83例,平均年龄( 64.6士10.6 )岁,根据诊断分为LA组 102例和非LA 组76例。排除标准:其他特定原因引起的白质病变患者,如:临床诊断或疑似多发性硬化、明显的脑积水、一氧化碳中毒、脑白质营养不良、进行性多灶性白质脑病,头颅手术或严重外伤史,近期曾有全身或颅内感染,颅内肿瘤等。
1.2 方法 回顾性调查178例患者的高血压、糖尿病、高血脂、高尿酸、高同型半胱氨酸、卒中(包括脑出血、脑梗塞,既往有明确卒中病史或目前卒中)等因素,全部以临床诊断及医院目前的正常值为标准,同时登记患者的性别、实足年龄。LA通常分为脑室周围WMH和深层/皮质下WMH。非LA组:侧脑室周围和深部白质无高信号;LA组分级根据目前应用最广的Fazekas量表分为3级[3],1级(轻度)为点灶状、点帽样或铅线样白质高信号;2级(中度)为病灶开始融合和/或形成晕环;3级(重度)为大片融合异常。由经验丰富的1名专科影像医师和1名神内医师完全独立分别评定,评级不一致,经上级医师一起协商后取得统一评级。采用改良的Rankin量表,分别评估卒中发生时和90天时的神经功能。
1.3 统计学方法 采用SPSS 19.0统计软件,计量资料采用X±S表示,以LA有无为因变量,其他因素:性别、年龄、高血压、糖尿病、高血脂、高尿酸、高HCY为自变量进行多因素Logistic分析,其中年龄分级1级≦55岁、2级>55岁且≦65岁、3级>65岁且≦75岁、4级>75岁;以LA分级进行分组,组间单因素比较,计数资料用卡方检验,计量资料使用单因素方差分析及Post Hot多重检验,符合方差齐性,组内两两比较采用LSD方法,非正态分布资料运用轶和检验,治疗前后的组内和组间比较分别采用配对t检验和独立样本t检验, P<0.05为差异有统计学意义。
2 结果
2.1 LA组与非LA组危险因素基线数据比较及多因素Logistic分析 见表1-2;178例患者中LA组102例,占比57.3%,年龄最小者42岁,最大88岁,平均年龄68.2土10.5岁,其中男性62例,组内发现3例符合Boston标准[3]可能为脑淀粉样血管病(CAA)患者,将高血压患者与可能为脑淀粉样血管病(CAA)患者的MRI-SWI及FLAIR序列图像对比,见图1(a为高血压患者,b为CAA患者),发现白质高信号范围基本一致,均在侧脑室周围;非LA组76例,占比42.7%,年龄最小者40岁,最大80岁,平均年龄59.7土8.8岁,其中男33例。Logistic分析显示性别、年龄及高血压3个危险因素LA组与非LA组差异显著,说明男性、有高血压、年龄越大者越易出现LA。
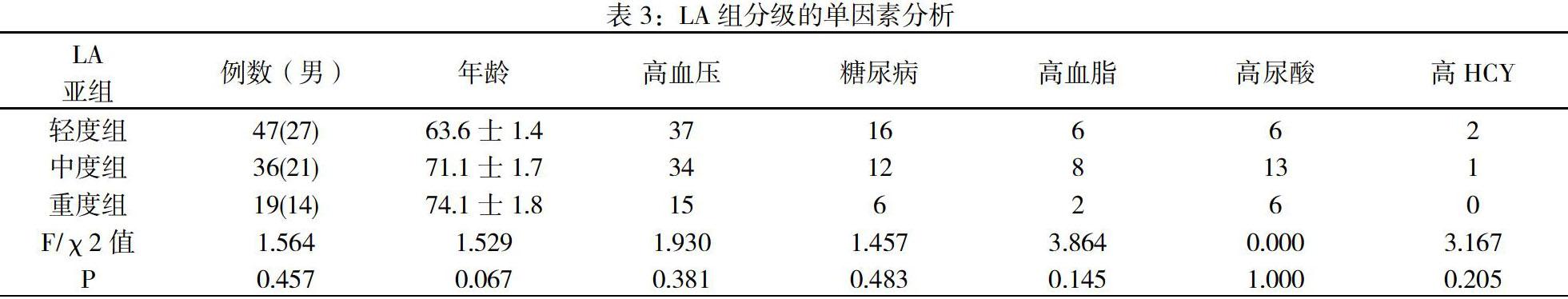
2.2 LA组分级不同亚组间的单因素分析 见表3,其中性别、高血压、糖尿病、高血脂、高尿酸、高HCY因素LA组各级间差异不显著,但是年龄(P=0.067接近0.05)表现出差异倾向,按年龄分级做LA级别分段条图(见图1),可发现年龄越大,LA组高评分例数(中、重度组相对轻度组)所占比例越大,说明脑白质疏松随年龄进展,年龄越大、脑白质疏松越严重。
2.3 LA对卒中发生率及预后的影响
非LA组76例中出现过卒中的39例,卒中发生率51.3%,LA组102例中出现过卒中的86例,卒中发生率84.3%,组间差异显著(P<0.05),说明LA组相比非LA组容易出现卒中;LA组不同亚组间,高级别组(中、重度)与低级别(轻度)组间卒中发生率差异显著(86.1%、84.2% VS 61.7%, P<0.05),高级别组出现卒中的概率越大,见表4。
改良Rankin量表评估卒中入院时的神经功能,标准内科药物治疗90天后采用电话回访或门诊方式再次进行mRS评分。非LA组卒中患者入院时mRS评分2.40±0.62,90天后mRS评分1.06±0.44,前后比较差异显著(t=7.93,P<0.05);LA组卒中患者入院时mRS评分2.70±0.86,90天后mRS评分1.93±0.94,前后比较差异显著(t=2.11,P=0.038<0.05)。虽然2组治疗后都有显著神经功能改善,但组间比较非LA组比LA组功能改善更明显(t=5.001,P=0.000<0.05)。见图2。
3 讨论
脑白质疏松症(LA)是影像学上的纯描述性词汇,对白质高信号区域的病理结果显示髓鞘苍白、髓鞘和相关轴突的损失致组织稀薄、轻度胶质增生[5]。LA的形成机制一直存在是由慢性缺血性损害所致还是血脑屏障破坏所致的争论。目前主流观点认为,小血管内皮受损出现透明样变和纤维化,导致管壁增厚、血流量减少、供血组织出现慢性缺血;慢性缺血引起组织损伤是发展成脑白质病变的致病机制[6]。而有的研究认为是血管内皮损伤后出现血脑屏障破坏,血液成分渗入脑组织间隙成潜在有毒物质,形成慢性损伤,是脑白质疏松的病理机制[7]。我们基于影像学发现,脑淀粉样血管病患者同高血压或其它危险因素一样,白质疏松都是发生在侧脑室周围和深部白质区域相对固定区域,见图1,微出血区域并没有出现因血管屏障破坏继发的高信号;同时我们发现,交界相邻大血管供血区的分水岭区域应该更容易因慢性缺血而继发高信号,但是分水岭区域并不是LA高发区,尽管有部分区域重叠;同时WMHs的年龄跨度非常大,多数研究认为至少50至65岁以后才会预期出现一些白质病变[8],而本研究发现WMHs最小患者年龄42岁,尽管这些WMHs存在异质性,但我们也并不认为在40多岁的年龄阶段就会有慢性脑缺血的发生。而有些研究提出了新的观点,认为是末支血管动脉僵硬、内皮功能障碍才是启动机制[9]。
对LA的危险因素分析,见表2-3,并对比前人研究结果,我们发现年龄和高血压是LA最重要的危险因素[10-11],而性別[12-13]、糖尿病[13-14]、高血脂[15]等因素,目前多有争议。综合WMHs的常见区域、危险因素等,我们认为侧脑室周围和深部白质区域处于分支血管供血区末端,出现了内分泌-神经失支配或失调节,继发了缺血和过度灌注的交替性损害才是WMHs的启动因素。随年龄增长、器官衰老、内分泌-神经支配能力下降以及高血压对末端小血管的直接压力性损害,或者其它多种因素的损害,造成这些解剖上相对固定区域的末端小血管的失调节、失支配能力,继发了这些固定解构部位的高信号出现。慢性缺血、血管屏障破坏以及末支动脉僵硬或都是在此基础上的继发。
为深入研究与年龄有关的脑白质变化对健康的影响,2001年欧洲工作组启动了LADIS 研究(The Leukoaraiosis And DISability study),历时10年,发现重度与轻度LA进行比较,残疾或死亡的风险要高出2倍以上,同时LA的严重程度是认知能力下降的最强预测因子之一[16]。在一项针对22项纵向研究的荟萃分析中,WMHs严重者痴呆风险增加2倍、中风风险增加3倍[17]。本研究回顾性分析LA对卒中的影响,发现LA越严重(分级越高),卒中发生率越高(见表4),同时LA患者相比非LA患者卒中后功能恢复更差(见图3),与前人研究结果基本一致[18-19]。我们可以认为,正是对脑深部末端小血管的失调节或失支配,促成了后继血管病变和脑组织缺血,引起卒中发生率增高以及阻碍了卒中后的功能修复。同时本研究结果表明年龄、性别、高血压与LA明显关联,是其独立危险因素,提示我们高血压患者应积极降压治疗阻止发展为LA,特别是老年男性;同时,已经出现白质病变的患者更应积极管控血压阻止LA进展、预防卒中。降压治疗既能阻止发展为脑白质病并延缓已经出现白质病变的继续进展[20]。
本研究纳入病例为一个时间阶段的住院患者,有选择偏倚可能;同时在住院患者中选择无LA的例数较少,存在选择限制;同时选用LA分级也可能受主观因素干扰,这些都可能造成分析结果的偏倚。扩大样本来源及样本量、更科学的LA分级评定或定量评估、进一步分析这种失调节或失支配的分子机制等是进一步研究分析LA的原因和对卒中影响的研究方向。
参考文献
[1] Hachinski VC,Potter P,Merskey H.Leukoaraiosis[J].Arch Neurol, 1987, 44(1):21-23.
[2] Eric E. Smith. Leukoaraiosis and Stroke[J]. Stroke, 2010, 41:S139-S143.
[3] Kim KW, MacFall JR, Payne ME. Classification of white matter lesions on magnetic resonance imaging in elderly persons[J]. Biol Psychiatry, 2008, 64:273-80.
[4] Knudsen KA, Rosand J, Karluk D, et al. Clinical diagnosis of cerebral amyloid angiopathy: validation of the Boston criteria[J]. Neurology, 2001, 56:537-539.
[5] Pantoni L, Garcia JH. Pathogenesis of leukoaraiosis: a review[J]. Stroke, 1997, 28: 652-659.
[6] Fernando MS, Simpson JE, Matthews F, et al. White matter lesions in an unselected cohort of the elderly: molecular pathology suggests origin from chronic hypoperfusion injury[J]. Stroke, 2006, 37:1391-1398.
[7] Bailey EL, Smith C, Sudlow CLM, et al. Pathology of lacunar ischaemic stroke in humans-a systematic review[J]. Brain Pathol, 2012, 22:583-591.
[8] Hopkins RO, Beck CJ, Burnett DL, et al. Prevalence of white matter hyper intensities in a young healthy population[J]. J Neuroimaging, 2006, 16: 243-251.
[9] Naoki Saji, Noriko Ogama, Kenji Toba, et al. White matter hyperintensities and geriatric syndrome: An important role of arterial stiffness. Geriatr Gerontol Int, 2015, 15 (Suppl.1): 17-25.
[10] Pantoni L, Garcia JH. The significance of cerebral white matter abnormalities 100 years after Binswangers report. A review[J]. Stroke, 1995, 26:1293-1301.
[11] Pantoni L, Garcia JH. Pathogenesis of leukoaraiosis: a review[J]. Stroke,1997, 28:652-659.
[12] van Dijk EJ, Prins ND, Vrooman HA, et al. Progression of cerebral small vessel disease in relation to risk factors and cognitive consequences: Rotterdam Scan study[J]. Stroke, 2008, 39: 2712-2719.
[13] Simoni M, Mehta Z, Rothwell PM. Validity of CT versus MR brain imaging in studies of risk factors for Leukoaraiosis: a systematic review[J]. Cerebrovasc Dis, 2010, 29(Suppl2):300.
[14] Bokura H, Yamaguchi S, Iijima K, et al. Metabolic syndrome is associated with silent ischemic brain lesions[J]. Stroke, 2008, 39:1607-1609.
[15] Park K, Yasuda N, Toyonaga S, et al. Significant association between leukoaraiosis and metabolic syndrome in healthy subjects[J]. Neurology, 2007, 69:974-978.
[16]The LADIS Study Group. 2001–2011: A Decade of the LADIS (Leukoaraiosis And DISability) Study: What Have We Learned about White Matter Changes and Small-Vessel Disease?[J]. Cerebrovasc Dis, 2011,32:577-588.
[17] Debette S, Markus HS. The clinical importance of white matter hyperintensities on brain magnetic resonance imaging: systematic review and metaanalysis[J]. BMJ, 2010, 341:c3666.
[18] Padovani A, Di Piero V, Bragoni M, et al. Correlates of leukoaraiosis and ventricular enlargement on magnetic resonance imaging: a study in normal elderly and cerebrovascular patients[J]. Eur J Neurol, 1997, 4:15-23.
[19] Enzinger C, Fazekas F, Ropele S, et al. Progression of cerebral white matter lesionsdclinical and radiological considerations[J]. J Neurol Sci, 2007, 257:5-10.
[20] Dufouil C, de Kersaint-Gilly A, Besancon V, et al. Longitudinal study of blood pressure and white matter hyperintensities: the EVA MRI Cohort[J]. Neurology, 2001, 56:921-926.

