一株反硝化聚磷菌的筛选与特性研究*
李 澳,胡 月,孙 玲,孟 娜,于楠楠
(徐州工程学院,江苏 徐州 221008)
氮、磷污染物是导致众多内陆湖泊、水库甚至河流水体富营养化的主要因素,它们的协同去除是污水生物处理的主要目标。常规的生化处理工艺可以有效地降低污水的BOD5和SS,但对污水中同时存在的N、P等营养物只能去除10%~20%,大量含磷污水直接排入水体。在近30多年里,许多污水厂在设计上都考虑到了利用微生物对N、P的同步去除。然而,由于硝化菌与传统聚磷菌(PAOs)的菌龄不同及反硝化菌与PAOs在碳源需求上的竞争,使得它们在脱氮除磷过程中存在着较大矛盾,系统难以达到最优运行条件。20世纪末,人们发现在厌氧/缺氧交替运行的环境中能够富集到一类兼有脱氮和除磷特性的PAOs,并把它们单独列出,称为反硝化聚磷菌(Denitrifying phosphorus accumulating organisms,DNPAOs),它们的发现为解决碳源利用和泥龄差异的矛盾提供了可能,使得脱氮除磷得以同步进行。目前,国内外在反硝化聚磷菌的分离筛选方面的研究已有一定的进展:2003年Wauters G等[1]分离到1株丛毛单胞菌属的DNPAOs;2004年Suguru O等[2]分离到1株红环菌属的DNPAOs;2008年许彦娟[3]分离到1株微小杆菌属和3株芽孢杆菌属的DNPAOs;2009年Cao Ngoc Diep等[4]分离到1株假单胞菌属的DNPAOs;2011年Hui LIU等[5]分离到1株副球菌属的DNPAOs;2018年谢蔚鹏等[6]分离到24株反硝化聚磷菌,可归于5个不同的属,分别是芽孢杆菌属、丛毛单胞菌属、普罗维登斯菌属、假单胞菌属和假苍白杆菌属。本研究依据除磷能力、硝酸盐还原产气及异染颗粒染色等实验,对DNPAOs进行分离筛选,得到1株高效同步脱氮除磷的DNPAOs,丰富和补充了生物反硝化除磷理论。
1 实 验
1.1 仪器与试剂
723C可见分光光度计;SW-CJ-1F洁净工作台;HZ150L恒温培养摇床;IXQ-SG46-280A手提式压力蒸汽灭菌锅;BCD-212KA海尔冰箱;HH.B11.600-S-II电热恒温培养箱;XMTD-204数显恒温水浴锅;150B生化培养箱等。
试剂除LB为生化试剂外,其余均为分析纯,pH的调节采用0.1 mol/L HCl和0.1 mol/L NaOH。
1.2 培养基
(1)LB培养基:酵母浸膏5 g,蛋白胨10 g,NaCl 5 g,双蒸水1000 mL,pH 7.0~7.2(若为固体则加入琼脂25 g)。
(2)LB-P培养基:LB培养基添加2.5 g K2HPO4和0.25 g KH2PO4,pH 7.0~7.2。
(3)富集培养基:CH3COONa·3H2O 5 g、丙酸5 mL、KNO32.0 g、MgSO4·7 H2O 0.2 g、K2HPO42.0 g、微量元素2 mL、双蒸水1000 mL;pH 7.2。
(4)1% BTB-反硝化培养基:CH3COONa·3H2O 5.0 g、KNO32.0 g、MgSO4·7 H2O 0.2 g、琼脂20 g、1%-BTB 4 mL、H2O 1000 mL;pH 7.6。
(5)反硝化缺磷培养基:KNO32 g/L、CH3COONa·3H2O 5 g/L、K2HPO40.05 g/L、MgSO4·7H2O 0.2 g/L、CaCl20.5 g/L、微量元素2 mL/L。
(6)反硝化富磷培养基:KNO32 g/L、CH3COONa·3H2O 5 g/L、K2HPO40.05 g/L、KH2PO40.2 g/L、MgSO4·7H2O 0.2 g/L、CaCl20.5 g/L、微量元素2 mL/L。
(7)微量元素溶液:FeCl3·6H2O 1.5 g/L、H3BO30.15 g/L、CuSO4·5H2O 0.03 g/L、KI 0.03 g/L、Na2MoO4·2H2O 0.06 g/L、MnCl2·4H2O 0.12 g/L、ZnSO4·7H2O 0.12 g/L、CoCl2·2H2O 0.12 g/L。
1.3 反硝化聚磷菌的富集培养与筛选
1.3.1 菌株富集培养
从徐州市的几个污水处理厂采集活性污泥,混合后称取10 g,加入200 mL富集培养基中,26 ℃、140 r/min摇床厌氧/缺氧间歇培养,每4 d为一周期(每一周期前2 d以乙酸钠提供碳源,后2 d以丙酸提供碳源,每次置换培养液的50%),共培养10个周期。培养结束后吸取0.5 mL富集液,进行10-1~10-9浓度梯度稀释,从各梯度的稀释液取0.1 mL分别涂布LB固体培养基,每个稀释度2个重复,于生化培养箱26 ℃下培养2~3 d。选取形态清晰的单菌落划线分离培养,长成的单菌落再转接,重复划线培养6次,即得纯菌落。
1.3.2 菌株筛选
①蓝白斑初筛:对已分离纯化的菌株取单菌落,分别点接于1% BTB-反硝化培养基上,于26 ℃培养2 d,选择显蓝色的菌株作为初筛菌株。
②Albert颗粒染色复筛:将上述筛选出的菌株缺氧培养12 h后,进行Albert异染颗粒染色,选择具有异染粒染色的菌株为反硝化聚磷菌。LB培养基斜面接种,4 ℃保存备用。
③将上述筛选出的反硝化聚磷菌分别接入100 mL LB液体培养基中,26 ℃,140 r/min摇床培养24 h,4000 r/min离心20 min收集菌体,调整OD600=1.0,无菌生理盐水保存,即为种子液。
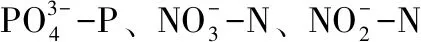
除磷率:η1=(C-Ct)/C×100%
(1)
反硝化率:η2=(A-At-Bt)/A×100%
(2)
式中:η1——除磷率,%
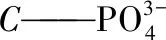

η2——反消化率,%
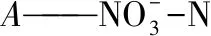
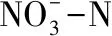

选取1株反硝化率和除磷率分别大于70%和50%的菌株为实验菌株。
1.4 分析方法
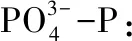
1.5 菌株特征及生理生化鉴定
参照文献[7-8]方法进行。
1.6 菌株16SrDNA基因片段PCR扩增
以细菌基因组DNA为模板扩增16SrDNA,采用一对通用引物,上游引物(7F):5-CAGAGTTTGATCCTGGCT-3’;下游引物(1540R):5’-AGGAGGTGATCCAGCCGCA-3’;PCR反应体系:Template 0.5 μL,5×Buffer(with Mg2+)2.5 μL,dNTPs 1 μL,上游和下游引物各0.5 μL,加双蒸H2O2至25 μL。PCR程序如下:① 98 ℃,预变性,3 min;② 98 ℃变性25 s;③ 55 ℃复性25 s;④ 72 ℃延伸1 min;⑤ 72 ℃延伸10 min;⑥ 4 ℃终止反应,其中步骤②至④循环30次。琼脂糖凝胶电泳分析PCR产物,并送中国上海生工生物技术有限公司测序。
1.7 菌株生长影响因素(不同因素对菌株生长及反硝化除磷性能的影响)
1.7.1 不同 pH 值
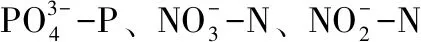
1.7.2 不同温度
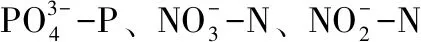
1.7.3 不同碳源
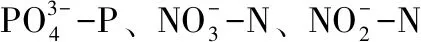
1.8 菌株脱氮除磷性能
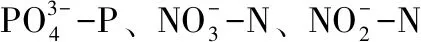
2 结果与讨论
2.1 菌株的富集与筛选
取混合物样品10 g置于200 mL乙酸钠/丙酸为交替碳源的富集培养基中,26 ℃下,140 r/min摇床培养40 d后,涂布LB固体培养基,共挑出形态、大小、颜色不同的菌落48株。分别挑单菌落接种于1%BTB-反硝化培养基进行蓝白斑筛选,显蓝斑的共有23个菌落,为反硝化菌,命名为N1-N23。对N1-N23厌氧吸磷培养后进行Albert异染粒染色,染色结果表明有8株菌体(N2、N3、N6、N9、N11、N13、N14、N23)含有poly-P颗粒,结合蓝白斑筛选与异染粒染色结果确定这8株菌为反硝化聚磷菌。
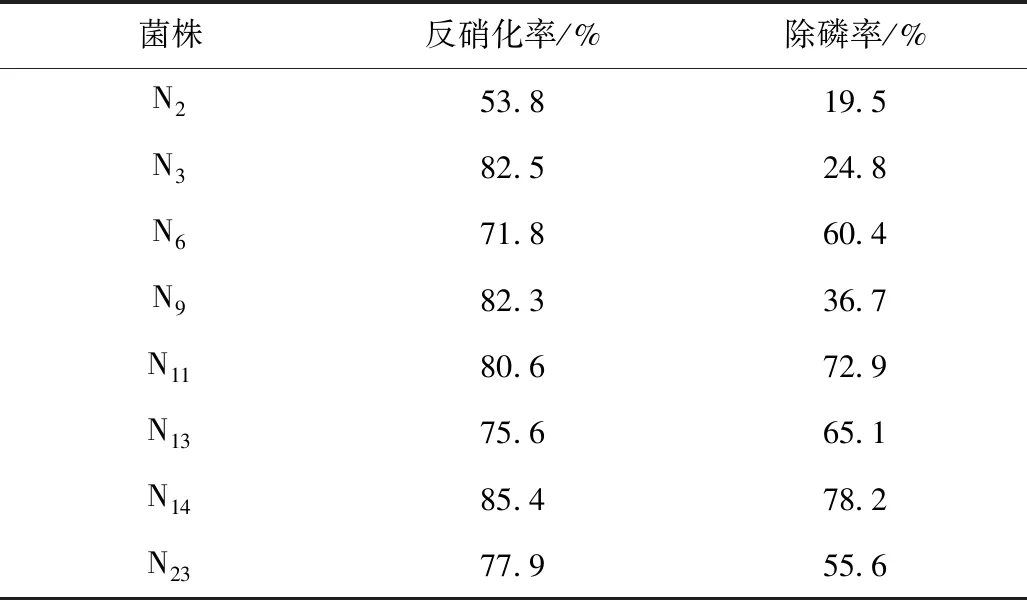
表1 好氧培养24 h菌株反硝化除磷结果
由表1可知,菌株N6、N11、N13、N14、N23的反硝化率均大于70%,除磷率均大于50%,对这5株菌株进行硝酸盐还原产气实验,结果N6、N13为阴性,N11、N14、N23为阳性,选取反硝化率和除磷率均较高的N14为进一步研究的高效反硝化聚磷菌。
2.2 N14特征
N14菌落奶白色,大小为0.5 μm×1.0 μm,边缘整齐、光滑,表面湿润,中间凸起,半透明,易挑起。显微镜下可见菌株粗短杆状,多数单个,极少数呈短链状。菌体Albert 异染粒染色结果见图1,从图1可知,菌体内含有poly-P颗粒。
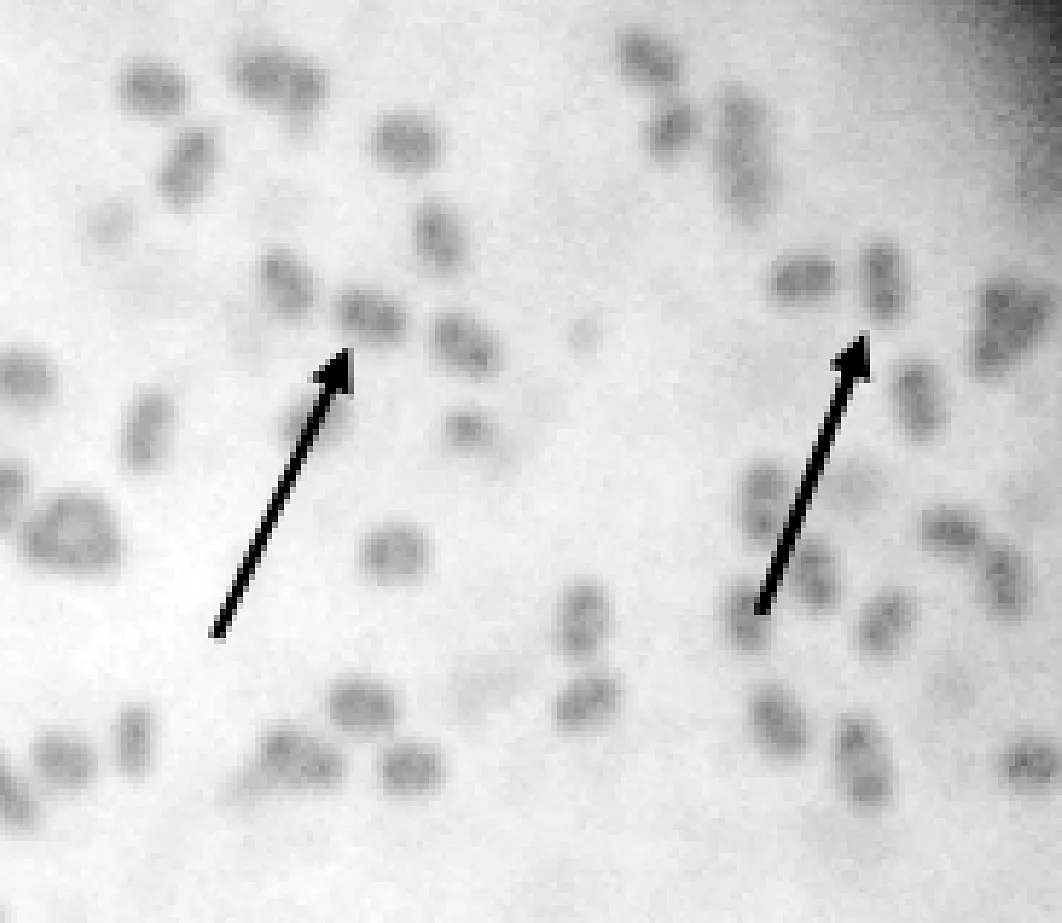
图1 菌株N14的poly-P染色
2.3 N14鉴定
N14为革兰氏阴性菌,无芽孢,有厚荚膜,有运动性;硝酸盐还原、硝酸盐还原产气、淀粉水解、柠檬酸盐利用、过氧化氢酶实验阳性;产氨、产H2S、V-P、甲基红、产吲哚阴性,初步鉴定菌株为克雷伯氏菌。以菌株总DNA为模版,经PCR扩增及16SrDNA测序,结果发现其于已知的克雷伯氏属Klebsiellasp. DAP24(登录号:EU302849)的相似性达98%。因此经鉴定菌株N14为克雷伯氏菌Klebsiellasp.,命名为Klebsiellasp. N14。
2.4 不同因素对N14脱氮除磷性能的影响
2.4.1 pH值
pH值影响细胞在培养基中的带电状态和氧化还原电位,从而影响微生物对营养物质的吸收和酶促反应的进行,因此pH变化对菌株脱氮除磷产生较大影响。由图2可知,菌株在pH为5~8范围内OD600、脱氮率、除磷率逐步上升,在pH为8时生长最好,此时OD600为1.26,脱氮除磷效能最佳,除磷率为81.6%,脱氮率为87.9%;但pH为5时OD600仅为0.28,脱氮除磷率最低,脱氮率为20.5%,除磷率为32.8%,显示此条件下菌株生长缓慢,脱氮除磷效果不理想;菌株在pH为9的条件下也能较好的生长,此时OD600为0.95,脱氮率除磷率依然保持在71%、65%左右。可见反硝化聚磷菌N14脱氮除磷最适宜的pH为中性及弱碱性,这与胡筱敏等[9]研究结果相一致。菌株在pH为5~9范围内生长吸光度与脱氮除磷率呈简单的正态分布,表明菌株脱氮除磷效能与生长代谢呈正相关。全程没有检测到氨氮浓度,这与生理生化鉴定时产氨反应阴性相一致,也进一步验证了硝酸盐还原产气生成的气体为N2。
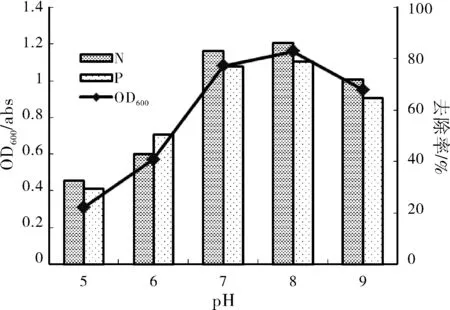
图2 pH对菌株N14生长及脱氮除磷性能的影响
2.4.2 温 度
通常情况下,温度对细菌生长和代谢有如下影响:在温度低至一定值时,细菌细胞膜呈凝胶状,营养物质的跨膜运输受阻,细胞停止生长;随着温度的升高,细菌细胞内的生化反应加快,生长加速;当温度升高超过上限温度后,对温度敏感的蛋白质和核酸变性加剧,细菌生长停止,甚至死亡。因此,在其它条件不变情况下,细菌生长有最适生长温度区间。由图3可知,菌株在好氧培养24 h后,在20~30 ℃范围内OD600、脱氮率、除磷率逐步上升,20 ℃时OD600为0.89,脱氮率、除磷率分别为70.5%、50.2%,可见此温度下菌株能较好的生长,且维持较高的脱氮除磷率,暗示N14可能耐受低温生长,可作为耐冷反硝化聚磷菌备选菌种;25 ℃时除磷率最高,为86.2%;30 ℃时OD600、脱氮率达最高值,OD600为1.28,脱氮率为88.2%,除磷率为82.7%;35 ℃时OD600、脱氮除磷率略有下降,40℃时明显降低,OD600为0.47,脱氮除磷率分别为40.8%、37.6%。菌株适宜生长的温度范围是20~30 ℃。
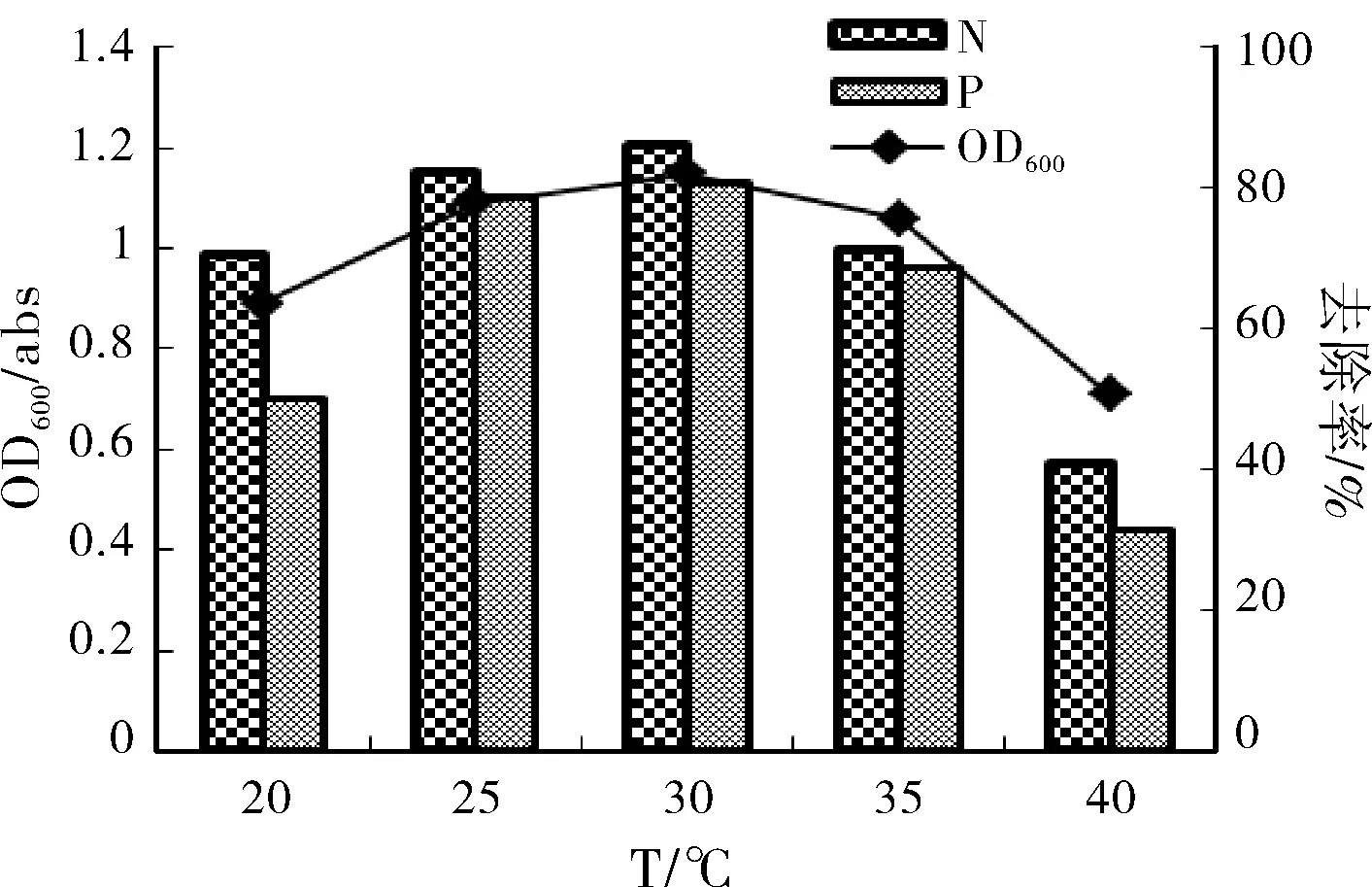
图3 温度对菌株N14生长及脱氮除磷性能的影响
2.4.3 碳 源
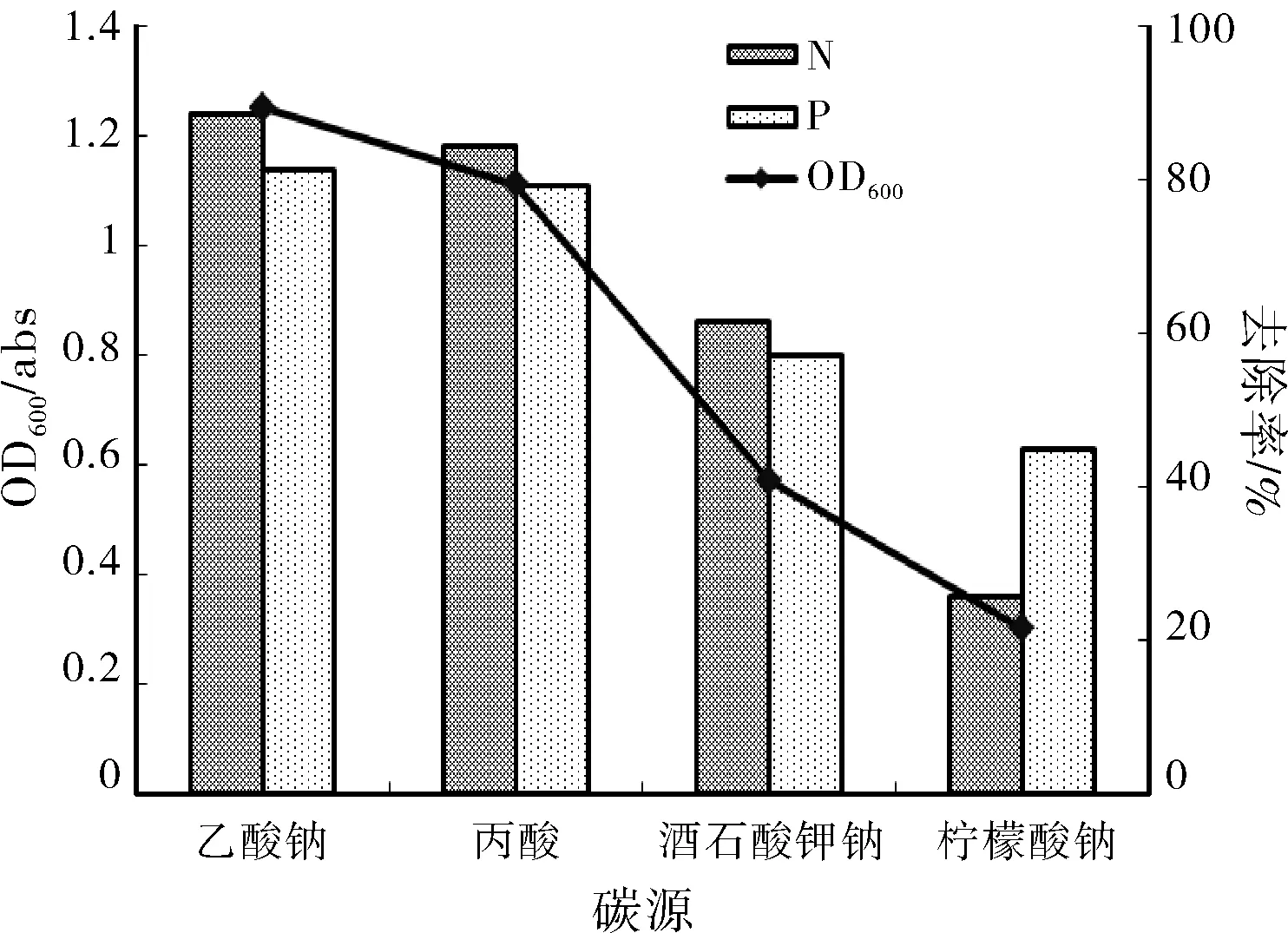
图4 碳源对菌株N14生长及脱氮除磷性能的影响
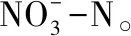
2.5 N14脱氮除磷效果
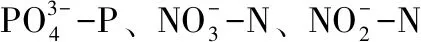
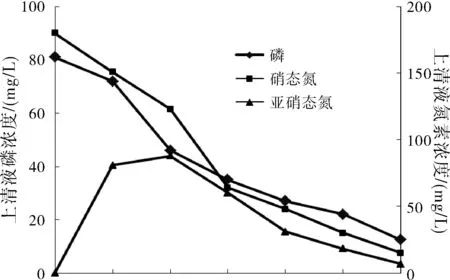
图5 N14脱氮除磷性能
3 结 论
(1)以乙酸钠/丙酸为交替碳源,对活性污泥进行为期40 d厌氧/缺氧培养,通过蓝白斑筛选、poly-P染色、硝酸盐还原产气及脱氮吸磷效能实验相结合的方法,筛选到1株高效反硝化聚磷菌N14,经16SrDNA基因序列分析及生理生化实验,初步鉴定菌株N14为Klebsiellasp.,命名为Klebsiellasp.N14。
(2)菌株N14对pH的耐受范围较广,其脱氮除磷的适宜pH是中性偏碱,最适pH是8;适宜生长的温度范围在20~35 ℃之间,脱氮除磷的最适温度是30 ℃;当碳源为乙酸钠时,菌株生长及脱氮除磷效能最佳,碳源为柠檬酸钠时,菌株脱氮除磷效果最差。
(3)菌株在pH为8,温度为30 ℃条件下好氧培养24 h后,培养液上清液中磷浓度从81 mg/L降到12.4 mg/L,除磷率为88.5%,硝酸盐氮浓度从180 mg/L降到15 mg/L,亚硝酸盐氮浓度从94 mg/L降到6.7 mg/L,脱氮率为84.7%。

