浙江沿海贝类体内有机锡化合物分布特征与风险评价
方 杰,母清林,张庆红,王晓华
(浙江省海洋生态环境监测中心,浙江 舟山 316021)
0 引言
在海洋航运及海上作业中常使用含有三丁基锡(TBT)和三苯基锡(TPT)等有机锡化合物(OTs)的涂料以防止海洋附着生物的污损[1]。研究表明,在水和沉积物中低浓度的三丁基锡和三苯基锡就可以对水生生物产生高毒性,导致海洋腹足类生物的性畸变[2-3],被认为是迄今为止由人为因素大量进入海洋环境的最毒物质之一[4]。许多国家已将TBT和TPT及其降解产物列入了优先污染控制的黑名单中[5-6]。
目前,国内对近岸海域有机锡污染的相关研究有很多,关注生物体中有机锡污染状况的相关报道主要集中在渤海湾[7]、厦门海域[8-9]、深圳湾[10]、珠江三角洲[11]和香港[12-13]等区域。上述研究表明,我国部分近岸海域的贝类和腹足类生物均不同程度受到了有机锡的污染,而在船舶活动频繁的港口码头和养殖区附近水域有机锡污染程度相对较高。
浙江省是我国重要的海洋渔业生产基地,沿海的船舶修造、航运业也十分发达。由于沿海养殖和船舶修造业涉及使用含有机锡的防污涂料,因此不可避免地会对海洋生物造成污染风险,但至今鲜有浙江沿海贝类生物有机锡污染的调查报道。本研究采用戊基化格氏衍生GC-FPD方法对浙江沿海双壳贝类体内的TBT和TPT,以及代谢产物一丁基锡(MBT)、二丁基锡(DBT)、一苯基锡(MPT)、二苯基锡(DPT)共6种OTs进行检测分析,探讨浙江沿海生物体有机锡的分布特征和健康风险状况,以期为有机锡的污染控制提供基础数据,为海洋生态环境保护提供技术支持。
1 材料和方法
1.1 研究区域和海洋生物种类
2019年9月以定点方式从定海、普陀、象山、三门、瑞安和乐清等6个县(市)7个采样点(采样站位见图1,其中定海两个采样点编号分别为定海1和定海2)采集了6种21份双壳贝类生物样品,所选择的双壳贝类种类是浙江沿海具有种群代表性的生物种类(表1)。研究区覆盖了浙江沿海的主要区域。采集的双壳贝类样品经现场冷冻(-18 ℃)后带回实验室。
图1 浙江沿海7个生物采样站位分布Fig.1 Locations of the seven sampling sites along Zhejiang coastal area

表1 采集的双壳贝类生物种类名称及体长信息Tab.1 Information of identities and body lengths of collected bivalve mollusks
1.2 样品预处理
样品制备方法按海洋监测规范(GB17378.6—2007)[14]进行。样品解冻后,在取出生物组织前分别测量个体长度,取个体大小相近的20~30只贝类用塑料刀和镊子取出其软体组织并归在一起放入匀浆机中匀化样品。取匀化样品作冷冻干燥处理(-40 ℃,0.12 mbar)数天。样品冷冻干燥完全后在玛瑙研钵中研磨成粉,最后将均质化的样品放入已净化的玻璃瓶内于-20 ℃的冰箱内避光保存。
1.3 样品分析和色谱条件
样品前处理方法参照海洋监测技术规程(HY/T147.3—2013)[15],称取3.000~5.000克冻干样品经盐酸/甲醇二次提取后,正戊基溴化镁衍生化,弗罗里硅土净化,浓缩定容至0.5 mL后待测。
色谱分析仪器采用日本岛津GC2030气相色谱仪(配FPD检测器和610 nm锡滤光片)。HP-5 m色谱柱(30 m×0.25 mm×0.25 μm);进样口温度:280 ℃;柱温:40 ℃保持3 min,然后以10 ℃/min升至220 ℃,再以20 ℃/min升至260 ℃,最后以3 ℃/min升至290 ℃。检测器温度:300 ℃;氢气流量:40 mL/min;空气流量:60 mL/min;尾吹气流量:50 mL/min。载气:高纯氮气,流速为1.0 mL/min。进样量:1.0 μL(不分流进样)。
1.4 标准物质
6种有机锡氯化物标准品一丁基锡(MBT)、二丁基锡(DBT)、三丁基锡(TBT)、一苯基锡(MPT)、二苯基锡(DPT)、三苯基锡(TPT)和内标化合物三戊基锡均购自美国AccuStandard Inc.,质量浓度均为1 000 μg/mL。衍生化试剂正戊基溴化镁购自北京百灵威科技有限公司,浓度为1.0 mol/L。
1.5 分析质量保证
在生物样品提取前,样品中加入内标化合物。每批样品均带有空白样、平行样和基体加标样来进行分析的质量控制。有机锡化合物均以回收内标作回收校正计算。
校正曲线均采用五点浓度计算,各目标化合物的线性曲线相关系数(r2)在0.993~0.999之间。同时在样品分析过程中,随机插入校正曲线的中间浓度点以评价仪器的稳定性(RPD < 20%),丁基锡和苯基锡的检出限范围为(0.29~0.42) ng·g-1(以Sn计,干重)。
实际样品的加标回收率:有机锡各组份的回收率为75%~108%,平均回收率为85.4%;平行样的相对偏差均小于10.2%。
以下内容除特别注明外,生物体中有机锡的含量单位均为ng·g-1(以Sn计,干重)。
2 结果与讨论
2.1 浙江沿海贝类生物体内有机锡的含量
浙江沿海贝类体内有机锡含量、贝类体内丁基锡和苯基锡含量范围及检出率见表2和表3。
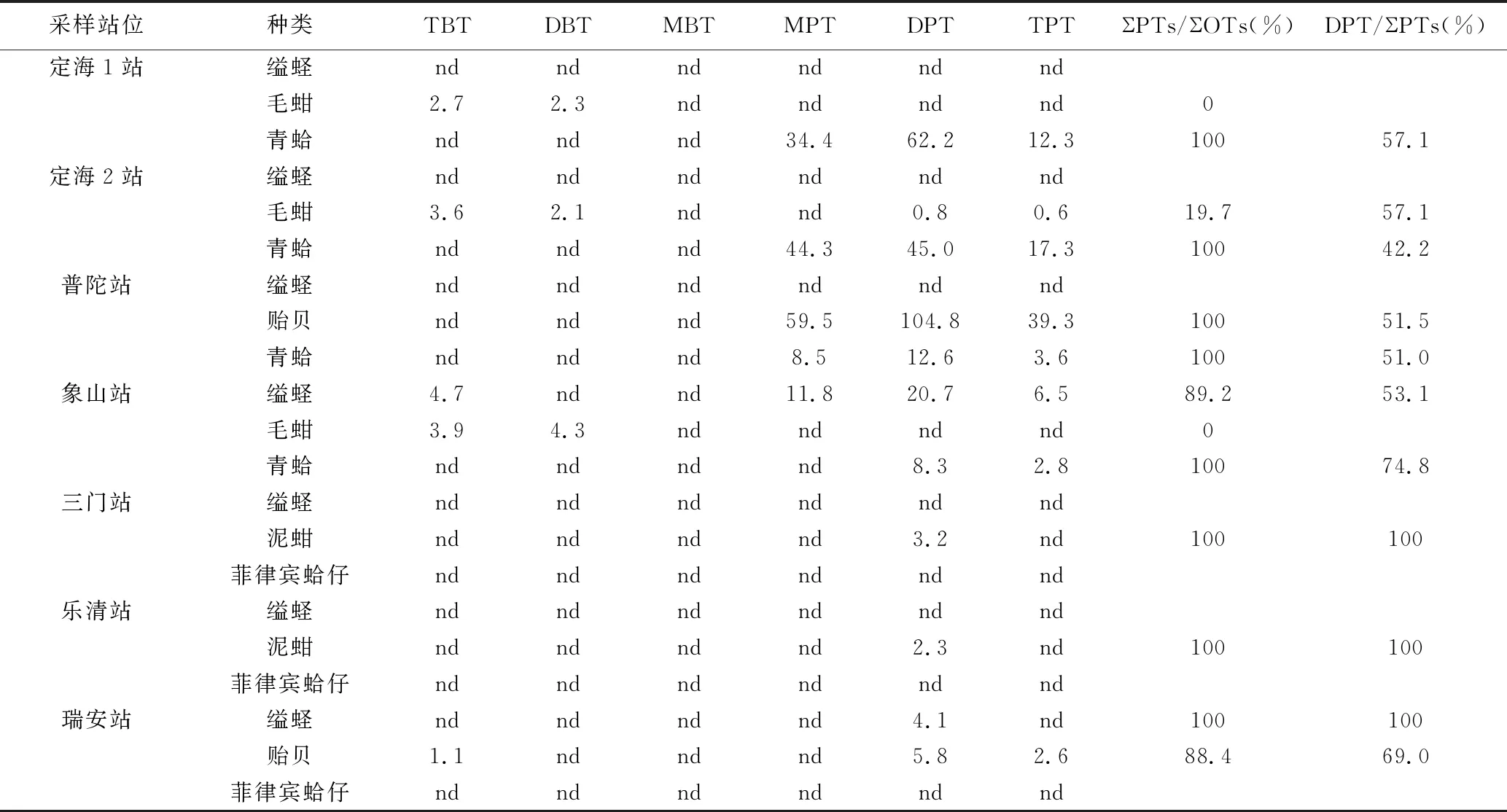
表2 浙江沿海贝类体内有机锡含量Tab.2 Concentrations of organotins in shellfishes from coastal areas of Zhejiang ng·g-1

表3 浙江沿海贝类体内丁基锡和苯基锡含量范围及检出率Tab.3 Concentration ranges and detection rate of butyltins and phenyltins in shellfishes of Zhejiang coastal area
由结果可知,贝类体内苯基锡的检出率较高(52.4%),含量介于nd~203.6 ng·g-1之间。除毛蚶外,苯基锡是贝类体内主要的污染物,约占有机锡总含量的88.4%~100%。而DPT是主要的苯基锡污染物,约占42.2%~100%,含量范围为nd~104.8 ng·g-1。丁基锡的检出率为23.8%,含量范围为nd~8.2 ng·g-1,以三丁基锡为主,而贝类体内均未检出MBT。
贝类体内的丁基锡检出率和含量均呈现TBT>DBT>MBT的变化规律。邓利 等[10]在对深圳蛇口港及深圳湾潮间带动物(牡蛎、贻贝等)检测有机物污染时发现,所有站位采集的双壳类体内普遍检测出TBT及其降解产物DBT,但均未检测出MBT。赵孔祥 等[16]对来自大连、山东和天津沿海的贝类中的有机锡进行检测时发现,主要以TBT为主。上述研究与本研究结果相似,说明研究区域贝类体内的丁基锡主要以三丁基锡为主。
贝类体内苯基锡含量呈现DPT>MPT>TPT的变化规律,显示苯基锡主要以TPT的降解产物DPT和MPT为主。从含量水平来看,研究区域贝类体内的苯基锡含量远远高于丁基锡含量。有报道称[17],TPT除了可以用于防污涂料添加剂外,还广泛地作为农业杀虫剂成分用于海水养殖的网箱中。另外,由于作为防污涂料成分的TPT价格低于TBT,这也使得渔民更倾向于使用含TPT的防污涂料[18]。贝类体内较高的苯基锡含量可能与防污涂料中TPT的释放输出有关。
2.2 丁基锡和苯基锡在不同采样点的分布特征
由于污染背景不同,不同采样点采集的贝类动物体内丁基锡和苯基锡含量往往差异很大。比较有机锡化合物在不同采样点中的分布有利于分析其在各地的污染水平和可能的来源。
图2为浙江沿海贝类体内有机锡含量的分布变化。普陀站贝类体内的有机锡和苯基锡含量为最高,其次为定海两个采样点。象山站贝类中的丁基锡含量为最高,定海两个采样点的丁基锡含量水平相当,而普陀站、三门站和乐清站三地的贝类中丁基锡均未检出。
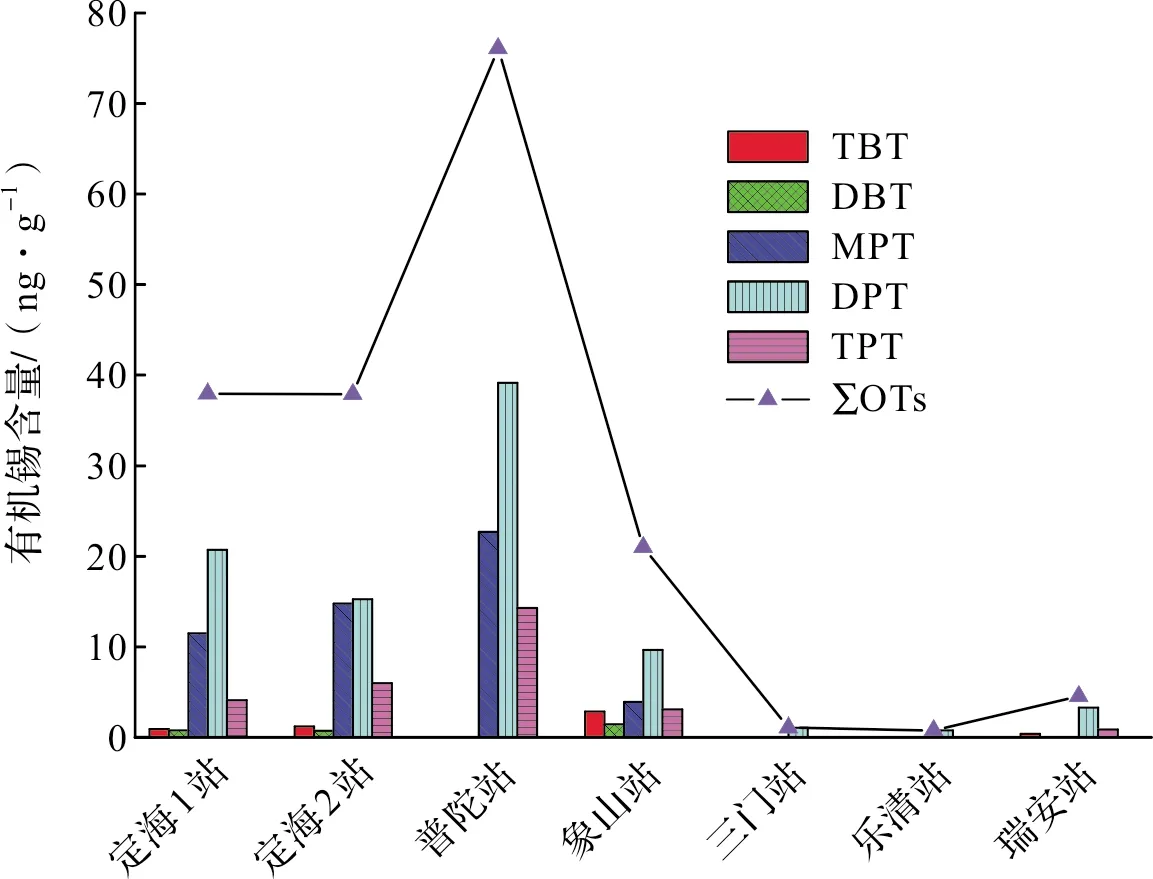
图2 浙江沿海各站位贝类中丁基锡和苯基锡平均含量分布Fig.2 Regional distribution of butyltins and phenyltins average concentration in shellfishes along Zhejiang coastal area
从不同区域贝类中有机锡含量的变化来看,各地有机锡含量水平差异较大。普陀站和定海站贝类中的有机锡含量明显高于其它区域,说明贝类体内有机锡含量与其栖息地有着较为紧密的关系,有机锡污染在海洋环境中的不均匀性导致了其在贝类体内含量水平分布的不均匀性。WANG et al[19]对厦门海域的研究中发现,有机锡污染与海上航运关系密切。同样,KEVIN et al[20]对香港海域疣荔枝螺(Reishiaclavigera)有机锡污染的长期时空变化趋势进行了研究,发现在渔村和台风避风地的疣荔枝螺体内三苯基锡和总有机锡含量最高,认为海运可能是有机锡污染的主要来源之一。宁波舟山港作为中国沿海主要港口和国家综合运输体系的重要枢纽,是国内重要的铁矿石中转基地、原油转运基地、液体化工储运基地和华东地区重要的煤炭、粮食储运基地。2019年宁波舟山港的货物吞吐量达到了11.2亿吨[21](其中舟山港为7亿吨[22]),而温州港和台州港货物吞吐量分别为0.75亿吨和0.49亿吨[21]。不同区域贝类体内有机锡含量从高到低呈现出:普陀站和定海站(舟山港)>象山站(宁波港)>乐清站和瑞安站(温州港)>三门站(台州港)的变化趋势。由此可见,港口货物吞吐量对贝类体内有机锡含量具有重要的影响,说明海运船舶的防污涂料可能是贝类体内有机锡的主要来源。
2.3 丁基锡和苯基锡在不同物种中的生物富集
不同生物种类对有机锡化合物的吸收、降解和代谢机制各有不同,导致其体内有机锡水平往往产生很大差异。本研究共采集了6种不同的贝类生物,图3为丁基锡和苯基锡在5种贝类体内含量水平的分布情况(菲律宾蛤仔体内因未检出有机锡而不做统计;另外,MBT在所有贝类中均未检出,也不作统计)。由图可知,除毛蚶中丁基锡含量高于苯基锡外,其它4种贝类中苯基锡含量均高于丁基锡含量。从苯基锡化合物来看,贻贝对苯基锡富集能力最强,其次为青蛤,而泥蚶和缢蛏的含量水平相当,都较低。各站位毛蚶体内均检出丁基锡且含量为所有种类最高,其次为缢蛏,这可能与两者栖息于潮间带软泥或含砂的泥质环境,易蓄积丁基锡和对丁基锡的代谢能力较低等因素有关。
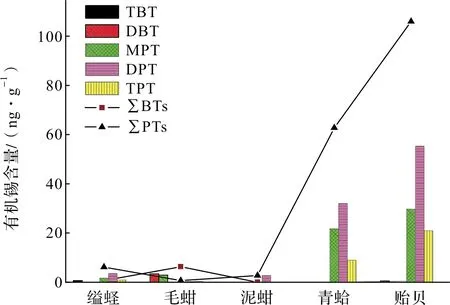
图3 不同贝类体内丁基锡和苯基锡平均含量分布Fig.3 Distribution of average levels of butyltins and phenyltins in shellfishes
综合来看,贻贝对有机锡的富集能力最强,其体内含量水平远远高于其它贝类,该结果与沈海涛 等[23]的研究结论相符。影响不同贝类体内有机锡的富集水平除栖息环境中有机锡污染水平外,还取决于其它因素,如不同的摄食行为、不同的消除代谢行为和污染物在其体内的储存机制等[24]。由于目前国内相关报道缺乏本研究中贝类种类的有机锡数据,加上有机锡计量方法的差异,因此无法与文献数据作精确比较。
2.4 浙江沿海贝类中有机锡对人体的健康风险评价
本研究中所采集的贝类均为人们喜爱食用的海产品,对于丁基锡和苯基锡具有较强的富集能力。有研究报道,海洋贝类对TBT的生物富集因子(BCF)可达5 000~10 400[25]。即使环境中的丁基锡和苯基锡含量很低,贝类生物也可以通过生物富集作用将有机锡污染物积蓄到一个很高的水平,进而通过食物链威胁到人类健康。人们食用了含有有机锡化合物的水产品可能会产生晕眩、恶心等症状[26]。暴露于TBT、DBT和苯基锡后会急剧地削弱NK细胞杀死肿瘤的功能,并对人体NK细胞的功能产生不可逆的抑制作用[25-28]。本研究参考FENNER et al[29]对NPnEOs进行风险评价的风险系数法对有机锡对人体的健康风险作初步的探讨。
风险系数法计算公式如下
(1)
式中:RQmix为多个污染物的总风险系数,PECx为污染物x的预测环境含量;PNECx为污染物x的预测无影响含量;RQx为污染物x的风险系数。
本研究将TBT和TPT及其降解产物风险系数的总和作为评价标准。当RQmix<0.1时,贝类体内的有机锡未对人体健康产生风险;当RQmix为0.1~1.0时,表明有机锡的风险程度较低;当RQmix>1.0时,表明有机锡对人体健康产生一定的风险,应考虑采取必要的控制措施。
目前我国尚未制定生物体中有机锡的评价标准,而且也没有比较全面的贝类中有机锡的统计资料,因此PEC采用了贝类体内有机锡的实测含量,PNEC采用了高俊敏[30]提出的渤海地区海产品可容忍的平均残留量(TARLs, Tolerable Average Residue Levels)作为本文的PNEC值,有机锡化合物MBT、DBT、TBT、MPT、DPT、TPT的PNEC值分别为1 707.3、511.9、68.3、3 170.7、905.6和115.9 ng·g-1(湿重)。由公式(1)计算贝类中的有机锡RQ结果见图4(样品的平均含水率以85%计),其中9个贝类样品中的有机锡和所有样品中的MBT因未检出而未纳入风险系数计算。
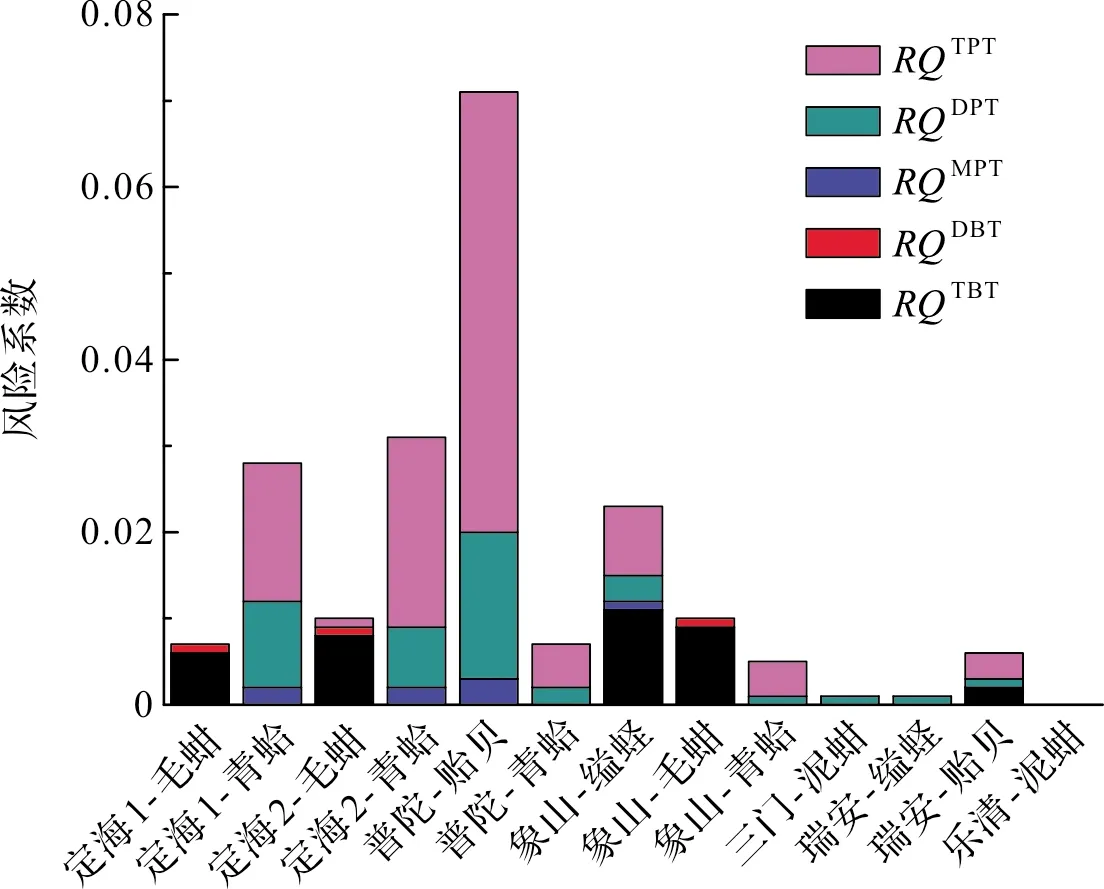
图4 浙江沿海贝类中有机锡的风险系数Fig.4 Risk quotients of organotins in shellfishes of Zhejiang coastal area
由图4可知,研究区域所有样品的有机锡总风险系数RQmix均小于0.1,表明贝类中的有机锡未对人体健康产生风险,浙江沿海贝类对食用人群的健康是安全的。从5种有机锡组分对RQmix的贡献来看,TPT的贡献率最大(平均可以达到36.3%),其次是DPT(33.1%)和TBT(26.6%)。而从贝类种类来看,普陀站贻贝的RQmix值最高(0.07),主要是由于其TPT和DPT的RQ值较高。上述结果显示对人体健康可能产生潜在风险的有机锡主要组分是DPT、TPT和TBT,因此还需要在今后的研究中进一步加以关注。
3 结论
(1)浙江沿海贝类体内以苯基锡为有机锡主要污染物,含量范围为nd~203.6 ng·g-1,苯基锡又以DPT为主。丁基锡含量范围为nd~8.2 ng·g-1,以TBT为主。贝类体内的丁基锡和苯基锡分别呈现TBT>DBT>MBT和DPT>MPT>TPT的变化规律。
(2)由不同区域贝类中的有机锡含量与港口货物吞吐量的比较可以看出,浙江沿海贝类中有机锡主要来源于海运船舶的防污涂料。
(3)从不同贝类富集有机锡的能力来看,贻贝对有机锡化合物的富集能力最强,其体内含量水平高于其它贝类。贝类体内有机锡的含量水平可能与其栖息环境和代谢能力等因素有关。
(4)采用风险系数法评价了有机锡对人体的健康风险,结果表明,浙江沿海贝类中的有机锡未对人体健康产生风险。

