我国东南沿海坛紫菜遗传多样性研究
吴晓雯,王铁杆,刘 颖,张 鹏
(浙江省海洋水产养殖研究所,温州市海洋生物遗传育种重点实验室,浙江省近岸水域生物资源开发 与保护重点实验室,浙江 温州 325005)
0 引言
坛紫菜(Pyropiahaitanensis)隶属于红藻门(Rhodophyta),红藻纲(Rhodophyceae),红毛菜科(Bangiaceae),法紫菜属(Pyropia)[1],是一种生长在潮间带岩礁上的暖温带大型藻类,分布在浙江、福建和广东,是我国特有的经济种类。目前我国坛紫菜栽培规模达24 863 hm2,年产量86 495 t,总产量占全国紫菜总产量的76%[2-3]。坛紫菜味美价廉,富含大量人体必需的蛋白质、多糖、氨基酸、矿物质和维生素,可供食用和药用,有着“营养宝库”的美称。
从20世纪60年代初开始坛紫菜养殖以来,大部分栽培品系仍由岩礁上采集的野生种驯化而来,过去10 a间在养殖实践中仅有一次引入野生种。种内频繁自交和遗传漂变导致种质退化,使养殖的坛紫菜产量逐年下降,急需对坛紫菜种质进行纯化、再生和遗传改良[4]。物种的遗传多样性是其基因库中遗传信息的总和,将新的基因引入现有物种中可以提高其适应性、养殖产量以及对疾病和环境的抵抗力[5]。因此,对野生坛紫菜资源开展遗传多样性研究具有重要意义。环境污染、水产养殖、堤坝建设等人类活动对潮间带生态系统和结构产生了重大影响,野生藻场资源受到威胁,但鲜有对野生坛紫菜遗传多样性研究的报道。因此,对现存的野生坛紫菜群体进行资源调查和遗传多样性分析,可为其人工繁育所需的原始种质资源提供参考。
分子标记是检测种质遗传结构和变异的常用技术手段。目前,RAPD[6]、AFLP[7]、ISSR[8-9]、SSR[10-11]、SCAR[12]已用于坛紫菜遗传多样性的研究,但这些标记存在一定的局限性,比如有的可重复性低,有的需较多人力和成本。日趋流行和成熟的测序技术则可提供更为准确的核苷酸序列数据,如核糖体ITS-5.8S rDNA和叶绿体rbcL[13-15]等已广泛应用于藻类研究。线粒体细胞色素氧化酶亚基I(cytochrome c oxidase subunit I,COX)基因变异大,是研究群体遗传变异的理想标记。叶绿体中的光合作用第一关键酶——核酮糖1,5-二磷酸羧化酶/加氧酶(Rubisco)的大亚基,由叶绿体基因组编码,简称rbcL。COX和rbcL基因经常被用作条形码标记用于评估海藻的遗传多样性,包括隐藏物种的多样性和群体结构[16-20],但它们还未被用于研究坛紫菜遗传多样性。
本研究使用COX和rbcL基因研究我国东南沿海的坛紫菜,旨在初步摸清我国东南沿海野生坛紫菜的遗传多样性特征,为野生坛紫菜保护提供理论依据。
1 材料与方法
1.1 实验材料
本研究所用的125株坛紫菜样品于2017年至2019年分别采自浙江的台州大陈岛(DC)、温州南策岛(NC)、温州乐清湾(YQ)、温州竹屿岛(ZY)、温州洞头胜利岙(SL)、温州洞头桐岙(TQ)和温州北麂小筲箕屿(BJ),福建的平潭岛(PT)、莆田南日岛(NR)和宁德北礵岛(BS),广东的汕头平屿(PY)。除乐清湾和桐岙的紫菜样品为养殖群体外,其余样品均为野生群体,样品信息见表1。将叶状体洗净晾干,密封保存于-20 ℃冰箱。
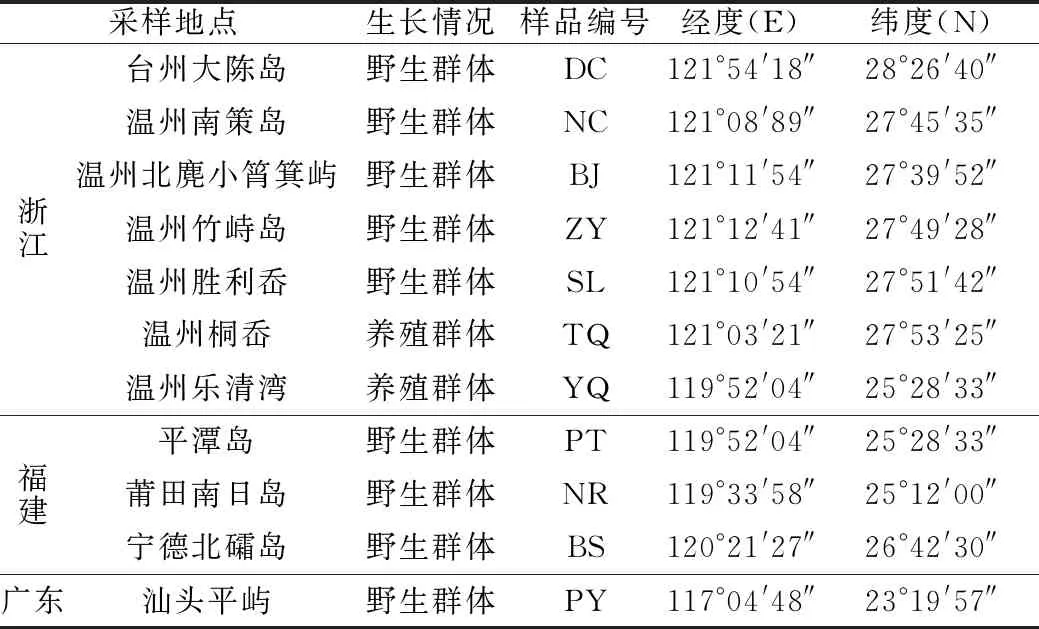
表1 坛紫菜样品信息Tab.1 Sample information of Pyropia haitanensis
1.2 坛紫菜基因组DNA提取
用双蒸水多次冲洗叶状体,吸水纸吸干表面水分后使用植物基因组DNA快速提取试剂盒(北京艾德莱生物科技有限公司,DN1401)提取总基因组DNA。利用1%的琼脂糖凝胶电泳检测DNA质量,再通过微量分光光度计(Nano-400)测定DNA的质量与浓度,于-20 ℃分管保存。
1.3 目标片段PCR扩增和测序
本实验参考NCBI相关序列自行设计PCR扩增引物:COX-F:5’-GATGCTGTACCCGGTAGAT-3’,COX-R:5’-GTTGTAATTGTTTAGCTGTTTTT-3’,rbcL-F:5’-GACTCCAACAGCAAACATCTAG -3’,rbcL-R: 5’-TTAATAYCTAGCTCCTTCAGGC-3’。引物由上海生工生物有限公司合成。
PCR反应体系选用25 μL,其中包括:超纯水9.5 μL,上下游引物各1 μL,DNA模板1 μL,2×A 8fasthifi PCR master(北京艾德莱生物技术有限公司)12.5 μL。PCR程序包括:95 ℃预变性3 min,95 ℃变性10 s,退火15 s(COX基因49 ℃、rbcL基因52.5 ℃),72 ℃延伸30 s(变性延伸35个循环),最后72 ℃再延伸5 min。每次反应均设置阴性对照以检验是否有污染。PCR产物通过1%琼脂糖凝胶电泳检测,确定PCR产物为目的基因序列后,送至杭州擎科生物有限公司进行纯化及双向测序。
1.4 数据处理
利用DNAstar 5.0软件包中的Seqman对获得的原始序列进行拼接,并结合峰图进行人工校对。通过NCBI的Blast比对验证两组数据(COX和rbcL)是否为目的基因序列。采用DNAsp 5.0[21]分析多态位点数、单倍型多样性和核苷酸多样性,统计单倍型[22]。采用MEGA 6.0[23]计算碱基组成、简约信息位点数和单碱基突变位点,根据Kimura两参数模型(Kimura-2-Parameter, K2P)[24]计算群体间的遗传距离以及单倍型遗传距离。采用最大似然法(Maximum Likelihood,ML法)构建单倍型的系统发生树,各个节点的支持度采用bootstrap方法进行1 000次自检。利用PopART 1.7[25]构建单倍型网络图,探讨坛紫菜单倍型是否存在谱系结构。采用R软件进行群体配对遗传分化和地理距离的线性回归分析和Mantel检验。利用DNAsp5.0中Tajima’D检验中性假说,验证东南沿海坛紫菜群体是否经历历史扩张[26]。使用Arlequin v3.5[27]进行分子方差(AMOVA)分析。
2 实验结果
2.1 碱基组成
本实验共获得125条序列,经过剪辑得到408 bp的COX基因片段和488 bp的rbcL基因片段。COX基因片断的T、C、A、G含量分别为37.6%、13.8%、34.1%和14.5%,A+T含量为71.7%,符合线粒体组成特征。rbcL基因片断的T、C、A、G含量分别为32.6%、15.2%、34.3%和17.9%。COX和rbcL基因片断串联后的长度为896 bp,T、C、A、G含量分别为34.9%、14.6%、34.2%和16.3%。
2.2 遗传多样性
COX基因片断中有2个缺失位点,68个变异位点,其中单碱基变异位点17个,简约信息位点51个。rbcL基因片断中变异位点60个,其中单碱基变异位点2个,简约信息位点58个。COX和rbcL基因片断串联分析检测到变异位点128个,其中单碱基变异位点19个,简约信息位点109个。
COX基因片断显示11个群体的单倍型多样性为0.790 0±0.023 0;核苷酸多样性为0.045 5±0.035 0,平均核苷酸差异度为18.269 0,Tajima’s D值为0.950 4(p>0.10)。rbcL基因片断显示11个群体的单倍型多样性为0.477 0±0.047 0;核苷酸多样性为0.028 4±0.023 1,平均核苷酸差异度为11.950 0,Tajima’s D值为0.710 3(p>0.10)。
COX和rbcL基因联合片断分析结果见表2。群体间单倍型多样性最高的是大陈岛(DC,0.972 0±0.064 0),北礵岛最低(BS,0.182 0±0.144 0)。核苷酸多样性最高的是南策岛(NC,0.026 4±0.028 6),胜利岙最低(SL,0.000 3±0.000 4)。

表2 基于COX和rbcL基因联合片段的坛紫菜11个群体遗传多样性参数Tab.2 Genetic diversity parameters of 11 Pyropia haitanensis populations based on the concatenated COX and rbcL gene fragments
2.3 群体遗传距离
基于COX和rbcL基因联合分析的群体间遗传距离见表3。遗传距离范围在0.000 3~0.111 0之间。平屿(PY)和大陈岛(DC)两个群体间遗传距离最大(0.111 0),乐清湾(YQ)和桐岙(TQ)遗传距离最小(0.000 3)。大陈岛(DC)与其它群体的遗传距离也较大。

表3 基于COX和rbcL基因联合片段的坛紫菜11个群体遗传距离Tab.3 Genetic distance between 11 Pyropia haitanensis populations based on concatenated COX and rbcL gene fragments
群体间遗传距离和地理距离相关性检测显示二者具有线性相关性(R2=0.002 2,p=0.735 4),群体遗传距离随地理距离的增大而增大,但没有形成地理隔离(Mantalr=0.046 6,p=0.291 8)(图1)。

图1 基于COX和rbcL基因片断的坛紫菜群体遗传 距离和地理距离相关性分析Fig.1 The correlation between population genetic distances and geographical distance based on COX and rbcL gene fragments
2.4 群体遗传结构
AMOVA分析结果显示(表4),坛紫菜群体间遗传变异主要来自于群体间(83.960 0%,p<0.001 0),群体内的遗传差异只占16.040 0%(p<0.001 0)。
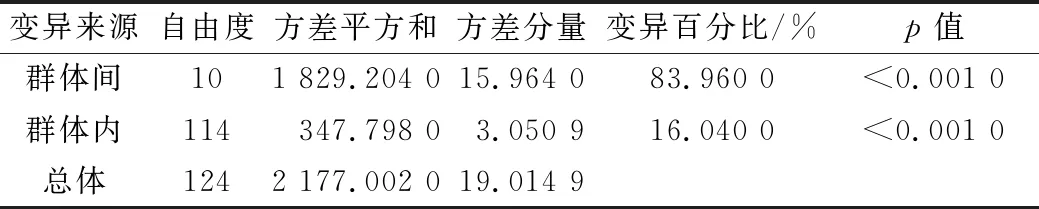
表4 基于COX基因和rbcL基因的坛紫菜群体AMOVA分析Tab.4 AMOVA analysis based on concatenated COX and rbcL gene fragments
Tajima’s D值主要检测目标序列在进化过程中是否遵循中性进化模型。COX基因(Tajima’s D=2.295 1)和rbcL基因(Tajima’s D=3.095 6)的单独分析,以及它们的联合分析(Tajima’s D=2.687 1)结果显示(表2),总Tajima’s D为正值,坛紫菜的进化方式为平衡选择,且有单倍型分化,与单倍型检测结果相符。
COX基因片断检测到25个单倍体,而rbcL基因片断只检测到8个单倍体。联合分析的128个变异位点在125个坛紫菜个体中定义了31个单倍型(Hap1~Hap31),上传到GenBank获得相应的序列号(MW380389~MW380413, MW391915~MW391922)。其中Hap1、Hap10和Hap16为核心单倍型,分别占总个体的 32.8%、12.8%和24.8%。单倍型网络图(图2)显示单倍型分为三大支,Hap29连接了其中两大支,可能是一个重要的单倍型。大陈岛(DC)群体内部分单倍型在网络图上独立出来,但其它群体没有明显的地理谱系结构。
以Pyropiayezonesis(COX: GenBank号KF561997.1;rbcL: GenBank号AB818919.1)和Paropiafucicola(COX: GenBank号KF561997.1;rbcL: GenBank号KJ776837.1)为外群,构建的坛紫菜单倍型ML系统树(图3)显示,所有坛紫菜与这两种紫菜明显分开,坛紫菜31个单倍型主要分为三大支,与单倍型网络图相符。
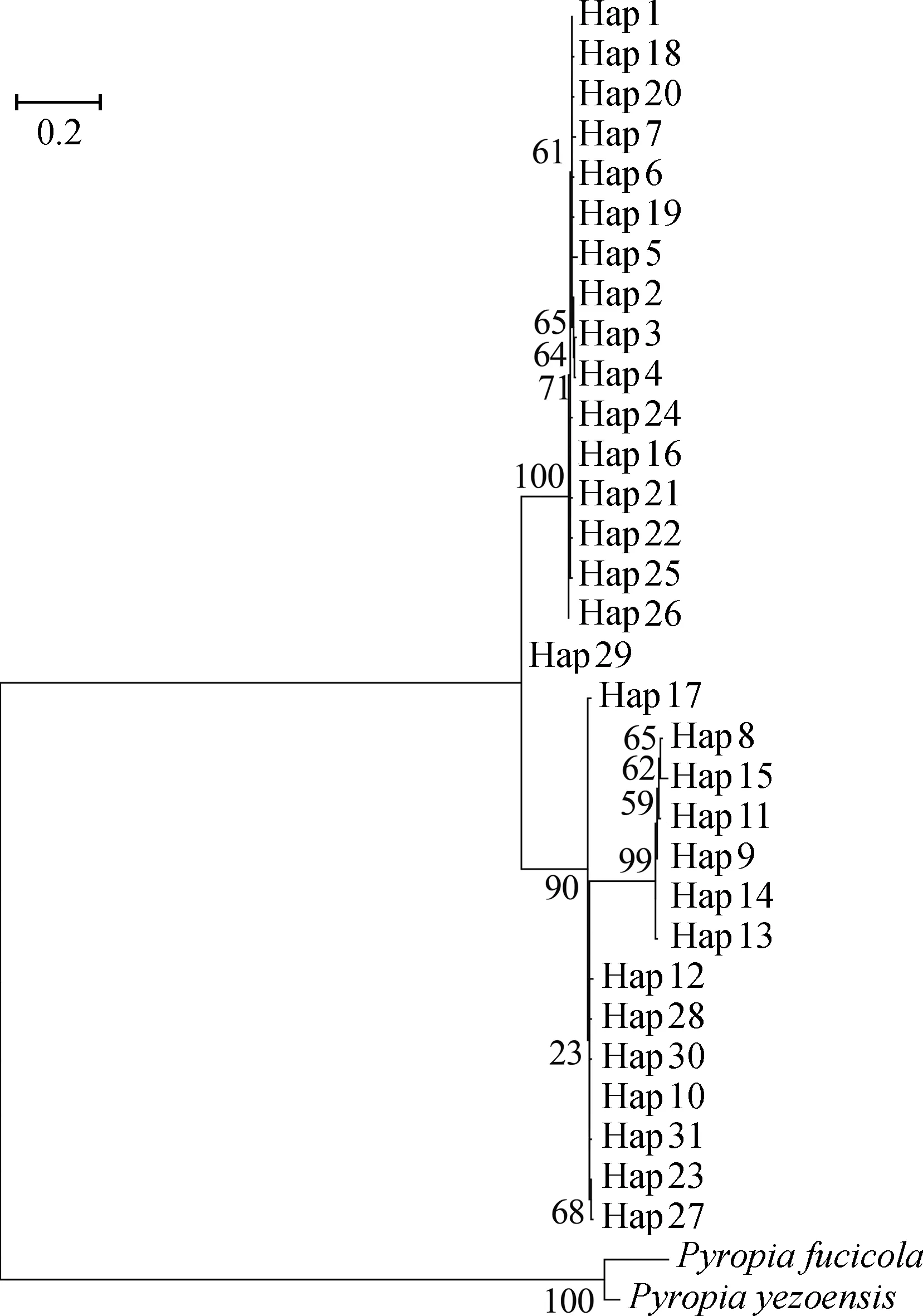
图3 基于COX和rbcL基因片段的坛紫菜31个 单倍型的ML系统发育树Fig.3 Maximum likelihood tree of 31 haplotypes based on COX and rbcL gene fragments (图中各分支数字代表置信值,标尺表示序列之间差异。) (Each branch number in theFigure represents a confidence value, and the scale indicates the difference between the sequences.)
3 讨论
3.1 分子标记选择
近年来,分子标记技术如RAPD[6]、AFLP[7]、ISSR[8-9]、SSR[10-11]、SCAR[12]等被广泛应用于群体遗传学研究。本次研究选择了线粒体COX基因和叶绿体rbcL基因片段来分析坛紫菜遗传多样性,结果显示COX基因片段的变异位点有68个,占比16.7%;rbcL基因片段的变异位点有60个,占比12.3%,这与其它红藻(Gracilariavermiculophylla)研究相类似[28]。对于东南沿海坛紫菜,COX基因片断单倍型多样性为0.790 0±0.023 0,核苷酸多样性为0.045 5±0.035 0;rbcL基因片断单倍型多样性为0.477 0±0.047 0,核苷酸多样性为0.028 4±0.023 1,这两个基因结果都高于红藻[28]。在125个个体中,COX基因片断检测到25个单倍型,而rbcL基因片断只检测到8个单倍型,表明COX基因在群体核苷酸多样性和单倍型分析时更有价值,该结果与YANG et al[28]研究结论相符。
3.2 坛紫菜遗传多样性
遗传多样性不仅是生物多样性的内在表现形式,还是物种保持进化潜能的基本条件,对生物多样性的形成、发展或维持有重要影响[29]。群体中单倍型多样性是评价该群体遗传分化和多态程度的重要指标之一,数值越大,群体遗传多样性越高。11个群体的核苷酸多样性为0.035 9±0.028 4,单倍型多样性为0.817 0±0.024 0,这种较高单倍型多样性和较低核苷酸多样性结果符合GRANT et al[30]提出的海洋生物遗传多样性的一般特征。大陈岛(DC)群体共有9个个体,检测到8个单倍型,占所有单倍型的25.8%,其单倍型多样性和核苷酸多样性明显高于其它坛紫菜群体(表2)。大陈岛隶属于台州,该地区是一个较好的野生坛紫菜种质资源库,但近几年在海区采样时发现该区域的野生坛紫菜生物量明显减少。因此,需要加大对该海区野生坛紫菜的保护力度,防止野生坛紫菜藻场的退化和衰竭。
ML系统发育树和单倍型网络图虽然呈现三大分支,有明显的谱系结构,但这些谱系的单倍型组成可能与其地理来源不完全匹配,各个群体间存在一定的基因交流,可能与异地扩散或引种有关。该结果和王金丹 等[9]通过微卫星对浙南4个海域(苍南铁钉岛、洞头竹屿岛、南麂列岛和温岭斜头岛)野生坛紫菜遗传多样性的研究类似,坛紫菜群体间群体遗传分化水平较低。坛紫菜大部分为雌雄异体,繁殖方式主要为异交,在其生活史中果孢子及壳孢子都可以通过海流进行长距离传播。中国沿海同时存在南向和北向的两种主要洋流,一是黑潮的支流,沿中国台湾北上进入东海,即台湾暖流;二是季节性的浙闽沿岸流,在冬季和夏季分别自北向南和自南向北流动,促使不同海区间的物质循环和交流[31]。这些洋流使坛紫菜果孢子和壳孢子大范围的漂移成为可能,可能促进坛紫菜群体间的个体混杂,从而影响群体间的遗传分化。
桐岙(TQ)和乐清湾(YQ)之间的遗传距离最小,说明两者亲缘关系最近。这两个群体皆来自于养殖群体,在育苗和生产过程中,可能存在不同品种的相互混杂。虽然两个群体采自不同海域,但仍可能来自同一亲本。长此以往,养殖坛紫菜品系容易退化,会对坛紫菜生产造成不利影响。因此,需要加强对坛紫菜养殖种质资源的研究和保护。
综上所述,本研究使用线粒体COX和叶绿体rbcL基因片段对我国东南沿海11个坛紫菜群体进行检测,发现坛紫菜遗传分化水平较低。在目前野生坛紫菜种质资源保护尚好的情况下,应重视对关键种质资源的收集、保存和保护,为坛紫菜新品系的培育提供优良材料和理论支持。
致谢感谢两位审稿专家对本文提出的宝贵意见。

