碘量法测定硼氢根浓度及主要影响因素
吴 冰
(三门峡市有色金属质量科学研究所,河南三门峡472000)
硼氢化钠(NaBH4)亦称四氢硼化钠,其固体粉末为白色晶体, 在空气中加热至300 ℃以上发生分解,具有良好的热稳定性。硼氢化钠中硼为+3 价,其原子核外电子排布为2s12px12py12pz0, 具有一个空轨道,极易形成稳定的配位化合物,因此,硼氢化钠表现出强还原的化学特性,在有机和无机工业领域均有广泛应用[1]。 如硼氢化钠对不同有机物表现出较高的选择性还原能力,在医药领域,多种维生素、消炎药及甲砜霉素等药物的合成均需要硼氢化钠作为还原剂[2];在涂料、纤维和塑料等聚合物工业中,硼氢化钠可有效除去材料中的羰基、重金属离子和过氧化物等杂质成分,起到纯化剂的作用[3]。在无机化工领域,造纸工业采用硼氢化钠作为还原剂将亚硫酸氢钠还原为连二亚硫酸钠, 作为生产纸浆的漂白光亮剂[4];冶金工业使用硼氢化钠处理生产废水,将其中的重金属阳离子及其络合离子还原为相应的金属单质, 使废水达到环保排放标准的同时回收其中有价金属[5]。
在硼氢化钠的电子结构中, 硼原子构成sp3杂化且与其周围的4 个氢原子形成共价键, 进而表现出优良的储氢性能。 硼氢化钠因具有理论质量储氢密度高、物理化学性质稳定、易于运输及释放氢气效率高且速率可控等优点,自20 世纪90 年代末期,作为最具商业化应用前景的化学储氢材料被世界各国学者广泛研究[6]。 目前,硼氢化钠已大规模应用于质子交换膜燃料电池(PEMFC)和直接硼氢化物燃料电池(DBFC)的生产。 在PEMFC 中,硼氢化钠在电池反应器中发生水解释放氢气, 供给电池系统消耗;而在DBFC 中,硼氢化钠用作阳极燃料,是电池系统的重要组成部分[7-10]。
根据以上分析可知,硼氢化钠的应用绝大多数是在水溶液介质当中,而不同领域对其使用的浓度范围有着较大差别,因此,精准检测溶液中硼氢化钠的含量对其工业应用具有重要意义。 M.V.Mirkin等[11]提出采用循环伏安法测定碱溶液中低浓度硼氢根含量,但循环伏安曲线的背景电流对最终的测试结果影响较大。 S.Amendola 等[12]采用开路计时电位法对硼氢根含量进行测定,结果发现不同的参比电极会对电化学测试结果产生较大误差。 相比之下,滴定分析是一种简单、快捷的定量分析方法,其中碘量法是氧化还原滴定中最主要的分析检测方法。 大量实验研究和工业生产实践表明,碘量法对于硫化物、水溶液中醛类和酚类等有机物,以及矿冶行业铜、铁、锡等重金属含量的测定均表现出较高的准确性[13-16]。 刘毅敏等[17]采用碘量法测定硼氢化钠浓度,考察了样品吸潮程度以及溶液碱浓度的不同对检测结果的影响;E.L.Gyenge 等[18]研究了溶液酸度对碘量法测定硼氢根浓度的影响,发现当溶液pH 大于5 时会显著增加I2的消耗, 导致测试结果偏高。
综合以上分析发现,研究者虽然在水溶液中硼氢化钠定量检测方面做了一些尝试,但目前还尚未开发出一种满足工业应用要求的精准检测方法。 碘量法相比于其他方法对不同原料表现出更强的适应性和检测结果的准确性,有潜力成为大规模工业应用的硼氢化钠定量检测方法。 然而,目前关于滴定过程中不同因素对检测结果的影响研究仍不全面,造成检测误差的主要原因亦不清楚。 基于以上问题, 本工作对分析测试过程中溶液酸度、KI 的添加量、指示剂用量、水封暗放时间等主要因素对检测结果的影响进行了系统研究, 明确主要影响因素,获得优化的滴定工艺条件,从而提供一种简单、快捷的硼氢化钠精准检测方法。
1 实验部分
1.1 仪器与试剂
硫酸溶液:4.0 mol/L;淀粉指示剂:10 g/L;碘酸钾标准溶液:0.100 0 mol/L(1/6 KIO3基准物);硫代硫酸钠标准溶液:0.1 mol/L(重铬酸钾标准溶液标定);碱性硼氢化钠溶液:0.050 00 mol/L BH4-+1.000 mol/L NaOH。本实验所用到的药品试剂均为分析纯,标准溶液均按GB/T 601—2016《化学试剂标准滴定溶液的制备》、GB/T 603—2002 《化学试剂试验方法中所用制剂及制品的制备》标准制备。
1.2 方法原理
碘量法是使用定量的氧化剂将碘化物(通常为KI)氧化生成游离碘,再由标准还原剂溶液滴定析出的碘单质,从而间接测定氧化剂量的方法。碘是弱氧化剂,其标准电极电势φI2/I-⊖=0.545 V,能与强还原剂发生作用, 而I-是中等强度还原剂能与多种氧化剂进行反应。根据电极电势的不同,碘量法可采取直接和间接两种方式进行: 电位比φI2/I-⊖低的还原性物质可直接用I2标准溶液滴定, 而电位高于φI2/I-⊖的氧化性物质需在一定条件下用I-还原生成I2,利用I2在水中溶解度较低的特点(0.001 33 mol/L),将I2溶解在KI 溶液中使之以I3-形式存在,然后用Na2S2O3标准溶液滴定释放出的I2,从而确定氧化剂的量。
本文采用间接碘量法:由于NaBH4具有强还原性,碱性条件下可与氧化剂KIO3(过量)发生定量反应,见式(1):
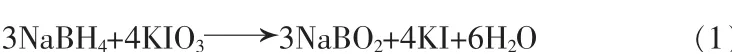
酸性条件下过量的KIO3可以和过量的KI 反应生成I2,见式(2):

生成的I2再用Na2S2O3标准溶液标定, 反应见式(3):
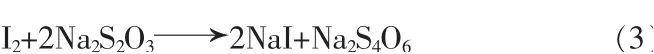
最后,根据式(4)可计算得到所测溶液中硼氢根的浓度:

1.3 实验方法
用移液管移取25.00 mL 碱性硼氢化钠溶液置于碘量瓶中, 加入20.00 mL KIO3溶液振荡60 s 使之充分反应,再根据实验设计条件加过量的KI 以及适量的4.0 mol/L H2SO4将溶液pH 调节至5 以下,水封冷却暗放数分钟。 用标定过的Na2S2O3进行滴定,在滴定终点将至时加入适量淀粉指示剂,再继续滴定至蓝色完全消失,30 s 不返蓝即滴定结束,按式(4)计算最终结果。
2 结果与讨论
2.1 正交实验
经过初步研究分析认为影响碘量法测定溶液中硼氢化钠含量的主要因素有:溶液酸度、KI 添加量、水封暗放时间及淀粉指示剂添加量等。 为进一步明确以上因素对滴定结果的影响规律进而获得最佳的滴定工艺参数,开展四因素四水平正交实验L16(44)研究。 因素水平条件见表1,滴定结果见表2。

表1 正交实验因素水平表
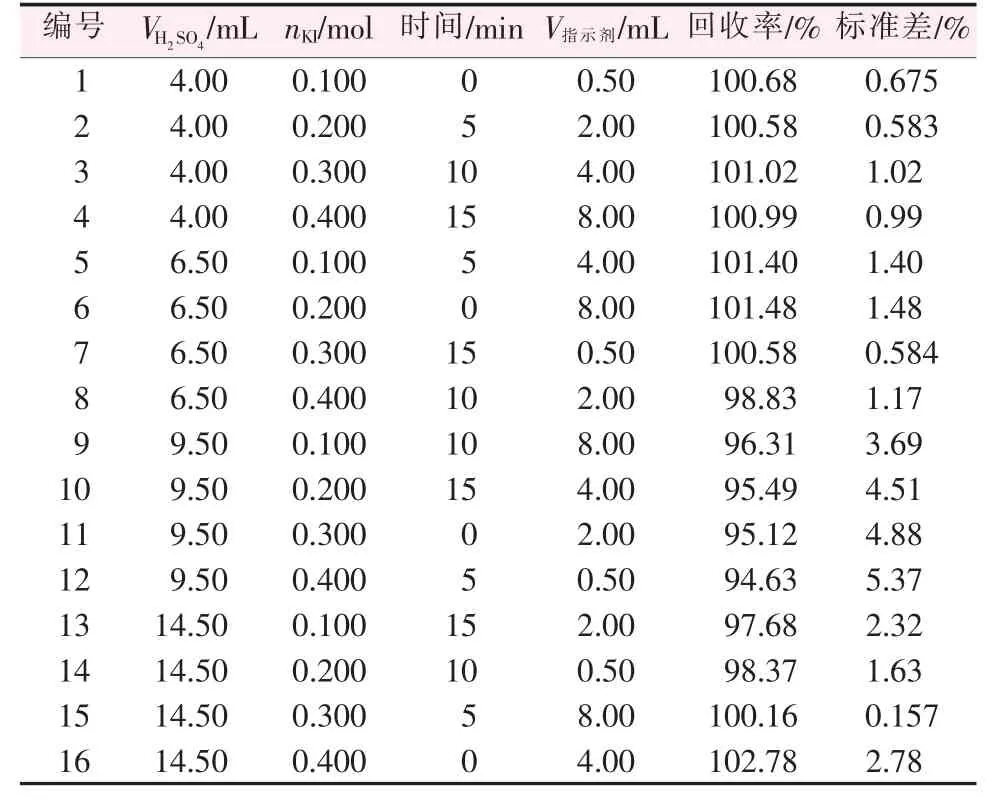
表2 L16(44)正交实验结果(n=3)
2.2 溶液酸度的影响
根据表2 中正交实验结果, 分析了溶液酸度对滴定结果的影响, 结果如图1 所示。 从图1 可以看出, 随着溶液酸度的增加相对误差呈先增加后减小的变化趋势。 主要原因是当加入的硫酸量过小时溶液呈碱性,而S2O32-与I2反应宜在中性或弱酸性环境中进行。 在碱性条件下S2O32-与I2之间的反应将按式(5)进行,导致硫代硫酸钠消耗单质碘的量低于预期反应,引起负误差。 而当硫酸加入量高于6.50 mL时溶液呈强酸性,使NaS2O3按式(6)发生分解,增加硫代硫酸钠的消耗量,从而引起正误差。

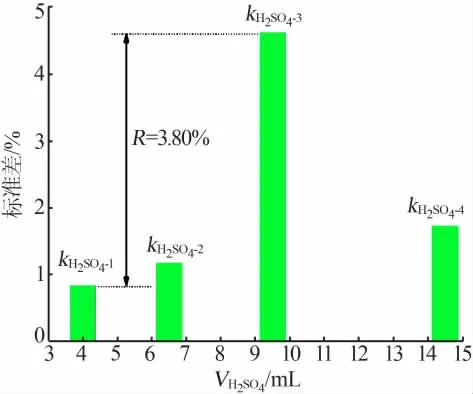
图1 酸度对滴定结果误差的影响
由以上分析可知, 当硫酸加入量为4.00 mL,即溶液酸度为0.06 mol/L 时相对误差最小,为最佳酸度滴定条件。 此外,结果显示极差值RH2SO4=3.80%,相对较高, 表明溶液酸度对碘量法测定硼氢根含量的滴定结果影响较为显著。
2.3 碘化钾加入量的影响
图2 为碘化钾加入量对滴定结果相对误差的影响。 从图2 可以看出,随着KI 加入量的增加相对误差呈先减小后增加的变化趋势。当KI 的加入量低于理论值0.1 mol 时,没有足够的I-与生成的I2结合成I3-,造成单质碘挥发引起滴定结果的正误差。 当KI的加入量为0.3 mol 时,溶液中I-浓度增加促进了KI与氧化剂之间的定量反应,同时过量的KI 可使反应生成的碘单质能够充分溶解在溶液中, 抑制了I2的挥发。 而当KI 的加入量大于0.3 mol 时会造成溶液中KI 浓度过高,不利于滴定过程中I2的释放,导致滴定终点滞后,引起较大正误差。 因此,KI 添加量为理论消耗量的3 倍时滴定结果的相对误差最小。此外,极差值RKI为0.80%,远低于RH2SO4,说明KI 加入量对滴定结果影响的显著程度明显弱于溶液酸度的影响。
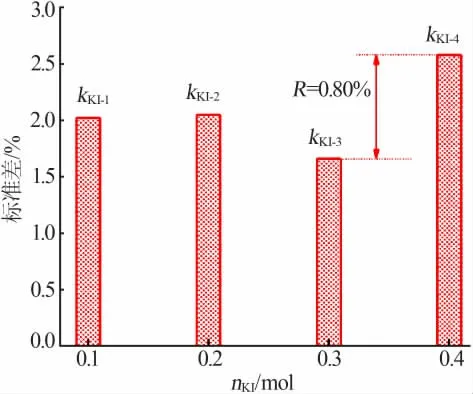
图2 碘化钾加入量对滴定结果误差的影响
2.4 指示剂加入量的影响
图3 为淀粉指示剂添加量对滴定结果相对误差的影响。从图3 可以看出,随着淀粉指示剂加入量的增加,相对误差呈先减小后增加的变化趋势。当淀粉指示剂添加量为0.5 mL 时,因指示剂加入量过少导致终点变色不明显。 而当指示剂加入量过高(高于4 mL)时也不利于滴定结果的准确性,引起误差的主要原因包括两个方面: 一是淀粉自身会反应消耗一定量的碘单质,按实际滴定过程中采用3.0 mL 1.0%淀粉作指示剂计算, 其消耗碘单质的量约为其质量的20%,导致指示剂灵敏度降低约300 倍,因此指示剂用量不宜过多; 另一方面由于支链淀粉和红糊精的存在会产生干扰色,使终点变色不明显。

图3 指示剂加入量对滴定结果误差的影响
2.5 水封暗放时间的影响
图4 为水封暗放时间对滴定结果相对误差的影响。 从图4 可以看出,当暗放时间为5~10 min 时滴定结果的相对偏差较小。 当放置时间少于5 min时,由于时间过短导致反应不完全, 且因酸碱反应放出的热量来不及冷却引起碘单质的挥发,造成滴定误差。 当放置时间为15 min 或更长时也不利于滴定结果的准确性。 因此,5~10 min 为碘量法滴定过程适宜的水封暗放时间。 此外,极差值R时间=0.57%,为4 个主要影响因素中的最小值, 说明水封暗放时间对滴定结果的影响相对较小。

图4 水封暗放时间对滴定结果误差的影响
2.6 其他因素的影响
2.6.1 硫代硫酸钠稳定性的影响
硫代硫酸钠因易风化、 潮解而无法直接配制成标准溶液。 为了获得浓度稳定的标准硫代硫酸钠溶液,配置过程中须将蒸馏水煮沸除去溶解的CO2,并加入少量Na2CO3保持溶液微碱性防止硫代硫酸钠在酸性条件下发生分解, 同时抑制蒸馏水中微生物与Na2S2O3发生作用。 引起硫代硫酸钠分解的因素主要包括以下3 个方面:
①与溶解氧的相互作用,见式(7):
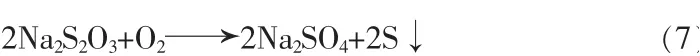
②与溶解二氧化碳的相互作用,见式(8):

③与微生物的相互作用,见式(9):
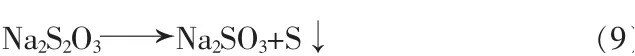
以上因素均为造成溶液中硫代硫酸钠浓度降低的主要原因。 此外,重金属离子、光照等因素也会引起硫代硫酸钠的分解, 其有效浓度会随放置时间的延长而发生缓慢变化。因此,硫代硫酸钠溶液在使用前须进行标定,且放置时间不宜过长。
2.6.2 淀粉指示剂加入时间的影响
淀粉指示剂加入的时间对于滴定终点的判断有着显著的影响,如指示剂加入时机不当,会对检测结果造成较大误差。 误差产生的原因主要是由于溶液中的直链型水溶性淀粉在其分子内部的氢键作用下使之发生弯曲形成螺旋状(见图5)[19-20],如过早加入淀粉指示剂则会造成I2分子进入淀粉分子螺旋结构的缝隙当中形成包合物,使I2分子发生一定程度的包裹而难以与硫代硫酸钠相互接触反应, 最终导致滴定终点延迟,测试结果出现正偏差。 因此,若想获得准确度高的检测结果, 淀粉指示剂的加入应选择在临近滴定终点前的时间。
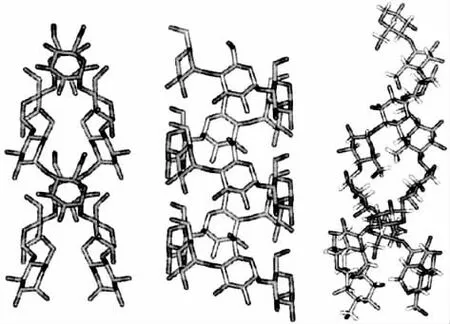
图5 淀粉分子的空间构象
2.7 优化条件实验
综合以上研究结果, 确定了碘量法测定溶液中硼氢化钠含量的最佳工艺条件: 酸度为0.06 mol/L,KI 用量为理论值的3 倍,淀粉指示剂加入量为2.0 mL,水封暗放时间为5~10 min。 根据极差数据分析结果确定了各因素对滴定结果影响的显著性顺序由大到小依次为:溶液酸度、指示剂加入量、KI 加入量、水封暗放时间。
基于以上结果, 在最佳滴定工艺条件下进行了硼氢化钠含量测定的优化实验, 共进行了5 组平行实验,结果示于图6。 从图6 可以看出,在最佳条件下滴定结果回收率较好,均接近100%,且准确度和重现性较高,标准偏差较小,均为0.3%左右。
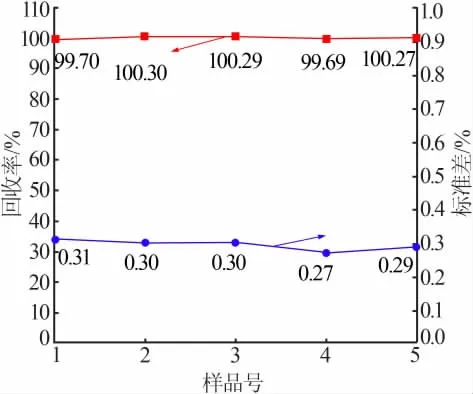
图6 最佳条件下滴定结果
3 结论
本工作采用碘量法测定溶液中硼氢化钠含量,考察了溶液酸度、 淀粉指示剂加入量、KI 加入量及水封暗放时间等因素对滴定结果的影响规律, 并明确了各因素对滴定结果影响的显著性顺序。 优化条件下的验证性实验结果表明滴定过程的回收率接近100%,标准偏差仅为0.3%左右,滴定结果具有较高的准确性和良好的重现性,是一种简单、快速、准确的测定溶液中硼氢根浓度的方法, 具有良好的工业化应用前景。

