能谱CT碘定量分析对不同亚型肾细胞癌的鉴别诊断
郝剑文 彭期臻 赵金坤 郑梅竹 曾潇 李滢 张雪宁
肾细胞癌(renal cell carcinoma,RCC)是肾脏最常见的原发恶性肿瘤,约占肾脏恶性肿瘤的90%。最常见为肾透明细胞癌(clear cell renal cell carcinoma,ccRCC),而非ccRCC中较常见肾乳头状癌(papillary renal cell carcinoma,pRCC)和肾嫌色细胞癌(chromophoberenal cell carcinoma,cRCC)[1-2]。肾癌的病理分型能够直接影响病人治疗方案的选择和预后情况,也是判断肾癌预后的独立因素[3]。能谱CT不仅能检出RCC病灶,还能根据组织间碘衰减的差异来提取有关肾脏组织成分的信息,进而分析RCC亚型。目前能谱CT已用于胸部、肾脏研究[4],但在RCC亚型鉴别中的报道较少。本文旨在研究能谱CT碘浓度定量参数对RCC亚型的鉴别诊断价值。
1 资料与方法
1.1 研究对象 回顾性分析2014年1月—2018年12月期间在天津医科大学肿瘤医院行根治性肾切除术并经病理证实的102例RCC病人资料,男64 例,女 38 例,年龄 29~82 岁,平均(57.10±14.63)岁。其中,ccRCC 75例,cRCC 15例,pRCC 12例。所有病例均为单侧肾单发肿瘤。其中,临床表现为肉眼血尿、腰痛者61例,出现晚期肾癌的血尿、腰痛和腹部肿块三联征者9例,无明显症状者32例。
1.2 设备与方法 采用GE Discovery 750 HD CT扫描设备,扫描范围自膈顶至髂前上棘,方向从头侧至尾侧。所有病人先行CT平扫,注射对比剂后再行 皮 质 期 (cortical phase,CP) 和 实 质 期(nephrographic phase,NP)双期动态增强扫描。 双肾平扫及NP增强扫描采用常规CT扫描模式,参数:管电压120 kV,管电流100 mA,螺距1.375,重建层厚及层间距均为1.25 mm;CP增强扫描采用宝石能谱扫描模式(GSI),参数:管电压 80 kV、140 kV 瞬时切换(0.5 ms),管电流 600 mA,螺距 1.375,重建层厚及层间距均为1.25 mm。增强检查采用非离子型对比剂碘海醇100 mL(含碘300 mg/mL),高压注射器经肘静脉注射,注射流率2.5 mL/s。分别于40 s和80 s后行双期扫描。能谱成像数据以混合能量模式(QC)重建为单能图像集。
1.3 影像重组与数据测量 在GE AW 4.5工作站上应用GSI Viewer软件进行图像处理及数据测量。CP图像经多平面重组为70 keV的单能量影像和碘-水基物质对影像。由2名不知病理结果的高年资(分别具有8年和10年工作经验)放射科医师采用盲法分别于CP影像上测量肿瘤最大径并勾画兴趣区(ROI):①肿瘤ROI勾画,包括尽量多的实性部分,选取范围较大、密度相对均匀的类圆形区域,避开血管、坏死、钙化;②腹主动脉ROI勾画,选取与肿瘤ROI同层面或头侧邻近层面的类圆形区域,面积约 80 mm2。记录各单能量(40~140 keV,间隔10 keV)水平下肿瘤和腹主动脉ROI的CT值和碘浓度值,取2名医师测量的平均值。计算肿瘤ROI相关参数,包括:①绝对强化CT值=强化CT值-平扫CT值;②相对强化CT值=绝对强化CT值/腹主动脉强化CT值;③碘浓度值;④标准化碘浓度(normalized iodine concentration,NIC)值,为肿瘤与腹主动脉碘浓度值的比值。
1.4 病理学分析 分析肿瘤病理分期及分级,其中难以确定者由2位高年资病理科医师协商达成一致。采用AJCC第7版TNM分期[5]进行病理分期:TX原发肿瘤无法评估;T0无原发肿瘤证据;T1肿瘤局限于肾脏,且最长径≤7 cm;T2肿瘤局限于肾脏,且最长径>7 cm;T3肿瘤侵犯大静脉或肾周组织,但未侵犯同侧肾上腺且未超过肾周筋膜;T4肿瘤侵犯范围超过肾周筋膜。NX区域淋巴结无法评估;N0无区域淋巴结转移;N1区域淋巴结转移。M0无远处转移;M1有远处转移。采用Fuhrman分级系统[6]进行病理分级:Ⅰ级,细胞核小,圆形,直径<10 μm,核仁不明显;Ⅱ级,细胞核稍大,略显不规则,直径<15 μm,核仁不明显;Ⅲ级,细胞核很不规则,直径<20 μm,可见大核仁;Ⅳ级,细胞核形状各异,核染色质呈凝块状,直径≥20 μm。
1.5 统计学方法 采用SPSS 24.0及MedCalc 15.0软件进行分析。符合正态分布的计量资料以均数±标准差(x±s)表示,2组间比较采用独立样本t检验。计数资料以例(%)表示,2组间比较采用χ2检验或Fisher确切概率法。采用受试者操作特征(ROC)曲线分析差异有统计学意义参数的诊断效能,计算ROC 曲线下面积(area under the curve,AUC)、最佳诊断阈值、敏感度和特异度。P<0.05表示差异有统计学意义。
2 结果
2.1 ccRCC与非ccRCC的病理学比较 2组肿瘤的最大径、组织学分级和病理学分期差异均无统计学意义(均 P>0.05),见表 1。

表1 ccRCC与非ccRCC肿瘤的病理学比较 个
2.2 ccRCC与非ccRCC的能谱CT参数比较及ROC曲线分析 ccRCC的绝对强化CT值、相对强化CT值、碘浓度值及NIC值 (图1)均高于非ccRCC(均 P<0.05),见表 2。 ROC 曲线分析显示,当NIC=0.35时鉴别ccRCC与非ccRCC的AUC最大(0.992)(图 2),诊断敏感度、特异度分别为 98.67%、92.59%,见表 3。
2.3 cRCC与pRCC的病理学比较 2组肿瘤的最大径、组织学分级和病理学分期差异无统计学意义(均 P<0.05),见表 4。
2.4 cRCC与pRCC的能谱CT参数比较及ROC曲线分析 pRCC的绝对强化CT值、相对强化CT值、碘浓度值及NIC值均高于cRCC(均P<0.05),见图3、4和表5。ROC曲线分析显示,当NIC=0.17时鉴别cRCC与pRCC 的 AUC 最大(0.978)(图 5),诊断敏感度、特异度分别为93.33%、91.67%,见表6。
3 讨论
3.1 能谱CT鉴别ccRCC和非ccRCC的价值 有研究显示,近20年在泌尿外科住院的肿瘤病人中RCC占比逐渐增多,随着彩超、CT等多种影像检查手段广泛应用,体检RCC检出率也由0.003%逐渐升至0.018%[7]。明确RCC分型有助于判断预后,决定治疗方式和手术范围。经典的TNM分期在判断RCC预后方面得到广泛应用,但对于RCC分型判断准确性不高;Furhman分级在判断ccRCC与pRCC间具有一定优势,但对其他RCC亚型评价能力不足,且易受取材部位及取材程度深浅的影响,有较高的误诊率。实际工作中常遇到ccRCC病人的影像表现不典型,如皮质期强化差异较小,或肿瘤实性部分血流灌注较少等,这些病人难与非ccRCC病人鉴别,从而影响影像诊断结果的准确性;此外,依靠强化程度等指标进行鉴别诊断主观性较强,易受对比剂注射速率及用量等影响。近年来,采用能谱CT检出RCC成为研究热点,但能谱CT参数能否判断RCC分型仍存在争议。因此,本研究分析了ccRCC与非ccRCC肿瘤的病理学分期及分级的差异,同时采用能谱CT碘定量参数对其进行分类。
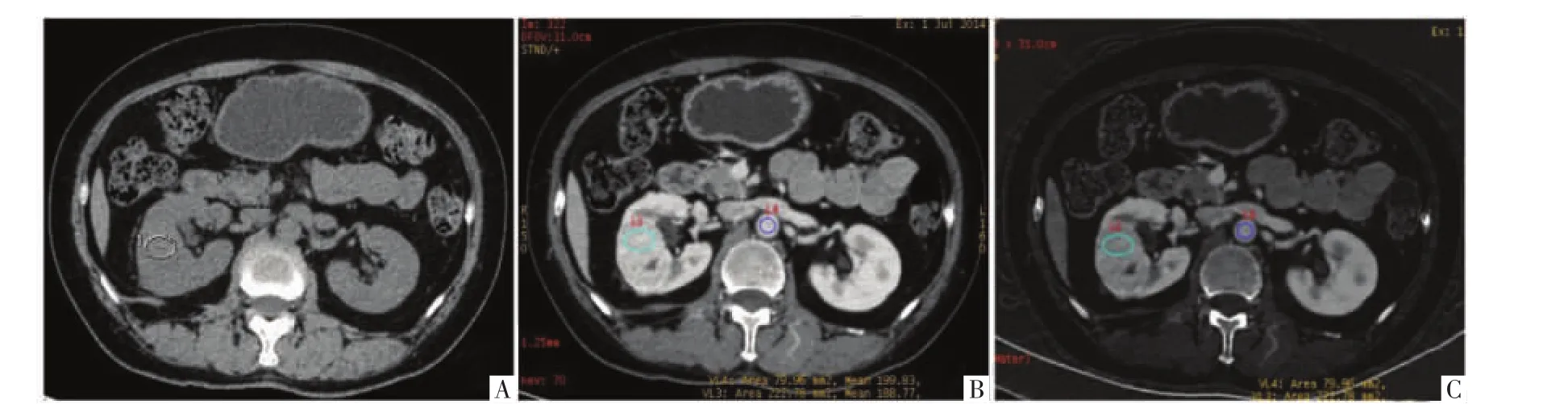
图1 病人男,50岁,右肾ccRCC。A图为CT平扫,可见右肾实性肿瘤,平扫CT值约41.01 HU。B图为70 keV单能量影像皮质期,肿块呈明显不均匀强化,肿块和腹主动脉的CT值分别为188.77、199.83 HU。C图为碘基图,肿块和腹主动脉碘浓度值约61.10、66.53 mg/mL。

表2 ccRCC与非ccRCC的能谱CT参数比较

图2 能谱CT参数诊断ccRCC与非ccRCC的ROC曲线
能谱CT可以进行碘定量分析,通过检测肿瘤组织中的碘浓度分布,从而间接反映肿瘤内微循环情况。当肾脏微血管受侵时,其血管通透性会进一步增加,使得碘元素富集于此。为防止单纯碘浓度值受到对比剂浓度、循环差异等多种因素影响,我们以腹主动脉碘浓度为基准,即可获得同时相的NIC值。能谱CT碘定量分析研究结果显示,皮质期ccRCC的绝对强化CT值、相对强化CT值、碘浓度

表3 能谱CT参数鉴别ccRCC和非ccRCC的ROC曲线分析

表4 cRCC和pRCC的病理学比较 个

图3 病人男,47岁,右肾cRCC。A图为CT平扫,可见右肾实性肿瘤,平扫CT值约34.43 HU。B图为70 keV单能量影像皮质期,肿块呈轻度强化,强化程度低于正常肾组织,70 keV时肿块和腹主动脉的CT值分别约58.28、271.65HU。C图为碘基图,肿块和腹主动脉碘浓度值约13.99、92.84 mg/mL。
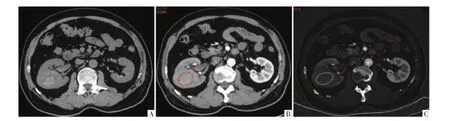
图4 病人女,60岁,右肾pRCC。A图为CT平扫,可见右肾实性肿瘤,平扫CT值约59.81HU。B图为70 keV单能量影像皮质期,肿块呈轻中度强化,肿块和腹主动脉的CT值分别约74.99、306.30 HU。C图为碘基图,肿块和腹主动脉碘浓度值约11.21、105.45 mg/mL。
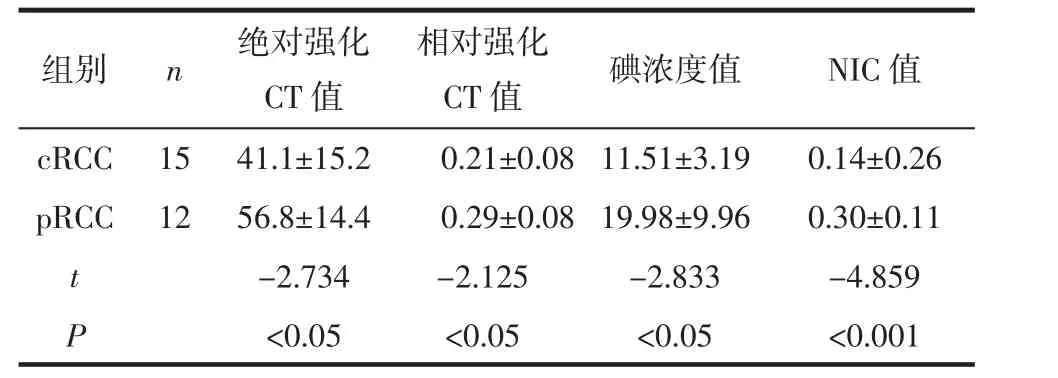
表5 cRCC与pRCC的能谱CT参数比较
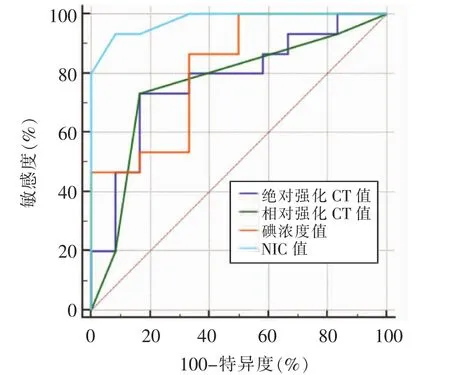
图5 能谱CT参数诊断cRCC与pRCC的ROC曲线

表6 能谱CT参数鉴别cRCC和pRCC的ROC曲线分析
和NIC值均明显高于非ccRCC(P<0.05),说明皮质期ccRCC碘摄取量更高,这与Bray等[8]的研究结果一致。而陆等[9]发现双源CT检测ccRCC病人碘浓度值及NIC值都高于非ccRCC病人,也与本研究结果类似。进一步分析原因,可能是由于ccRCC内肿瘤新生血管和小泡状结构丰富,而非ccRCC内血管往往偏少。由此可见,碘定量分析技术有助于鉴别ccRCC与非ccRCC。ROC曲线分析显示NIC的诊断效能要优于单纯碘浓度的诊断效能,当NIC临界值取 0.35时,其敏感度(98.67%)、特异度(92.59%)最高。因此,采用NIC值判断ccRCC与非ccRCC的分类具有较高的临床价值。
3.2 能谱CT鉴别cRCC和pRCC的价值 2016年世界卫生组织对肾脏肿瘤的分类中,综合肾脏肿瘤流行病学特征、病理学特征以及遗传基因进行修订,在以往RCC分类的基础上纳入了6种新的RCC组织学亚型[10],其中ccRCC依然是最常见的RCC分型,约占80%,而cRCC和pRCC是肾脏肿瘤分类中的另外2个独立分型。ccRCC主要起源于近端肾小管或集合管的上皮细胞,肿瘤血供丰富,常伴出血、坏死及囊变表现,异质性强,恶性程度高,预后较差,5年生存率不到50%[11]。cRCC主要为乏血供肿瘤,出血、坏死及囊变表现相对少见,大部分呈膨胀性生长,边界清晰,多为“慢进慢出”强化方式,恶性程度较低,生长缓慢,是预后最为良好的肾癌亚型之一。pRCC起源于肾近曲小管或远曲小管的上皮细胞,常由肿瘤细胞构成不同的小管和乳头状结构,亦可见出血、坏死和囊变。pRCC主要为乏血供肿瘤,因此增强时对比剂进入迟缓,在肿瘤内也需要更长的时间扩散,故强化程度不及ccRCC[12]。本研究病理学结果显示,cRCC和pRCC的肿瘤最大径以及分级分期方面未见明显差异。这是由于经典的TNM分期易受观察者主观判断影响,且Fuhrman分级选区分布极易不均匀,有可能获得错误、片面的信息,而肿瘤内部本身存在异质性,仅靠部分病理学表现不能全面评价病变。刘等[13]的研究结果显示,多层螺旋CT对cRCC和pRCC的诊断效能不高。故本研究选择能谱CT碘定量技术对两者进行鉴别,pRCC的多项碘定量参数均高于cRCC,推测这可能与cRCC微血管密度更低,导致对比剂进入病灶及扩散速度较慢,碘摄取量减少有关;另外,pRCC的泡沫细胞、砂粒体及肿瘤细胞对含铁血黄素的吞噬作用可能也会对碘定量结果产生一定的影响。ROC曲线分析证明NIC的诊断效能要优于单纯碘浓度。当NIC临界值取0.17时,其敏感度(93.33%)、特异度 (91.67%)进一步提示利用NIC值对cRCC和pRCC两者进行鉴别具有一定的研究意义。
3.3 本研究不足 本研究纳入的cRCC和pRCC病例数均较少,统计结果的代表性相对不足,有待于进一步加大样本量。另外,此次没有将Ⅰ型和Ⅱ型pRCC进行细致的分类分析。今后随着样本例数的继续积累和更详实的分类讨论,我们将进一步对RCC分型作出更详细的分析,以提高对其鉴别诊断的准确性。

