LncRNA LUCAT1 在胰腺癌组织中的表达及其临床意义*
曹 维,朱 净,周国雄
(南通大学附属医院消化内科,江苏226001)
胰腺癌是高度侵袭性恶性肿瘤,超过80%胰腺癌在确诊时已是局部晚期或转移期[1],5 年生存率仅3%[2],中位生存时间 3~5 个月[3]。只有 10%~15%胰腺癌有机会手术切除[4],但术后复发率高达75%~92%[5-6]。因此,发现有效的生物学标记对提高胰腺癌的诊断和治疗具有重要意义。
肺癌相关转录本1(lung cancer transcript 1,LUCAT1)是因为其通过抑制p21 和p57 表达促进非小细胞肺癌细胞增殖被首次发现而得名[7],随后在膀胱癌、卵巢癌、非小细胞肺癌及肾透明细胞癌[8-9]等多种肿瘤中发现长链非编码RNA(LncRNA)LUCAT1的异常表达。本研究选取2012—2019 年我院普外经手术切除的80 例胰腺癌组织及其配对癌旁组织,分析胰腺癌组织LncRNA LUCAT1 的表达及其与临床病理参数的关系,探讨LncRNA LUCAT1 在胰腺癌发生、发展中的作用。
1 材料与方法
1.1 材料 手术切除、病理证实的80 例胰腺癌组织及其配对癌旁组织,置液氮罐冻存。Trizol 试剂盒(美国 Invitrogen 公司),反转录试剂盒、MixPCR 扩增试剂盒(Fermentas 公司)。PCR 引物采用Primer5.0软件设计,由Invitrogen(上海)公司合成。
1.2 方法
1.2.1 RNA 抽提:将组织剪成小碎块,放入研钵中加入液氮迅速反复研磨。取100 mg 组织加入1 mL Trizol 后转移至1.5 mL 无RNA 酶EP 管中。电动匀浆器充分匀浆1~2 min,室温静置5 min,12 000 r/min离心5 min,加入200 mL 氯仿充分混匀振荡后,12 000 r/min,4 ℃离心 5 min。吸取 400 μL 上层包含 RNA的水相,转移至新的EP 管中,加入500 μL 异丙醇充分混匀,于-20 ℃冰箱静置1h 以增加沉淀。1 2000 r/min,4 ℃离心15 min,弃上清保留沉淀,继续加入4 ℃预冷的75%无水乙醇1 mL,混匀后再次7 500 r/min,4 ℃离心5 min。 重复一次乙醇洗脱步骤,尽可能弃净上清。通风橱干燥5~10 min,待管壁乙醇完全挥发后加入25 μL DEPC 水,充分溶解管底RNA。
1.2.2 逆转录:取总 RNA 1 μg,5×PrimerScript RT Master Mix 4 μL,RNase Free dH2O 补充至总体积20 μL,设置逆转录条件:37 ℃ 15 min,85 ℃ 5 sec,4 ℃维持。
1.2.3 实时荧光定量PCR 检测:设计F 和R 引物,LncRNA-LUCAT1_F:GTGTCAAGCTCGGATTGCCT;R:GAGCCCACACACTCAGGTTC;GAPDH_F:CTGG GCTACACTGAGCACC;R:AAGTGGTCGTTGAGGG CAATG。SYBR-Green PCR Master mix 试剂盒中取SYBR Premix 12.5μL,Primer F 和 R(10 μmol/L)各1 μL,cDNA 2 μL×2,dH2O 8.5 μL,在 LightCycler 96 PCR 仪上,根据说明书设PCR 扩增的标准程序:预变性 95 ℃ 30 sec,PCR 反应 95 ℃ 5 sec,60 ℃ 30 sec,40 个循环,解离分析。GAPDH 作为参量,用2-ΔCT分析算得基因的相对表达量。
1.3 统计学处理 应用SPSS 22.0 统计学软件处理分析数据。等级资料组间比较采用秩和检验,分类变量资料组间比较采用χ2检验或Fisher 精确概率法。P<0.05 为差异有统计学意义。
2 结 果
胰腺癌组织中LncRNA LUCAT1 表达量高于配对的癌旁组织,差异有统计学意义(P<0.05),见图1。有淋巴结转移、病理分期Ⅱ期以上以及有血管侵犯的胰腺癌组织中LncRNA LUCAT1 阳性表达率分别高于无淋巴结转移、病理分期为Ⅰ期以及无血管侵犯的胰腺癌组织,差异均有统计学意义(P<0.05),LncRNA LUCAT1 阳性表达率与患者性别、年龄、肿瘤部位、肿瘤大小及肿瘤分化程度无关(P>0.05)。见表1。
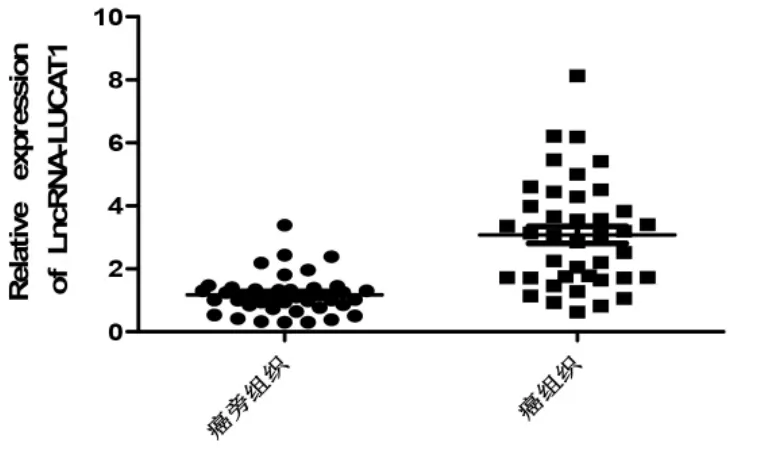
图1 胰腺癌组织与癌旁组织LUCAT1 表达

表1 LUCAT1 表达与临床病理参数关系 例(%)
3 讨 论
LncRNA 是一类长度大于200 个核苷酸的非编码RNA[10],与DNA、RNA 和转录因子相互作用调控DNA 甲基化、组蛋白修饰及染色质重塑等多个生物学过程[11],可影响控制细胞周期、血管生成,促进转录基因的表达[12]。在多种人类肿瘤中发现LncRNA表达的改变[13],如卵巢癌细胞中LncRNA MALAT1表达与肿瘤大小、临床分期、转移及生存期相关[14];非小细胞肺癌中LncRNA PRNCR1 高表达促进细胞内皮-间质转型(EMT),加速细胞迁移及侵袭进程。内源性的LncRNA DUXAP8 可以促进胰腺癌的增殖[15];LncRNA SUMOP13 高表达促进胰腺癌的迁移、侵袭以及EMT 进程,提示LncRNA 在胰腺癌的发病中发挥重要作用[16],它可能作为评判胰腺癌早期诊断、治疗和预后的生物学标记物[17]。
microRNA 作为小分子的非编码RNA,通过转录后调控的方式调节基因的表达,在肿瘤病理生理机制中发挥重要作用[18]。近年来研究发现,LncRNA与microRNA 相互作用形成在转录后水平调控基因的错综复杂的网络[19],LncRNA 竞争性结合microRNA 与mRNA 的结合位点,抑制microRNA 与其它转录本的“分子海绵”或“分子诱饵”[20-21]。乳腺癌中miR-217 与LncRNA HOTAIR 结合,促进卵巢癌恶性增殖[22]。在肝癌中LncRNA linc00974 通过与miR-642 的相互作用调节KRT19 表达,并进一步影响NOTCH 和 TGF-β 信号通路[23],从而更加证实LncRNA 与microRNA 的结合在肿瘤恶性增殖中发挥着重要作用。已有研究结果显示,miR-642 在前列腺癌、肝癌及膀胱癌[24]中发挥重要作用,胰腺癌miR-642 的表达与Ki67 表达相关[25]。本研究结果显示,胰腺癌组织中LncRNA LUCAT1 表达量高于癌旁组织,有淋巴结转移、病理分期Ⅱ期以上以及有血管侵犯的胰腺癌组织中LncRNA LUCAT1 阳性表达率增高,推测胰腺癌中LncRNA LUCAT1 可能通过竞争性结合miR-642 促进癌细胞的恶性增殖。

