大孔树脂-聚酰胺分离纯化红树莓籽低聚原花青素及其体外模拟胃、肠消化
纪秀凤 芦 宇 刘海春 赵倩华 王维民 王贵虹 励建荣 吕长鑫*
(1 渤海大学食品科学与工程学院 生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心辽宁锦州121013 2 河北省科技工程学校 河北保定071000 3 大连中超食品有限公司 辽宁大连116400 4 辽宁新大地实业发展集团有限公司 沈阳110168)
红树莓属蔷薇科(Rasaceae)悬钩子属(Rubus L.)多年生灌木植物,又称覆盆子、托盘和马林等,在我国辽宁、吉林和黑龙江等地区广泛种植,果实酸甜可口,富含原花青素、黄酮和鞣花酸等物质,具有抗氧化、抗衰老和抗癌等功效,被誉为“生命之果”[1-2]。 红树莓鲜果不耐贮藏,多被加工成果酒和果汁等产品, 而红树莓籽作为加工副产物尚未得到有效利用[3]。原花青素是红树莓籽中的主要活性物质。原花青素聚合度不同,被人体吸收利用的情况亦不相同, 将聚合度在2~4 间的原花青素称为低聚原花青素, 聚合度高于4 的称为高聚原花青素[4]。 低聚体生物活性远高于高聚体,通过不同浓度乙醇梯度洗脱吸附原花青素的大孔树脂,可实现高聚及低聚原花青素的分离, 同时提高了其纯度,相对于有机溶剂的分离萃取,具有成本低、易再生和无毒害等优点[5-6]。 聚酰胺是一类酰胺基聚合成的高分子化合物[7],对原花青素吸附性强,具有吸附快、 分离效果好及纯化纯度高等优点[8]。大孔树脂和聚酰胺联用, 既实现了原花青素分级分离,又较大程度地提高了其纯度。 由于体外胃、肠消化模型比较接近于人体真实生理消化情况[9],因此,可基于体外模拟胃、肠消化过程中不同聚合度原花青素释放规律, 评价不同聚合度原花青素在人体内的生物活性变化情况。
本研究首先通过不同浓度解吸剂梯度洗脱吸附红树莓籽原花青素的大孔树脂层析柱, 实现原花青素高聚体和低聚体的分离。其次,通过聚酰胺树脂二次纯化大孔树脂分离的红树莓籽低聚原花青素,确定纯化工艺参数,为红树莓籽低聚原花青素提供更高效的纯化方法。 最后,构建体外胃、肠消化模型, 考察不同聚合度红树莓籽原花青素体外胃、肠消化前、后释放量的变化情况,为红树莓籽低聚原花青素的高效利用提供理论依据。
1 材料与方法
1.1 材料与试剂
红树莓籽,大连市中超食品有限公司;儿茶素标准品(≥98%),如吉生物科技公司;胃蛋白酶、胰蛋白酶,Sigma 公司;柱层析聚酰胺树脂(30~60目)、大孔吸附树脂,郑州勤实科技有限公司;无水乙醇、冰乙酸、甲醇、石油醚,天津市天力化学试剂有限公司;香草醛、氢氧化钠,天津市大茂化学试剂厂;盐酸,锦州古城化学试剂有限公司;以上试剂均为分析纯。
1.2 仪器与设备
Centrifuge5804R 冷冻离心机, 德国艾本德股份公司;UV-2700 紫外-可见分光光度计,日本岛津有限公司;GT-100 高通量组织研磨仪, 北京格瑞德曼仪器设备有限公司;SHB-D 循环水真空泵,上海申光仪器仪表有限公司;KQ-100DB 数控超声波清洗器, 江苏昆山市超声仪器有限公司;SHA-2 冷冻水浴恒振荡器, 金坛市瑞华仪器有限公司。
1.3 试验方法
1.3.1 红树莓籽原花青素提取 红树莓籽干燥、除杂、粉碎、过筛后,在料液比1∶10 g/mL、温度40℃的条件下采用石油醚脱脂4 h,抽滤取粉。 红树莓籽脱脂粉在料液比1 ∶15 g/mL、 乙醇体积分数80%、提取时间1 h 的条件下提取红树莓籽原花青素,将原花青素醇提物在55 ℃下旋蒸除醇,冷冻干燥成粉备用。
1.3.2 原花青素质量标准曲线 称取儿茶素标准品5 mg,甲醇定容至25 mL,分别移取0,0.2,0.4,0.6,0.8,1.0 mL 儿茶素标准品溶液于试管中,加入甲醇分别定容至1 mL, 各加入5 mg/mL 香草醛-甲醇溶液6 mL 和浓盐酸3 mL,摇匀,于30 ℃水浴避光1 h。以甲醇为空白,测定500 nm 处吸光值[10-12],以儿茶素质量浓度(μg/mL)为横坐标,吸光值为纵坐标,绘制的标准曲线为y=0.0012x-0.0028,R2=0.9993。
1.3.3 原花青素物质的量标准曲线 称取儿茶素标准品2.5 mg,冰乙酸定容至25 mL,分别移取以上溶液0,0.2,0.4,0.6,0.8,1.0 mL 于试管中,冰乙酸分别定容至1 mL, 各加入5 mg/mL 香草醛-乙酸溶液6 mL 和浓盐酸3 mL,30 ℃水浴避光反应1 h,以冰乙酸为空白,测定500 nm 处吸光值[11-12],以儿茶素浓度(μmol/mL)为横坐标,吸光值为纵坐标,绘制的标准曲线为:y=2.4899x-0.0063,R2=0.9995。
1.3.4 原花青素平均聚合度测定 大孔树脂梯度洗脱得到的不同聚合度原花青素粉配置成1 mg/mL 样液,采用1.3.2 节和1.3.3 节方法得到原花青素质量及物质的量,计算原花青素平均聚合度[13],见公式(1)。

式中:m——原花青素质量/μg;M——儿茶素相对分子质量,290.27;n——原花青素物质的量/μmol。
1.3.5 大孔树脂预处理 将大孔树脂于95%乙醇中浸泡24 h,蒸馏水冲洗至无醇味且洗脱液透明;再于4%盐酸溶液中浸泡12 h 后洗至中性; 最后于4%氢氧化钠溶液中浸泡12 h 后洗至中性,45℃烘干备用[14]。
1.3.6 聚酰胺预处理与再生 将聚酰胺树脂于95%乙醇中溶胀24 h, 蒸馏水洗至无醇味; 再于5%氢氧化钠溶液中浸泡12 h 后洗至中性;最后于10%醋酸溶液中浸泡12 h 后洗至中性,45 ℃烘干备用[15]。
1.3.7 红树莓籽原花青素分级纯化 实验室前期研究大孔树脂纯化条件为:树脂20 mg,上样质量浓度4 mg/mL,pH 4.0, 上样及解吸流速1.5 mL/min,上样及解吸剂体积80 mL。此条件下经30%,40%,50%,60%和70%乙醇溶液梯度洗脱, 分别收集洗脱组分测定解吸率及平均聚合度, 确定低聚及高聚原花青素洗脱条件。
1.3.8 聚酰胺动态吸附与解吸试验 量取10 g处理后的聚酰胺树脂湿法装柱 (Φ18 mm×300 mm), 以大孔树脂分离纯化得到的红树莓籽低聚原花青素洗脱液为上样液, 通过聚酰胺层析柱进行吸附,以吸附率为指标,分别考察上样质量浓度(0.5, 1.0, 1.5, 2.0, 2.5 mg/mL)、pH (2, 3, 4, 5,6)、流速(0.5,1.0,1.5,2.0,2.5 mL/min)对红树莓籽低聚原花青素吸附效果的影响。同时,在上述最佳吸附条件下,每10 mL 收集一组流分,测定低聚原花青素浓度,绘制泄露曲线,确定上样液体积。在上述最佳吸附条件下,聚酰胺树脂吸附饱和后,经蒸馏水洗至流出液澄清,以解吸率为指标,分别考察乙醇体积分数(40%,50%,60%,70%,80%)和解吸流速(0.5, 1.0, 1.5, 2.0, 2.5 mL/min)对低聚原花青素解吸效果的影响;此外,每10 mL 收集一组流出液,测定低聚原花青素质量浓度,绘制动态洗脱曲线,从而确定最佳洗脱液体积。
1.3.9 吸附率与解吸率的计算 分别测定上样液、 吸附液和洗脱液中红树莓籽低聚原花青素的质量浓度,计算吸附率和解吸率,其公式如(2)和(3)所示:
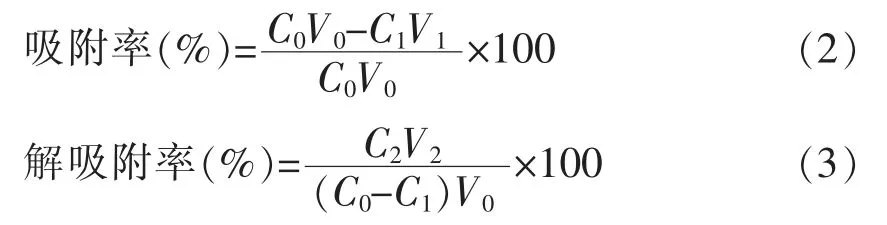
式 中:C0——上样液质量浓度/mg·mL-1;C1——流出液质量浓度/mg·mL-1;C2——解吸液质量浓度/mg·mL-1;V0——上样液体积/mL;V1——流出液体积/mL;V2——洗脱液体积/mL。
1.3.10 纯度的计算 分别称取0.025 mg 经大孔树脂和聚酰胺树脂洗脱的红树莓籽低聚原花青素,加入95%乙醇定容至25 mL,用1.3.1 节方法测定溶液中低聚原花青素的质量浓度, 样品低聚原花青素纯度计算见公式(4):

式中:C——低聚原花青素溶液质量浓度/mg·mL-1;V——低聚原花青素溶液体积/mL;M——低聚原花青素质量/mg。
1.3.11 体外胃肠模拟消化试验
1.3.11.1 胃消化对原花青素释放量影响 准确称取0.25 g 红树莓籽低聚原花青素和高聚原花青素,分别加入10 mL 生理盐水混匀后,加入4 mL 0.1 mol/L 的盐酸溶液和4 mL 8 mg/mL 的胃蛋白酶溶液,调pH 至2.0。 同时,以生理盐水替代酶液做2 组空白对照,于37 ℃恒温水浴振荡器分别消化0.0, 0.5, 1.0, 1.5, 2.0 和2.5 h,在4 ℃,8 000 r/min 条件下离心10 min,取上清液测定红树莓籽原花青素质量浓度[16-17],确定原花青素释放量。
1.3.11.2 肠消化对原花青素影响 分别向体外胃消化2.5 h 的样液中加入1 mol/L 的NaHCO3调至pH 为7.0,加入6 mL 肠消化液(0.3 g 胰酶和1.9 g 猪胆汁溶于60 mL pH 为7.0 的0.1 mol/L NaHCO3-Na2CO3缓冲溶液),同时做肠液空白对照组 (pH 7.0 的0.1 mol/L NaHCO3-Na2CO3缓冲溶液), 于37 ℃恒温水浴振荡器中分别消化0.0,0.5, 1.0, 1.5, 2.0, 2.5 和3.0 h, 在4 ℃,8 000 r/min 条件下离心10 min, 以肠电解液替代肠消化液溶液作为空白, 取上清液测定其红树莓籽原花青素质量浓度[18],确定原花青素释放量。
2 结果与分析
2.1 红树莓籽原花青素分级结果分析
由图1 可知, 经30%乙醇和40%乙醇梯度洗脱的红树莓籽原花青素解吸率显著增加(P<0.05),平均聚合度略有增加,但无显著性差异(P>0.05),40%乙醇洗脱时解吸率最高,且平均聚合度小于4,说明40%乙醇洗脱物为低聚原花青素;此后随乙醇浓度增大, 梯度洗脱下的原花青素解吸率显著降低(P<0.05),平均聚合度显著升高(P<0.05),且均高于4,即为高聚体。 原花青素平均聚合度增大,其极性随之增强,大孔树脂对其吸附能力也逐渐增强, 故需高浓度乙醇才可解吸下高聚原花青素[4];其次,30%及40%乙醇洗脱的低聚体原花青素总解吸率约为48%,而再经50%及60%乙醇洗脱的高聚体总解吸率约为40%, 故将红树莓籽低聚和高聚原花青素进行分离具有一定必要性。综上分析,选用40%乙醇洗脱得到低聚原花青素,再经60%乙醇洗脱得到高聚原花青素,此高聚原花青素经聚酰胺纯化后, 为低聚原花青素的体外胃肠模拟消化试验作对照。

图1 不同洗脱液中原花青素的解吸率和平均聚合度Fig.1 The average polymerization degree and desorption rate of proanthocyanidins from different proanthocyanidins eluent
2.2 聚酰胺动态吸附与解吸结果分析
2.2.1 上样浓度对吸附效果影响分析 由图2 可知,上样质量浓度低于2 mg/mL 时,吸附率随红树莓籽低聚原花青素上样质量浓度的增加而升高,由于上样液低聚原花青素质量浓度升高, 单位表面积的低聚原花青素与聚酰胺树脂接触量增多,吸附量随之增大[19]。但上样质量浓度为1.0 和1.5 mg/mL 时,吸附率变化不显著(P>0.05);上样质量浓度高于2 mg/mL 后,吸附率显著下降(P<0.05),是因为上样质量浓度过大, 低聚原花青素在聚酰胺树脂中扩散能力下降, 与杂质竞争性吸附聚酰胺树脂,低聚原花青素得不到充分吸附,造成原料浪费[20],故选用2 mg/mL 为最适上样质量浓度。
2.2.2 上样液pH 对吸附效果影响分析 由图3可知,pH 值在2~5 范围内,随pH 升高,红树莓籽低聚原花青素吸附率显著增加(P<0.05),pH 为5时,吸附率最高,随后吸附率显著下降(P<0.05)。红树莓籽低聚原花青素分子中含有多个酚羟基,呈弱酸性, 聚酰胺分子通过氢键与低聚原花青素结合,故易在酸性环境中被吸附。随低聚原花青素溶液pH 增大,酚羟基中氢离子易解离,分子极性变大,亲水性增强,不易被树脂吸附[21],故选择上样液最适pH 为5。
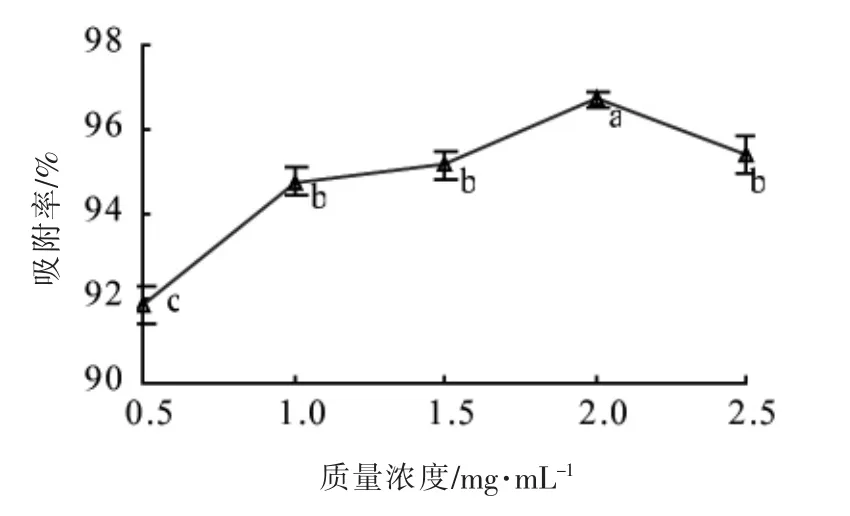
图2 上样质量浓度对吸附效果影响Fig.2 Effect of concentration in sample on the adsorption efficiency
2.2.3 上样液流速对吸附效果影响分析 由图4可知,上样流速在0.5~1.5 mL/min 范围内,随着上样流速的增加,吸附率逐渐升高,但上样流速在0.5~1.0 mL/min 范围内变化不显著(P>0.05);上样流速高于1.5 mL/min 后,吸附率显著下降(P<0.05),是因为流速过大,节约了上样时间,提高了效率, 但样液中低聚原花青素与树脂接触不够充分,引起样液流失,导致吸附量下降。 故选用最佳上样流速为1.5 mL/min。

图3 上样液pH 对吸附效果影响Fig. 3 Effect of pH in sample on the adsorption efficiency
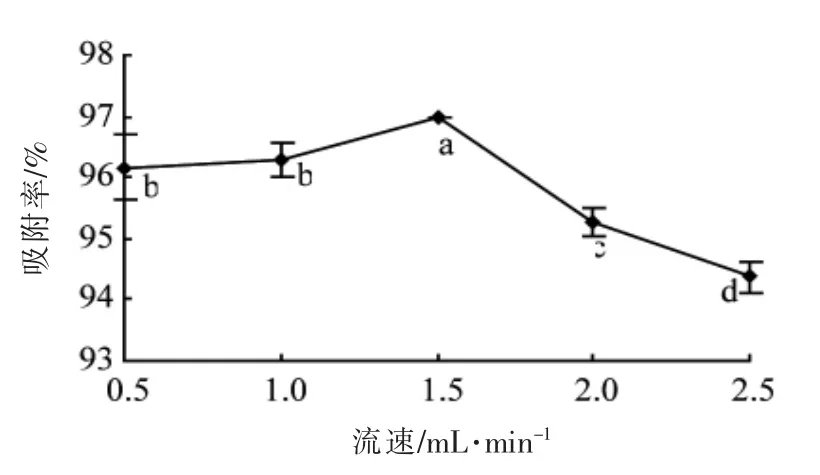
图4 上样液流速对吸附效果影响Fig.4 Effect of sample flow rate on the adsorption efficiency
2.2.4 泄露曲线 由图5 可知, 当流出液在10~120 mL 范围内,流出液中红树莓籽低聚原花青素质量浓度逐渐升高。流出液体积增加到40 mL 后,原花青素质量浓度变化趋于平缓, 当流出液体积达到100 mL 时,流出液的低聚原花青素浓度达到上样液的1/10, 此时聚酰胺树脂吸附基本达到饱和,故将100 mL 作为泄漏点[22],选用最佳上样体积为100 mL。
2.2.5 解吸剂体积分数对解吸效果影响分析 选择乙醇作为红树莓籽低聚原花青素的解吸剂,由图6 可知,当乙醇体积分数低于70%时,随乙醇体积分数增加,低聚原花青素解吸率显著升高(P<0.05),可能是由于乙醇为极性溶剂,随其浓度增大,溶液极性增强,进而对低聚原花青素作用力加强,解吸率升高;当乙醇体积分数高于70%后,解吸率变化无显著性差异(P>0.05),是因样液中其它水溶性杂质也被洗脱下来, 降低了低聚原花青素浓度。 故选用最适乙醇体积分数为70%。
2.2.6 解吸流速对解吸效果影响分析 如图7 所示, 解吸流速对红树莓籽低聚原花青素解吸效果影响较大。 流速在0.5~1.5 mL/min 范围内时,随流速增大低聚原花青素解吸率显著增加 (P<0.05);流速高于1.5 mL/min 时,解吸率显著减小(P<0.05)。 适当增大解吸流速时,生产效率将大幅度提高,但当解吸流速过高时,解吸剂与聚酰胺树脂作用时间较短,对低聚原花青素解吸不够充分,解吸率降低[23]。 故选取最适解吸流速为1.5 mL/min。
2.2.7 洗脱曲线 聚酰胺纯化红树莓籽低聚原花青素洗脱曲线如图8 所示, 当洗脱液体积达50 mL 时, 洗脱的低聚原花青素质量浓度达到最大,随后每组流分洗脱下的低聚原花青素质量浓度逐渐降低,当洗脱液体积达到150 mL 时,低聚原花青素质量浓度几乎不再发生变化, 聚酰胺树脂吸附的低聚原花青素几乎完全被洗脱下, 随后流出液中虽仍含少量低聚原花青素,但考虑后期处理,提高纯化效率,选择放弃剩余洗脱液,故选取150 mL 为洗脱液体积。

图5 泄露曲线Fig.5 Leakage curve

图6 解吸剂体积分数对解吸效果影响Fig.6 Effect of desorption agent concentration on the desorption efficiency
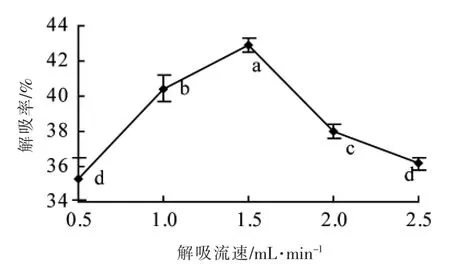
图7 解吸流速对解吸效果影响Fig.7 Effect of desorption rate on the desorption efficiency

图8 洗脱曲线Fig.8 Desorption curve
2.3 低聚原花青素纯度测定结果分析
经大孔树脂和聚酰胺纯化的红树莓籽低聚原花青素纯度分别为(52.36±0.42)%和(71.09±0.29)%, 经聚酰胺纯化后纯度提高了18.73%,说明经大孔树脂洗脱的低聚原花青素再经聚酰胺二次纯化,可有效提高红树莓籽低聚原花青素纯度。
2.4 体外胃肠消化模拟对原花青素释放量影响分析
2.4.1 模拟胃消化对原花青素释放量影响分析体外模拟胃消化过程中原花青素释放量变化情况如图9 所示,消化0~2.0 h 内,低聚原花青素释放量显著增加(P<0.05),随后趋于平缓;消化0~1.0 h 内,高聚原花青素释放量显著增加(P<0.05),随之趋于平缓。 在胃消化条件下的低聚和高聚原花青素释放量均高于不加胃蛋白酶的对照组, 说明在强酸性环境下, 胃蛋白酶促进了原花青素的释放, 是因为在较低的pH 值下蛋白质易被胃蛋白酶水解, 使得与蛋白质结合的原花青素被释放出来[18]。 原花青素释放量大小依次为:低聚原花青素胃液消化组>低聚原花青素对照组>高聚原花青素胃液消化组>高聚原花青素对照组。 因此,低聚原花青素比高聚原花青素在胃消化条件下更易被释放,进而被人体吸收。
2.4.2 模拟肠消化对原花青素释放量影响分析体外模拟肠消化过程中原花青素释放量变化情况如图10 所示。消化0~2.5 h 内,肠消化组和对照组的低聚和高聚原花青素释放量均显著升高 (P<0.05),随后趋于平稳,差异不显著(P>0.05)。并且,两对照组释放量均低于两消化组, 说明在肠消化环境中胰酶和胆汁可水解原花青素与细胞内外蛋白质或多糖形成的酯键, 进而促进原花青素的释放[24]。 红树莓籽低聚原花青素释放量远高于高聚原花青素, 说明在肠消化环境下低聚原花青素更易被释放,进而在人体内发挥更高的生理活性。

图9 模拟胃消化过程中原花青素释放量的变化Fig.9 Changes in proanthocyanidins of red raspberry seeds during simulated gastric digestion
3 结论
HPD100 大孔树脂将红树莓籽原花青素粗提物吸附饱和后, 通过不同体积分数的乙醇对其梯度洗脱,实现了原花青素分级分离,最终确定40%乙醇洗脱得到低聚原花青素, 再经60%乙醇洗脱得到高聚原花青素。通过动态吸附及解吸试验,确定聚酰胺层析树脂对红树莓籽低聚原花青素二次纯化的最适工艺参数为: 上样液质量浓度2 mg/mL、上样流速1.5 mL/min、上样液体积100 mL;解吸剂乙醇体积分数70%、解吸流速1.5 mL/min、解吸剂体积150 mL。 此条件下低聚原花青素纯度由52.36%提高到71.09%,说明聚酰胺二次纯化红树莓籽低聚原花青素可达到较好的纯化目的。
模拟胃消化0~2.5 h 和肠消化0~3.0 h, 低聚和高聚原花青素释放量逐渐升高至14.23,5.02 mg/g 和27.79,12.62 mg/g,表明胃蛋白酶、胰酶和胆汁可促进低聚及高聚原花青素的释放。 低聚原花青素在消化中释放量均远高于高聚原花青素,说明低聚原花青素更利于释放, 便于进一步在人体内实现生理活性。
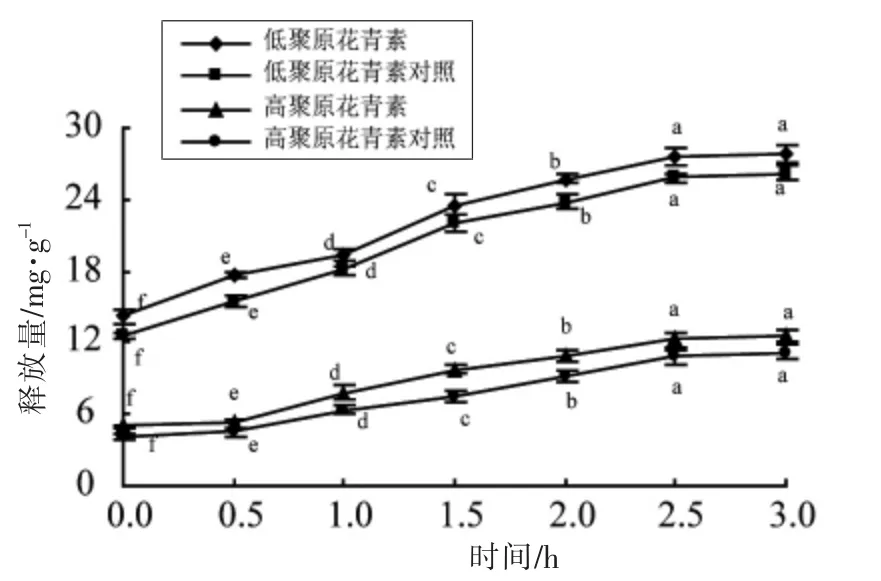
图10 模拟肠消化过程中原花青素释放量的变化Fig.10 Changes in proanthocyanidins of red raspberry seeds during simulated intestinal digestion
——树莓

