Ⅰ型干扰素受体缺失小鼠体外受精实验研究
张帆,安学芳,赵赫,李丽,肖宇宙
(中国科学院武汉病毒研究所,武汉 430071)
干扰素是一类在同种细胞上具有广谱抗病毒功能的活性蛋白,其活性的发挥受细胞基因的调节和控制[1],分为I 型干扰素和II 型干扰素两大类。 I型干扰素包括IFN-α 和IFN-β,II 型干扰素又称IFN-γ。 IFN-α、IFN-β 和IFN-γ 在体内分别由白细胞、成纤维细胞和淋巴细胞分泌,作用于干扰素受体,通过信号途径的激活,产生抗病毒蛋白,抑制病毒复制[2]。
I 型干扰素受体缺失小鼠是C57BL/6 背景小鼠通过ES 细胞基因打靶获得,该小鼠在被病毒感染后靶组织器官内病毒滴度远高于野生型小鼠,同时,病毒感染致死量远低于野生型小鼠[3],是理想的病毒易感动物模型,广泛应用于感染性小鼠模型的制备、病毒致病机制的研究、抗病毒药物及疫苗的筛选与评价等方面[4-8]。
实际饲养繁育过程中发现,干扰素受体缺失小鼠妊娠期为21 d 左右,哺乳期为21 d 左右,出生后42 ~56 d 可达性成熟,以上繁殖性能与背景野生型小鼠无明显差异。 但在产仔数量上,干扰素受体缺失小鼠普遍不佳,每胎产仔3 ~6 只,显著低于背景野生型小鼠每胎产仔数8 ~12 只。 干扰素受体缺失是否对小鼠体外受精造成影响,目前鲜有报道,本实验使用体外受精-胚胎移植(IVF-ET)技术,通过配子杂交试验,探讨I 型干扰素受体缺失对小鼠精子和卵细胞在体外受精中的影响。 同时,通过优化体外受精参数,探索提高体外受精率的方法,为后续相应机理研究以及快速扩繁策略制定奠定基础。
1 材料与方法
1.1 材料
1.1.1 实验动物
150 只4 周龄雌性IFN-α R-/-小鼠,体重约14 g;33 只12 周龄雄性,体重约25 g)、IFNα/β R-/-小鼠(150 只4 周龄雌性,体重约14 g;33 只12 周龄雄性,体重约25 g),ICR 小鼠(9 只8 周龄雌性,体重22~25 g),由中国科学院武汉病毒研究所实验动物中心保存【SYXK(鄂)2019-0034】。 C57BL/6 野生型小鼠(45 只4 周龄雌性,体重约14 g;9 只12 周龄雄性,体重约25 g)购自北京维通利华实验动物技术有限公司【SCXK(京)2016-0006】。 所有动物均满足SPF 级,饲养于屏障环境IVC 笼盒【SYXK(鄂)2019-0034】,自由饮水进食。 所有操作均符合中国科学院武汉病毒研究所动物实验伦理要求(IACUC 审批号:WIVA30201901)。
1.1.2 主要试剂与仪器
PMSG ( 宁波三生生物科技有限公司,B181205)、HCG(宁波三生生物科技有限公司,S180801),HTF (Cosmobio,CSR-R-B070),KSOM(Cosmobio,CSR-R-B074),2,2,2-三溴乙醇(Sigma,T48402),叔 戊 醇(Sigma,152463),M2 培 养 基(Sigma,M7167),矿物油(Sigma,M5310)。
体视显微镜(Motic,中国)、倒置显微镜(Leica,德国)、二氧化碳培养箱(Thermo,德国)、体温维持仪(瑞沃德,中国)、超净工作台(苏净安泰,中国)。
1.2 方法
1.2.1 实验分组
两种I 型干扰素受体缺失小鼠(IFN-α R-/-、IFN-α/β R-/-)及背景野生型小鼠(C57BL/6)分别进行体外受精及胚胎移植,每组超排5 只雌鼠,3 次重复,记录相关数据。 同时,分别将两种I 型干扰素受体小鼠配子与同背景品系小鼠配子进行体外受精,每组5 只小鼠,3 次重复,记录相关数据。 体外受精条件优化实验每种因素超排5 只小鼠,3 次重复,记录相关数据。
1.2.2 麻醉剂的配置与使用
称取5 g 2,2,2-三溴乙醇,加入3.1 mL 叔戊醇充分溶解,取500 μL 溶液加入39.5 mL 生理盐水中混匀过滤,小鼠麻醉按照20 μL/g 腹腔注射使用,所有实验操作均在动物麻醉状态下进行。
1.2.3 雌鼠超排及取卵
超排雌鼠腹腔注射10 IU PMSG,48 h 后腹腔注射10 IU HCG。 注射HCG 15 h 后将动物安乐死,收集卵子并放入二氧化碳培养箱暂存。
1.2.4 雄鼠精子采集与质量测定
将具有成功交配经验且1 周内未与雌鼠合笼的可育雄鼠安乐死后,取出附睾,迅速将精子取出至HTF 获能液中,获能30 min 后对精子进行计数观察并统计精子活力,精子活力计算公式为:(总精子数-非前进运动精子数)/总精子数。
1.2.5 体外受精
延获能滴边缘吸取适量精子悬浊液,注射入受精滴中,放入二氧化碳培养箱中培养6 h 后,将受精卵移入KSOM 液滴中继续培养。
1.2.6 受体准备
将ICR 结扎雄鼠与受体雌鼠1 ∶1合笼,第2 天验栓,如发现阴道栓则可作为胚胎移植的受体。 移植前应确定受体动物输卵管出现膨大部,如无膨大部,则不能作为受体动物。
1.2.7 早期胚胎形态学观察与统计
体外受精24 ~28 h 后,镜检受精情况,统计2细胞胚胎数、未受精卵数、异常卵数。 各类细胞形态特点见参考文献9[9]。
1.2.8 胚胎移植
将镜检状态良好的2 细胞胚胎移入提前平衡好的M2 培养基中,漂洗3 次后可用于移植。 受体小鼠麻醉后将40 枚胚胎采用输卵管移植方法移入双侧输卵管中。 移植完成后注意保温及术后照料,具体移植方法见参考文献9[9]。
1.2.9 体外受精条件的优化
影响小鼠体外受精因素很多,本实验主要对以下影响因素进行优化:A:不同采卵时间对体外受精效果的影响。 B:不同精子密度对体外受精效果的影响。 C:不同精子获能时间对体外受精效果的影响。 D:在获能液及受精液加入还原型谷胱甘肽对体外受精的影响。 探索提高I 型干扰素受体缺失小鼠体外受精方法。
1.3 统计学分析
使用SPSS 20.0 软件进行统计学分析,对所得数据进行单因素方差分析,定量数据以平均值±标准误(±s)表示。 组间比较采用t检验,检验水准为α=0.05,P<0.05 为差异具有统计学意义。
2 结果
2.1 两种I 型干扰素受体缺失雄鼠精子参数分析
由表1 可见,两种I 型干扰素受体缺失小鼠与背景品系雄鼠精子数量差异无显著性(P>0.05),而两种I 型干扰素受体缺失小鼠精子活力低于背景品系雄鼠,差异具有显著性(P<0.05)。 两种I 型干扰素受体缺失小鼠间,精子活力差异无显著性(P>0.05)。
2.2 两种I 型干扰素受体缺失小鼠体外受精率分析
由表2 可见,IFN-α R-/-和IFN-α/β R-/-小鼠体外平均受精率分别为(43.37 ± 1.90)%和(34.41 ±3.18)%,背景品系C57BL/6 小鼠体外平均受精率为(77.09 ± 0.67)%,两种I 型干扰素受体缺失小鼠与背景品系小鼠平均体外受精率差异具有显著性(P<0.05)。 同时,干扰素α 受体缺失小鼠体外受精率高于干扰素α、β 受体双缺失小鼠体外受精率,两者差异具有显著性(P<0.05)。
2.3 移植产仔率分析
将2 细胞胚胎定数移植受体小鼠双侧输卵管,对小鼠产仔数、平均产仔率、离乳数及平均成活率进行统计。 由表3 可见,IFN-α R-/-、IFN-α/β R-/-及C57BL/6 小鼠的平均产仔率分别为(20.83 ±1.44)%、(19.17 ± 1.44)%及(20.83 ± 1.44)%,不同品系小鼠组间平均产仔率差异无显著性(P>0.05)。 IFN-α R-/-组和IFN-α/β R-/-组出生的仔鼠在离乳前均死亡1 只,C57BL/6 组仔鼠全部成活,均顺利离乳。 不同实验组间平均成活率差异无显著性(P>0.05)。
2.4 配子杂交实验分析
将两种干扰素受体缺失小鼠雌雄配子分别与背景野生型小鼠雄雌配子进行体外受精,对卵母细胞数、2 细胞胚胎数、未受精卵数及异常卵数进行记录并计算平均受精率。 由表4 可见,IFN-α R-/-雌性小鼠卵细胞与背景野生型C57BL/6 雄性小鼠精子体外受精,平均受精率为(41.20 ± 1.18)%,IFN-α R-/-雄性小鼠精子与背景野生型C57BL/6 雌性小鼠卵细胞体外受精,平均受精率为(50.30 ± 1.08)%,两者差异具有显著性(P<0.05)。 IFN-α/β R-/-雌性小鼠卵细胞与背景野生型C57BL/6 雄性小鼠精子体外受精,平均受精率为(33.29 ± 2.44)%,IFNα/β R-/-雄性小鼠精子与背景野生型C57BL/6 雌性小鼠卵细胞体外受精,平均受精率为(42.82 ±0.35)%,两者差异具有显著性(P<0.05)。
2.5 体外受精条件优化结果分析
2.5.1 不同采卵时间对体外受精效果的影响
雌性小鼠注射HCG 后,不同时间点收集卵子,由表5 可见,IFN-α R-/-小鼠注射HCG 后15 h 收集卵细胞体外受精,受精效果最好,受精率显著高于其他时间点取卵的受精率(P<0.05)。 由表6 可见,IFN-α/β R-/-小鼠注射HCG 后13 h 和15 h 收集卵细胞体外受精,受精率差异不显著(P>0.05),受精率显著高于11 h 和17 h 取卵的受精率(P<0.05)。
2.5.2 不同精子密度对体外受精效果的影响
将不同密度小鼠精子体外受精,由表7 及表8可见,两种I 型干扰素受体缺失小鼠体外受精中,精子浓度为0.5 ~1×106/mL 受精效果最好,显著高于其余两个精子浓度组(P<0.05),精子浓度过低或过高均不利于体外受精。
2.5.3 不同获能时间对体外受精效果的影响
将不同获能时间的精子与卵细胞体外受精,由表9 及表10 可见,两种I 型干扰素受体缺失小鼠精子获能1 h 平均受精率最高,显著高于其他获能时间组(P<0.05),获能时间延长至2 h 时,受精率明显降低。
2.5.4 获能液及受精液中加入还原型谷胱甘肽对体外受精的影响
将精子获能液及受精液中添加1 mmol/L 还原型谷胱甘肽,由表11 及表12 可见,两种I 型干扰素受体缺失小鼠平均体外受精率与不添加还原型谷胱甘肽比较,均获得显著提高(P<0.05)。

表1 两种I 型干扰素受体缺失小鼠精子参数(n=3)Table 1 Sperm parameters of two type I interferon receptor-deficient mice(n=3)

表2 两种I 型干扰素受体缺失小鼠体外受精情况(n=15)Table 2 IVF results of two types I interferon receptor-deficient mice(n=15)

表3 移植产仔率与成活率情况(n=3)Table 3 Transplant birth rate and survival rate(n=3)

表4 两种I 型干扰素受体缺失小鼠与背景野生型小鼠配子杂交实验情况Table 4 Hybridization test of two types I interferon receptor-deficient mice and background wild-type mice

表5 不同采卵时间对IFN-α R-/-小鼠体外受精的影响Table 5 Effects of different oocyte collection time onin vitro fertilization of IFN-α R-/- mice
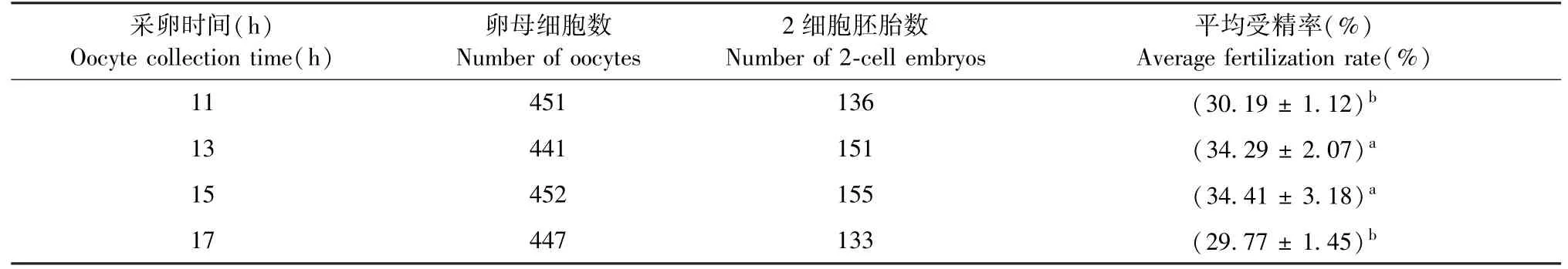
表6 不同采卵时间对IFN-α/β R-/-小鼠体外受精的影响Table 6 Effects of different oocyte collection time onin vitro fertilization of IFN-α/β R-/- mice

表7 不同精子浓度对IFN-α R-/-小鼠体外受精的影响Table 7 Effects of different sperm concentrations onin vitro fertilization of IFN-α R-/- mice

表8 不同精子浓度对IFN-α/β R-/-小鼠体外受精的影响Table 8 Effects of different sperm concentrations onin vitro fertilization of IFN-α/β R-/- mice

表9 不同获能时间对IFN-α R-/-小鼠体外受精的影响Table 9 Effects of different capacitation time onin vitro fertilization of IFN-α R-/- mice

表10 不同获能时间对IFN-α/β R-/-小鼠体外受精的影响Table 10 Effects of different capacitation time onin vitro fertilization of IFN-α/β R-/-mice

表11 添加还原型谷胱甘肽对IFN-α R-/-小鼠体外受精的影响Table 11 Effects of adding GSH onin vitro fertilization of IFN-α R-/- mice

表12 添加还原型谷胱甘肽对IFN-α/β R-/-小鼠体外受精的影响Table 12 Effects of adding GSH onin vitro fertilization of IFN-α/β R-/- mice
3 讨论
I 型干扰素受体缺失小鼠作为一种免疫缺陷动物,通过血液学分析,4 ~12 周龄的I 型干扰素受体缺失小鼠与正常背景野生型小鼠唯一的异常是末梢血中成熟型单核细胞及嗜中性细胞增加2 ~3倍,细胞表面IgM 稍有减弱[10],是多种病毒的易感模式动物,目前对其的研究主要集中在通过感染病毒后的机体各项指标的测定,从而确定感染性动物模型的构建是否成功,为后续病毒致病机理、抗病毒药物筛选等研究提供动物模型支持。 由于I 型干扰素受体缺失小鼠产仔数量偏低,为探索原因,笔者通过体外受精-胚胎移植及配子杂交试验初步探索干扰素受体缺失对体外受精造成的影响,并通过单一变量法对体外受精条件进行优化,为后续深入研究提供数据支持。
对两种I 型干扰素受体缺失小鼠IFN-α R-/-和IFN-α/β R-/-及背景野生型小鼠C57BL/6 精子参数比较发现,两种I 型干扰素受体缺失小鼠在精子数量上与背景品系小鼠并无显著性差异(P>0.05),但精子活力显著低于背景品系小鼠(P<0.05)。 体外受精-胚胎移植发现,两种I 型干扰素受体缺失小鼠平均体外受精率与背景野生型小鼠比较有显著差异(P<0.05);同时,干扰素α 受体单缺失小鼠平均体外受精率高于干扰素α、β 受体双缺失小鼠,两者比较有显著差异(P<0.05)(见表2)。 由此初步推断,I 型干扰素受体缺失导致小鼠体外受精能力明显降低,并且降低程度随受体缺失数量增加而增加。 将体外受精获得的2 细胞胚胎定数移植入受体输卵管,均得到了较理想的产仔量,I 型干扰素受体缺失小鼠与背景野生型小鼠无明显差异(见表3)。
为研究I 型干扰素受体缺失小鼠的卵细胞和精子分别对体外受精的影响,笔者设计了配子杂交试验,将IFN-α R-/-及IFN-α/β R-/-小鼠卵细胞和精子分别与背景野生型小鼠精子和卵细胞进行杂交体外受精,记录卵母细胞数、2 细胞胚胎数、未受精卵数及异常卵数,并计算平均受精率。 分析可知,两种I 型干扰素受体缺失小鼠精子与背景野生型小鼠卵细胞体外受精平均受精率(50.30 ± 1.08)%和(42.82 ± 0.35)%和相应品系小鼠卵细胞与背景野生型小鼠精子体外平均受精率(41.20 ± 1.18)%和(33.29 ± 2.44)%均低于背景野生型体外受精率(77.09 ± 0.67)%,推断I 型干扰素受体缺失对小鼠精子和卵细胞均产生了影响,导致受精率降低。 同时,两种I 型干扰素受体缺失小鼠精子与背景野生型小鼠卵细胞体外受精率均高于相应品系小鼠卵细胞与背景野生型小鼠体外受精率,说明I 型干扰素受体缺失对卵细胞在体外受精中的影响更为明显。 当I 型干扰素与受体结合后,将引发级联性的信号放大过程,信号传递到细胞核,对一系列干扰素刺激基因的表达进行调控,主要涉及的信号通路包括MAPK (mitogen-activated protein kinase) 通路[11]。 研究发现在动物繁殖的不同阶段均有MAPK 信号通路的参与,对动物生产实践中的繁殖调控具有一定作用,主要体现在对于精子的发生、睾丸的发育及卵母细胞的发育产生影响[12]。 推测I型干扰素受体缺失,使细胞内MAPK 通路受阻,从而导致小鼠生殖功能障碍,相关具体机制仍需进一步研究。 同时,I 型干扰素受体缺失将直接影响动物免疫功能,是否能够间接导致其繁殖性能下降亦需要后续探索。
影响小鼠体外受精因素很多,本试验通过改变影响体外受精的因素,如注射HCG 后的取卵时间、精子浓度、精子获能时间及改变精子获能液和受精液成分,探索提高体外受精效率的方法。 通过改变注射HCG 后取卵时间或调整体外受精精子浓度,并未使两种I 型干扰素受体缺失小鼠体外受精率获得提升。 适当调整精子获能时间,当延长获能时间为1 h 时,发现两种I 型干扰素受体缺失小鼠体外受精率与常规方法相比,具有显著提高(P<0.05)。 本试验以本实验以Takeo 等[13]前期研究为依据,将常规精子获能液及受精液中加入1 mmol/L 还原型GSH,结果发现,加入GSH 后,两种I 型干扰素受体缺失小鼠体外受精率与常规获能液及受精液比较均获得显著提高(P<0.05)。
本研究显示I 型干扰素受体缺失可导致该两种品系小鼠体外受精率降低,同时,对卵细胞的影响较精子更为显著,通过延长精子获能时间或在精子获能液及受精也中加入GSH,能够显著提高体外受精效果。 笔者后续将对I 型干扰素受体缺失对小鼠体外受精造成的影响以及繁殖策略进行深入研究,并对相应影响机制进行进一步探索。

