蒙花苷磷脂复合物固体脂质纳米粒的制备及其体内药动学研究
周 开 张佩琛 郝海军 付金芳 范明松*
(1.郑州澍青医学高等专科学校, 河南 郑州450064; 2.上海雷允上药业有限公司技术中心,上海201401)
蒙花苷是一种天然黄酮类化合物,主要存在于野菊花、密蒙花等植物中,具有降血压、抗氧化、镇痛、疏风清热、抗菌消炎、养肝明目等药理作用[1-3]。近年来研究[4]发现,内皮细胞损伤导致的功能性障碍与高血压、动脉粥样硬化、糖尿病等多种心血管疾病密切相关,故预防和逆转内皮细胞损伤有望成为治疗心脑血管疾病的新方法,而蒙花苷对血管内皮细胞具有明显的保护和修复作用[5-6],有望开发成预防、治疗心脑血管疾病的新药。但该成分水溶性和脂溶性均较差[7],导致体内吸收困难。
纳米给药系统在促进难溶性药物体内吸收、提高生物利用度方面具有较大优势,但由于蒙花苷脂溶性较差,严重影响了它与纳米脂质载体的亲和性,往往导致纳米粒包封率较低[8],故为了获得高包封率的固体脂质纳米粒,需先改善药物脂溶性。据报道,磷脂复合物技术有助于改善药物脂溶性[8-10],故本实验采用溶剂挥发法制备蒙花苷磷脂复合物[11],并进一步制成固体脂质纳米粒,再对其基本理化性质及体内药动学进行研究。
1 材料
1.1 仪器 CPA255D型电子天平[赛多利斯科学仪器(北京) 有限公司];Agilent 1260型高效液相色谱仪(美国Agilent 公司);THZ-92A型恒温振荡器(上海翠柳实验仪器有限公司);DF-101S型磁力搅拌器(巩义市予华仪器有限责任公司);D8型X 射线粉末衍射仪(瑞士Bruker 公司);ND200-2型氮气吹扫仪(徐州晟浩电子科技有限公司);XW-80A型漩涡混合器(上海医科大学仪器厂)。
1.2 试剂与药物 蒙花苷对照品(批号111528-201606,纯度99.5%,中国食品药品检定研究院)。卵磷脂(批号PC98T,辅必成上海医药科技有限公司);单硬脂酸甘油酯(批号T160522)、泊洛沙姆188(批号WPW1602B)(德国巴斯夫公司)。磺胺甲恶唑对照品(批号T20160615,纯度>99.0%,上海泽叶生物科技有限公司)。
1.3 动物 SD 大鼠,体质量280~320 g,购自上海斯莱克实验动物有限公司,雌雄兼用,动物生产许可证号SCXK(沪) 2012-0002。
2 方法与结果
2.1 蒙花苷固体脂质纳米粒制备 称取蒙花苷21 mg、大豆磷脂29 mg、单硬脂酸甘油酯300 mg,溶于10 mL(60±1)℃无水乙醇中,作为有机相;将0.3 g 泊洛沙姆188 溶于同温度30 mL 蒸馏水中,作为水相,1 000 r/min 转速下将有机相滴入水相中,继续搅拌0.5 h 得到初乳,置于超声波细胞粉碎仪中超声处理8 min(功率500 W,每超声2 s间隔1 s),立即置于-20℃冰箱中固化,0.22 μm微孔滤膜过滤,即得纳米粒混悬液。
2.2 蒙花苷磷脂复合物固体脂质纳米粒制备 称取蒙花苷60 mg、大豆卵磷脂80 mg,置于30 mL四氢呋喃中(1∶1),1 000 r/min 转速下恒温(45℃) 搅拌5 h,减压旋蒸除去四氢呋喃,得到磷脂复合物[11]。采用乳化超声分散法制备固体脂质纳米粒,称取磷脂复合物50 mg、单硬脂酸甘油酯300 mg,溶于10 mL(60±1)℃无水乙醇中,作为有机相;将0.3 g 泊洛沙姆188 溶于同温度30 mL蒸馏水中,作为水相,1 000 r/min 转速下将有机相滴入水相中,继续搅拌0.5 h 得到初乳,置于超声波细胞粉碎仪中超声处理8 min(功率500 W,每超声2 s 间隔2 s),立即置于-20℃冰箱中固化,0.22 μm 微孔滤膜过滤,即得纳米粒混悬液。
2.3 蒙花苷含有量测定
2.3.1 色谱条件 Waters C18色谱柱(4.6 mm×250 mm,5 μm);流动相甲醇-0.4% 磷酸(55∶45);体积流量1.0 mL/min;柱温30℃;检测波长325 nm;进样量20 μL。
2.3.2 供试品溶液制备 精密量取0.5 mL 蒙花苷磷脂复合物固体脂质纳米粒混悬液,加入0.5 mL甲醇超声处理后定容至10 mL,12 000 r/min 离心10 min,精密量取1 mL 至100 mL 量瓶中,流动相定容至刻度,HPLC 法测定蒙花苷总含有量。同法配制空白溶液。
2.3.3 方法学考察 称取蒙花苷对照品18.0 mg 溶于100.0 mL 甲醇中,得到0.18 mg/mL 贮备液,精密量取5 mL 于100 mL 量瓶中,流动相定容至刻度,即得(9.0 μg/mL),精密量取1.0 mL 于10 mL 量瓶中,流动相定容至刻度,即得(0.9 μg/mL),再进一步稀释成 0.01、0.2,0.3、0.45、0.6、0.9 μg/mL,在“2.3.1” 项色谱条件下进样测定。以溶液质量浓度为横坐标(X),峰面积为纵坐标(Y) 进行回归,得方程为Y=13.575 6X+2.041 9(r=0.999 7),在0.01~0.9 μg/mL 范围内线性关系良好。
取“2.3.2” 项下供试品溶液,于0、4、6、8、12、24 h 在“2.3.1” 项色谱条件下进样测定,测得蒙花苷含有量的RSD 为0.48%,表明溶液在24 h内稳定性良好。取0.01、0.6、0.9 μg/mL 对照品溶液,在“2.3.1” 项色谱条件下进样测定6次,测得日内精密度RSD 分别为1.31%、0.27%、0.08%,表明该方法精密度良好。于空白溶液中分别加入0.45 μg/mL对照品溶液 0.8、1.0、1.2 mL,平行3 份,在“2.3.1” 项色谱条件下进样测定,测得平均加样回收率为100.92%,RSD为1.74%。
2.4 参数测定
2.4.1 包封率、载药量 采用超滤离心法。精密量取1.0 mL 纳米粒混悬液于超滤离心管中,12 000 r/min离心60 min。精密量取0.5 mL 续滤液,加入0.5 mL 甲醇超声处理,定容至10 mL,精密量取1 mL 至100 mL 量瓶中,流动相定容至刻度,HPLC 法测定外管续滤液中蒙花苷含有量(m游离);精密量取0.5 mL 蒙花苷磷脂复合物固体脂质纳米粒混悬液,加入0.5 mL 甲醇超声处理,定容至10 mL,12 000 r/min 离心10 min,精密量取1 mL 至100 mL 量瓶中,流动相定容至刻度,HPLC 法测定蒙花苷总含有量,计算包封率、载药量,公式分别为包封率=[(m总药-m游离药) /m总药]×100%、载药量=[(m总药-m游离药) /m药脂]×100%,其中m总药表示总药物量,m游离药表示游离药物量,m药脂表示药物和脂质总量。结果,磷脂复合物固体脂质纳米粒平均包封率为82.06%,载药量为4.72%,高于固体脂质纳米粒的52.63%、2.93%,故选择前者作进一步研究。
2.4.2 粒径、Zeta 电位 量取蒙花苷磷脂复合物固体脂质纳米粒0.2 mL,加入4.0 mL 蒸馏水,振荡混匀后测定粒径、Zeta 电位,结果见图1~2,可知平均粒径为(216.72±3.57) nm,PDI 为0.067±0.09,Zeta 电位为(-8.7±0.7) mV。
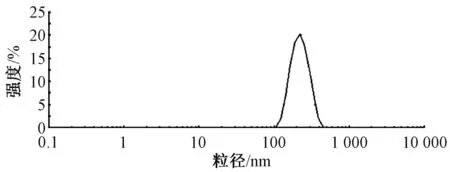
图1 蒙花苷磷脂复合物固体脂质纳米粒粒径分布Fig.1 Particle size distribution of the solid lipid nanoparticles of buddleoside phospholipid complex
2.4.3 形态 量取蒙花苷磷脂复合物固体脂质纳米粒混悬液适量,按照1∶20 比例用蒸馏水稀释后滴加到有支持膜的铜网上,均匀铺展放置10 min,滤纸轻轻吸干,置于5%磷钨酸溶液中浸泡5 min,自然晾干后在透射电镜下观察形态,结果见图3。由此可知,纳米粒呈类球形或球形,无粘连现象。

图2 蒙花苷磷脂复合物固体脂质纳米粒Zeta 电位Fig.2 Zeta potential of the solid lipid nanoparticles of buddleoside phospholipid complex

图3 蒙花苷磷脂复合物固体脂质纳米粒透射电镜图Fig.3 Transmission electron microscope image for the solid lipid nanoparticles of buddleoside phospholipid complex
2.5 体外稳定性研究 于0、0.5、1、2、4、6、12、24、36、48 h 测定蒙花苷磷脂复合物固体脂质纳米粒混悬液粒径变化,结果见图4。由此可知,纳米粒在48 h 内粒径变化不显著,可能与静电排斥力有关;磷脂复合物在0.5 h 内即发生沉淀,可能是由于它一般在非质子溶剂中制备,当接触水相时即发生解离而沉淀。

图4 蒙花苷磷脂复合物固体脂质纳米粒体外稳定性Fig.4 In vitro stability of the solid lipid nanoparticles of buddleoside phospholipid complex
2.6 冻干粉制备 量取2 mL 蒙花苷磷脂复合物固体脂质纳米粒混悬液于西林瓶中,加入5%甘露醇混匀,置于-75℃冰箱中预冻12 h 后立即放入-40℃冻干机中,平衡3 h 后抽真空,4℃/h升温至-25℃,保持48 h,即得。取适量加水重新分散,测得其平均粒径为(252.31±6.11) nm,Zeta电位为(-7.9±0.8) mV,与固体脂质纳米粒混悬液相比,前者有所增大,而后者有所下降。
2.7 体内药动学研究
2.7.1 灌胃液制备 取蒙花苷、蒙花苷磷脂复合物、蒙花苷磷脂复合物固体脂质纳米粒冻干粉末适量,0.5% CMC-Na 配制成5 mg/mL(以蒙花苷含有量计),即得。
2.7.2 给药方案及采血 取SD 大鼠18 只,雌雄兼具,随机分为蒙花苷组、蒙花苷磷脂复合物组、蒙花苷磷脂复合物固体脂质纳米粒组,每组大鼠按40 mg/kg 剂量(以蒙花苷含有量计) 分别灌胃给予“2.7.1” 项下相应灌胃液。大鼠固定于37℃保温垫上行颈动脉插管术,于5、10、30、45、60、90、120、150、180、240、360 min 各取血0.2 mL至肝素化离心管中,2 500 r/min 离心3 min,取上层血浆冷冻待测。
2.7.3 血样处理 精密量取磺胺甲恶唑(内标)溶液(228.4 ng/mL) 20 μL、血浆样品50 μL,置于离心管中,加入1.5 mL 甲醇后涡旋混匀6 min,8 000 r/min 离心30 min,分取上清液,45℃下氮气缓慢吹除有机溶剂,加入50 μL 甲醇复溶,8 000 r/min 离心10 min,取上清液,置于进样瓶的内衬管中待测。
2.7.4 专属性、线性关系考察 将空白血浆在室温下解冻,按“2.7.3” 项下方法处理(不加内标),同法处理给药后血浆。另取血浆对照品溶液,在“2.3.1” 项色谱条件下进样测定,测得蒙花苷、磺胺甲恶唑(内标) 分别在5.9、6.3 min出峰,而且均不受内源性物质干扰。
精密称取磺胺甲恶唑对照品22.84 mg,溶于100 mL 甲醇中,得到228.4 μg/mL 贮备液,取适量继续稀释至228.4 ng/mL,作为内标溶液。精密称取蒙花苷对照品22.60 mg,溶于100.0 mL 甲醇中,甲醇逐步稀释成1 130.0、565.0、282.5、113.0、56.5、28.2 ng/mL,分别量取50 μL,氮气吹干后加入同体积空白血浆,混匀溶解,得到血浆对照品溶液,按“2.7.3” 项下方法处理,在“2.3.1” 项色谱条件下进样测定。以蒙花苷与内标峰面积比值为纵坐标(Y),溶液质量浓度为横坐标(X) 进行回归,得方程为Y=1.307 2X+8.915 3(r=0.991 3),在28.2~1 130.0 ng/mL 范围内线性关系良好。
2.7.5 方法学考察 取28.2、565.0、1 130 ng/mL血浆对照品溶液,在“2.3.1” 项色谱条件下进样测定6 次,测得日内精密度RSD 分别为8.26%、4.83%、4.11%,日间精密度RSD 分别为10.64%、7.62%、6.23%,表明该方法精密度良好。任取一份血浆样品,于0、2、4、8、12、24、48 h 在“2.3.1” 项色谱条件下进样测定,测得蒙花苷、内标峰面积比值RSD 为1.92%,表明血浆样品在48 h 内稳定性良好。精密称取蒙花苷对照品16.00 mg,溶于100.0 mL 甲醇中得160.00 μg/mL 溶液,精密量取1.0 mL 至 100 mL 量瓶中,甲醇定容至1 600 ng/mL,继续用甲醇稀释至40.0、400.0、800.0 ng/mL,分别精密量取50 μL,氮气吹干,加入同体积大 鼠空白血浆,得 40.0、400.0、800.0 ng/mL血浆样品,按“2.7.3” 项下方法处理,在“2.3.1” 项色谱条件下进样测定,测得回收率分别为92.34%、96.17%、94.72%,RSD 均小于1.84%。将25.75 ng/mL 血浆对照品溶液逐步稀释,在“2.3.1” 项色谱条件下进样测定,测得定量限(信噪比约为10) 为6.38 ng/mL,检测限(信噪比约为3) 为2.12 ng/mL。
2.7.6 分析结果 图5、表1 显示,与蒙花苷比较,其磷脂复合 物Cmax、AUC0~t、AUC0~∞升 高(P<0.05);与蒙花苷及其磷脂复合物比较,其固体脂质纳米粒tmax延长(P<0.05),Cmax、AUC0~t、AUC0~∞升高(P<0.05,P<0.01)。另外,磷脂复合物、固体脂质纳米粒相对生物利用度较原料药分别提高至1.39、2.89 倍。

图5 样品血药浓度-时间曲线Fig.5 Plasma concentration-time curves for samples
3 讨论
药物亲脂性对固体脂质纳米粒包封率的影响较大[9],课题组前期对蒙花苷固体脂质纳米粒进行了研究,发现其包封率仅为52.63%;本实验将该成分先制成磷脂复合物以提高其脂溶性,增加与脂质载体的亲和性,再进一步制成固体脂质纳米粒,此时包封率提高至82.06%。
表1 样品主要药动学参数(, n=6)Tab.1 Main pharmacokinetic parameters for samples(, n=6)

表1 样品主要药动学参数(, n=6)Tab.1 Main pharmacokinetic parameters for samples(, n=6)
注:与蒙花苷比较,*P<0.05,**P<0.01;与蒙花苷磷脂复合物比较,#P<0.05,##P<0.01。
为防止SD 大鼠处于失血性病理状态,药动学研究中对其进行颈动脉插管术,可最大程度减少采血时血量的损失,也可防止眼眶静脉丛采血时带来的时间误差,可控性较强;另一方面,该方法可使大鼠在实验过程中自由饮水。结果显示,磷脂复合物固体脂质纳米粒可显著升高蒙花苷Cmax,促进该成分在机体内的吸收,相对生物利用度提高至2.89 倍;显著延长tmax,可能是由于固体脂质纳米粒对包裹于其中的药物具有缓释作用[8],有助于增加药物体内滞留时间,促进其体内吸收,而且纳米粒处方中磷脂、泊洛沙姆本身也具有促进药物体内吸收的作用[12-14];tmax、Cmax、AUC0~t、AUC0~∞与磷脂复合物相比均有显著差异,表明固体脂质纳米粒后能改变磷脂复合物药动学,更有助于促进药物体内吸收。
综上所述,本实验成功制备了蒙花苷磷脂复合物固体脂质纳米粒,为制备高包封率的相关剂型提供了借鉴,也为进一步研究其体内药效学[15-16]奠定了基础。

