辛烯基琥珀酸酐改性多孔淀粉结构表征
李海燕 马云翔 俞力月 孙 倩 张盛贵
(甘肃农业大学,兰州 730070)
辛烯基琥珀酸酐(OSA)可与淀粉反应形成含有亲水和疏水基团的辛烯基琥珀酸淀粉酯,疏水基团的引入使OSA改性淀粉具有两亲特性[1],可用作乳化剂、包封剂及脂肪替代品[2]。美国食品和药物管理局允许OSA改性淀粉作为合法的食品添加剂,最大OSA添加水平为3.0%,取代度(DS)小于0.02[3,4]。由于OSA在水中的溶解度低,在淀粉颗粒中分布不均匀,渗入颗粒内部受到阻碍[5],导致反应仅限于淀粉表面[6,7],DS较低(0.0164)[8]。多孔淀粉(PS)是用物理法、生物法和化学法使淀粉颗粒由表面至内部形成孔洞的一种变性淀粉[9],PS相比于原淀粉具有大的比表面积[10]。因此,相比于原淀粉,PS作为反应主体,不仅使反应时淀粉与OSA的接触面积增加,又能使OSA渗透到淀粉的内部而发生反应,获得更高的取代度,提高改性淀粉的乳化能力和乳化稳定性。
最近的一些研究已经通过物理化学处理增加淀粉对OSA修饰的敏感性。Wang等[11]利用高速剪切的方法促进OSA与淀粉的酯化反应,使淀粉表面结构破坏,同时OSA液滴变小,使OSA更易进入淀粉颗粒内部,从而使酯化反应更均匀的发生。Wang等[12]通过比较冷冻-解冻和水热-碱的方法预处理淀粉,证明水热-碱预处理增加了OSA-淀粉的DS和反应效率(分别为0.0185和79.7%),冷冻-解冻预处理产生相反的结果(分别为0.015 2和65.5%)。Lu等[13]使用β-淀粉酶和转葡糖苷酶对天然淀粉纳米颗粒(NSP)进行酶预处理,然后用OSA酯化,结果表明双酶预处理增加了OSA改性淀粉颗粒的DS,提高了乳液稳定性。Xu等[14]利用脂肪酶催化OSA与淀粉的酯化反应,所得产物与水相法获得的产物性质相似,但可以缩短反应时间。淀粉在经OSA改性前,通过物理化学方法将淀粉颗粒适度破坏,可增加OSA与淀粉的接触面积,从而提高酯化反应的效率。
关于OSA改性多孔淀粉的结构性质研究报道很少,研究淀粉的多孔结构对OSA改性淀粉的DS及性质的影响鲜见报道。本研究通过OSA改性PS以获得更高取代度但又符合食用标准的改性淀粉,以克服原淀粉取代度低、乳化能力和乳化稳定性差的缺点。以多孔淀粉为主体,OSA为客体成功合成OSA改性多孔淀粉,采用SEM评价多孔淀粉的孔结构,固态核磁(13C CP/MAS NMR)和傅里叶红外光谱(FT-IR)评价OSA与多孔淀粉的酯键,X射线衍射分析(XRD)评价OSA改性多孔淀粉的结晶结构,热重分析(TGA)改性淀粉酯的热稳定性。研究OSA改性多孔淀粉的结构特性,旨在为淀粉的综合利用提供借鉴,且为改性淀粉作为乳化剂递送生物活性物质提供选择。
1 材料与方法
1.1 材料与试剂
玉米淀粉、α-淀粉酶(AM,50 U/mg,分析纯)、淀粉葡糖苷酶(AMG,100 U/mL,分析纯)、辛烯基琥珀酸酐(分析纯)、玉米油(试剂级)、β-胡萝卜素。
1.2 仪器与设备
PHS-3C雷磁pH计;H-1850R台式高速冷冻离心机;600 MHz 宽腔固体超导核磁共振波谱仪;NEXUS 670傅里叶变换红外光谱仪;SuperNOVAX-射线单晶衍射仪;JSM-6701F冷场发射型扫描电镜;DF-Ⅱ集热式磁力加热搅拌器;FJ-200高速均质机。
1.3 方法
1.3.1 多孔淀粉(PS)的制备
参照Dura等[9]的方法稍做修改,具体方法如下:将玉米淀粉(10.0 g)悬浮于pH 4.5的磷酸盐和醋酸盐混合缓冲液中,于40 ℃水浴锅中搅拌(100r/min)20 min,然后加入2%(相对于淀粉)、酶比(mAM:mAMG)为6∶1的复合酶,将样品在50 ℃水浴中搅拌(50 r/min)。24h后加1 mol/L NaOH溶液调pH为10.0以终止酶解反应。将悬浮液在7 000r/min,4℃下离心15 min,蒸馏水重复洗涤3次。最后,将收集的沉淀物置于恒温干燥箱中50 ℃干燥8 h,研磨过90目筛存于干燥器中备用。
1.3.2 OSA改性多孔淀粉的制备
参照Song等[15]的方法并做适当修改,具体操作如下:将原淀粉或多孔淀粉(5.0 g)分散在水(30%)中,搅拌20 min以形成悬浮液。用3% NaOH溶液调pH至8.5,在1 h内分别将淀粉质量1%、3%和5%的OSA(用无水乙醇稀释3倍)溶液缓慢滴加至淀粉浆中,35 ℃反应1 h,再用3% HCl溶液将pH调至6.5,离心混合物并用水洗2次,用70%乙醇洗涤2次,置于40 ℃干燥24 h,过90目筛备用。将改性淀粉分别命名为1% OSA-NS、1% OSA-PS、3% OSA-PS和5% OSA-PS。
1.3.3 OSA改性多孔淀粉取代度(DS)的测定
参照Kweon等[16]描述的滴定法测定DS,适当修改,具体操作为:OSA改性多孔淀粉(1g)置于20 mL HCl-异丙醇溶液(2.5 mol/L)中,搅拌30 min。加入90%异丙醇水溶液(100 mL),搅拌10 min。将悬浮液离心,残余物用90%异丙醇水溶液洗涤,直至用0.1 mol/L AgNO3测定不存在氯离子。将残余物重新分散在蒸馏水(60 mL)中,沸水浴中加热20 min。用酚酞作为终点指示剂,用0.1 mol/L标准NaOH溶液滴定混合物,多孔淀粉做空白对照。DS用公式计算:
式中:162为葡萄糖残基的摩尔质量/g/mol;210为辛烯基琥珀酸酐的摩尔质量/g/mol;A为氢氧化钠溶液的滴定体积/mL;M为氢氧化钠溶液的浓度/mol/L;W为样品质量/g。
反应效率(RE)计算公式为:
1.3.4 OSA改性多孔淀粉结构表征分析
1.3.4.1 扫描电镜分析(SEM)
用导电胶将少量干燥后的原淀粉、多孔淀粉和OSA改性多孔淀粉粉末粘在样品座上,将样品座置于离子溅射仪中镀金30 s后,用扫描电镜观察样品粉末的形态特征。
1.3.4.2 核磁共振分析(13C CP/MAS NMR)
使用AVANCE NEO WB 600核磁共振波谱仪在100.56 MHz下以13C参照纯四甲基硅烷获得多孔淀粉和OSA改性多孔淀粉的13C CPMAS NMR光谱。
1.3.4.3 傅里叶红外光谱分析(FT-IR)
采用溴化钾压片法测定多孔淀粉及OSA改性多孔淀粉的红外光谱。取适量溴化钾,加入1 mg干燥样品粉末,碾磨至无颗粒感后压片处理,扫描波长为4 000 ~450 cm-1。
1.3.4.4 X射线衍射分析(XRD)
采用X射线衍射仪对多孔淀粉及OSA改性多孔淀粉结晶结构测定。测试条件为:扫描范围535;扫描速度2/min;扫描步长0.06;扫描方式为连续。相对结晶度使用公式计算。
式中:Xc为相对结晶度;Ac为晶体面积;Aa为非晶体面积。
1.3.4.5 热重分析(TGA-DTA)
采用热重分析仪研究多孔淀粉及OSA改性多孔淀粉的热特性。分析条件:氮气;升温速率10℃/min;温度范围20700 ℃。
1.3.5 乳化稳定性分析
分别配制0.05 g/mL的多孔淀粉和OSA改性多孔淀粉溶液,加入β-胡萝卜素玉米油,使混合物中含有5%的OSA改性多孔淀粉和10%的玉米油,用高速均质机以500 r/min的速度均质10 min后,再通过高压均质机在100 MPa下均质两次,吸取10 mL放入试管中,30 min后观察试管中乳液的状态并拍照。
1.3.6 统计分析
每组实验重复3次,采用Origin 8及SPSS 22等软件对数据进行统计分析。数据用平均值±标准差的形式表示。
2 结果与讨论
2.1 OSA改性多孔淀粉的取代度(DS)
在淀粉浓度为30%,反应时间为1 h,温度为35 ℃,pH值为8.5条件下对不同OSA水平处理的改性多孔淀粉进行DS分析(表1)。结果表明,1%OSA-PS的DS为0.0191,RE为82.11%,随着OSA浓度的增加,DS也随之增加,RE减小,原因是淀粉羟基数目固定,因此反应依赖于羟基附近OSA分子的可用性[17],在OSA改性银杏淀粉中也观察到相似的结果[18],而RE减小可能是由于水不溶性OSA和淀粉相混合不充分造成的[19]。Chen等[8]在3%OSA水平下利用水热预处理淀粉,使得OSA改性淀粉的DS从0.0164上升到0.0190;Bai等[20]制备3%浓度的OSA改性玉米淀粉,DS为0.019。本实验所测1%OSA改性原淀粉的DS为0.0130,1%OSA改性多孔淀粉DS为0.0191,DS和RE均不同程度的增加,这是由于多孔淀粉结构中孔径和孔深度的增加提供了更大的比表面积[21],与OSA有更多的反应位点,赋予酯化产物更大的取代度和反应效率。

表1 OSA改性多孔淀粉的DS和相对结晶度
注:不同的上标字母表明差异有统计学意义(P< 0.05)。
2.2 OSA改性多孔淀粉的结构表征
2.2.1 扫描电镜分析(SEM)
天然玉米淀粉、多孔淀粉及OSA改性多孔淀粉的SEM显示在图1中。天然玉米淀粉(图1a)表面平滑,颗粒呈圆形和多角形,且没有可见的孔,表明在处理期间不存在内源性酶。多孔淀粉(图1b)表面出现较为均匀的孔,孔的深浅不一,有的孔可以延伸到颗粒内部,但颗粒的形状几乎不变,可提供更大的比表面积,释放更多的羟基基团与OSA发生反应[22]。在OSA酯化反应后,颗粒表面出现轻微腐蚀,但不影响颗粒的原始形状[17],多孔结构仍能保持。SEM结果表明,酯化反应不会破坏多孔淀粉颗粒的形态结构。

图1天然玉米淀粉、多孔淀粉及OSA改性多孔淀粉电镜扫描图
2.2.2 固态核磁分析(13C CP/MAS NMR)
对多孔淀粉和OSA改性多孔淀粉进行13C CP/MAS NMR分析,如图2所示,根据文献得出多孔淀粉分子中碳原子的对应信号[23]。OSA-PS的光谱图与PS基本一致,表明酯化反应后骨架结构保持良好,图2b中嵌入了OSA-PS部分放大的固态13C谱图,范围为120 ~250。该峰的中心位置为172,这是由13C的酯键化学位移引起的[24],结果表明,通过酯化反应成功形成了OSA与PS之间的骨架连接。
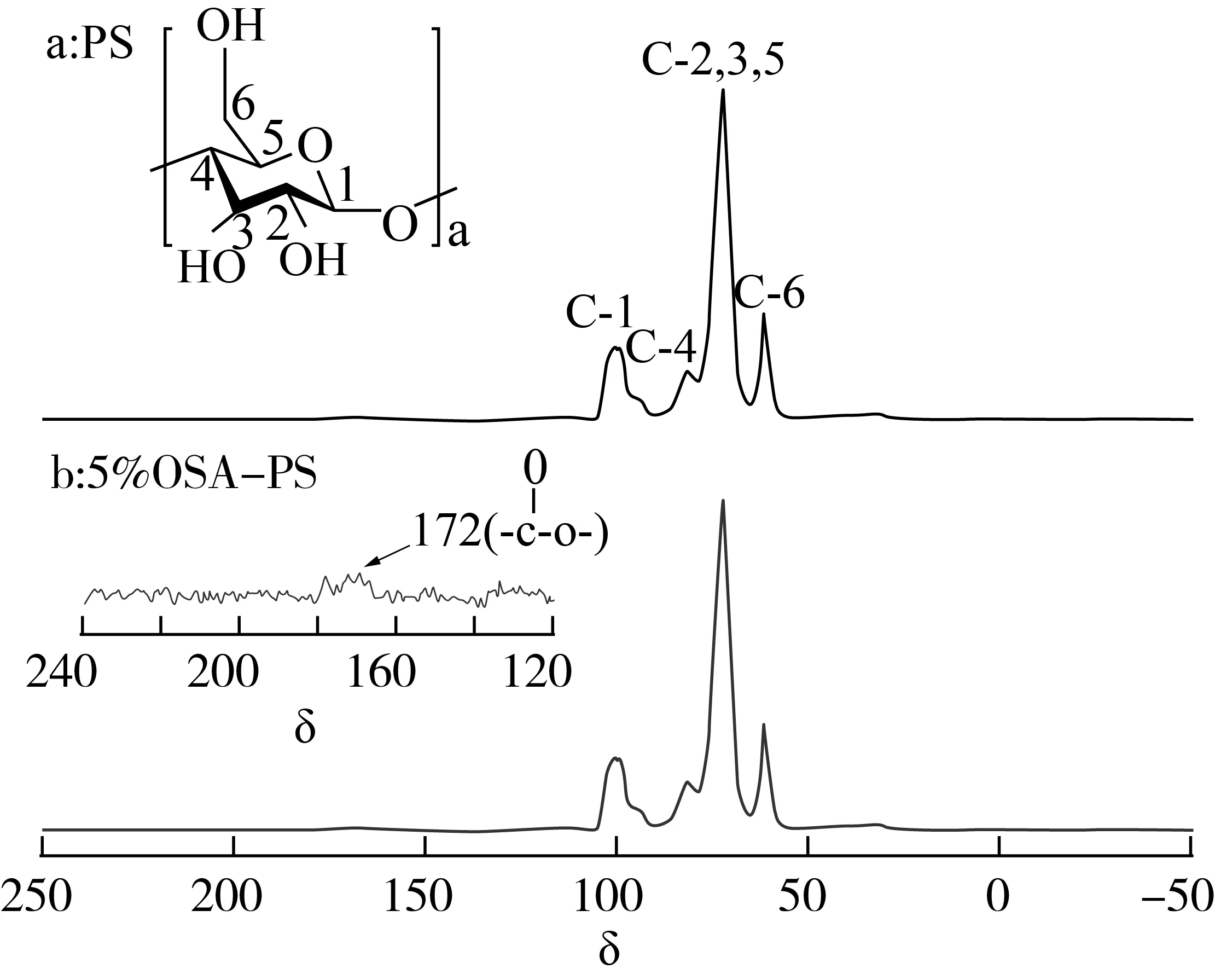
图2PS (a)和OSA改性PS (b)的13C CP/MAS NMR谱图
2.2.3 傅里叶红外光谱分析(FT-IR)


图3多孔淀粉和OSA改性多孔淀粉的红外光谱图
2.2.4 X射线衍射分析(XRD)
多孔淀粉和OSA改性多孔淀粉的X射线衍射图如图4所示,Xc的相应值在表1中给出。所有淀粉样品都显示出典型的A型衍射峰,分别在15°、17°、18°和23°处有强的衍射峰。多孔淀粉和OSA改性多孔淀粉之间几乎没有差异,表明酯化反应不会改变淀粉的结晶类型。多孔淀粉的Xc值略高于OSA改性多孔淀粉的值,但不同OSA水平改性多孔淀粉之间的Xc值没有显著性差异(表1)。这表明OSA酯化主要发生在淀粉的无定形区域,与取代度较低的实际较为符合,该结果与He等[26]的研究一致。
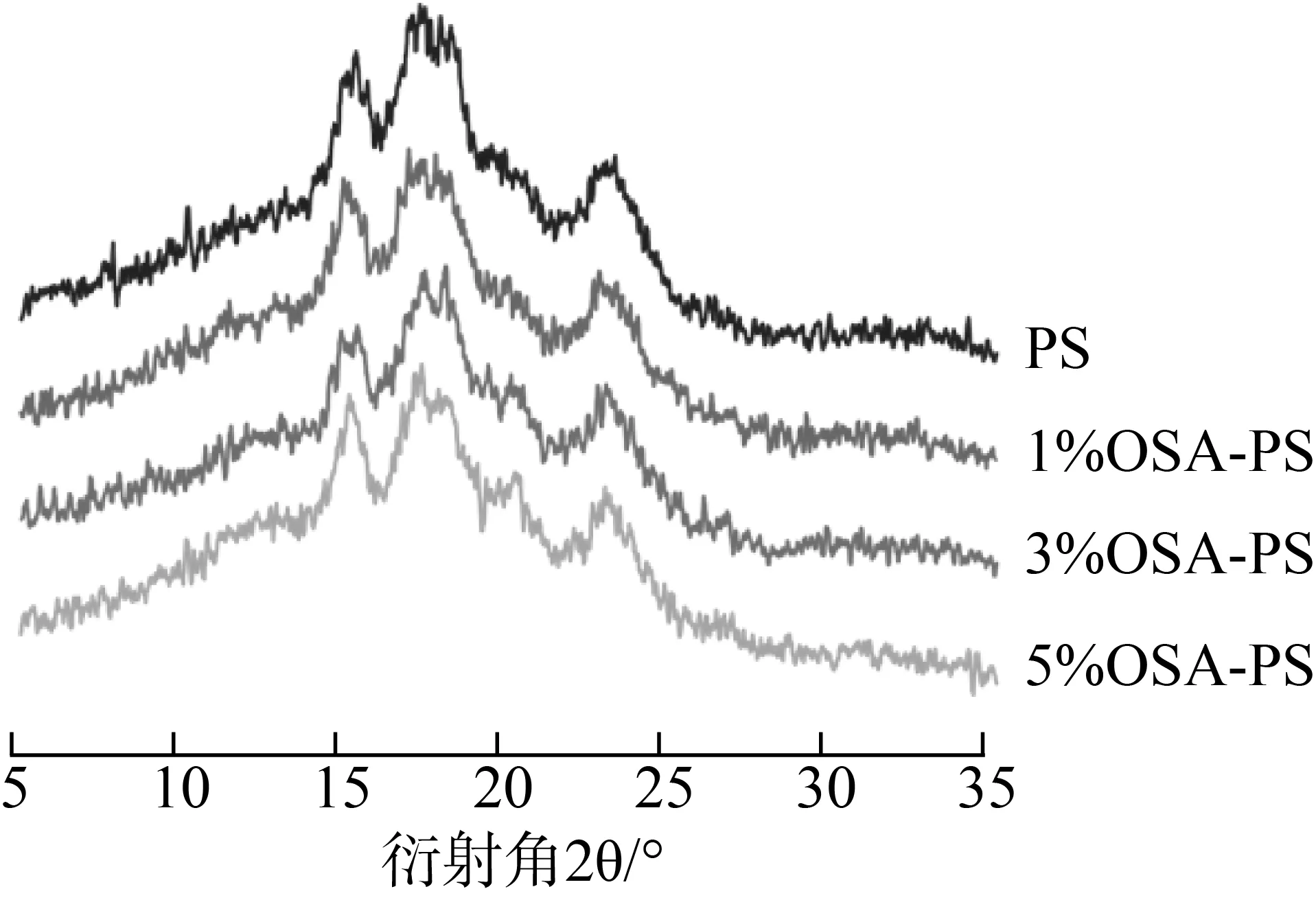
图4多孔淀粉和OSA改性多孔淀粉的X衍射图谱
2.2.5 热重分析(TGA-DTA)
OSA改性淀粉的热特性TGA和DTG曲线如图5所示。由图5a可见,所有样品的TGA曲线中观察到两个阶段的质量损失。第一阶段发生在120 ℃以下,这是由水蒸发引起的质量损失约8%。第二阶段,即主要的质量损失(约76%),多孔淀粉发生在270 ℃,归因于淀粉分解,而OSA改性多孔淀粉显示出不同的模式,在较低温度下开始(分别为253、250、229 ℃)[27]。此外,由图5b可知,多孔淀粉,OSA改性多孔淀粉的最大热分解温度分别为325、321、316、311 ℃,且随DS增加,最大热分解温度降低。结果表明,酯化过程降低了热降解的初始温度以及淀粉的热稳定性[28]。
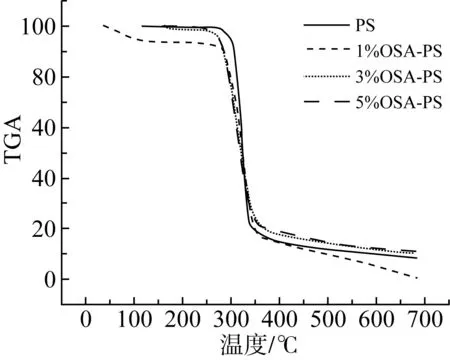
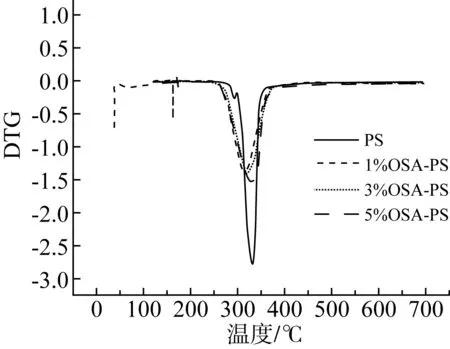
图5多孔淀粉和OSA改性多孔淀粉的TGA和DTG曲线
2.3 乳化稳定性分析
从图6可看出,静置30 min后,多孔淀粉形成的乳液出现较明显的分层现象,主要是由于多孔淀粉不溶于水且不具有乳化作用。OSA改性多孔淀粉中,1%OSA-PS由于所含OSA浓度小,乳化效果不明显,而3%和5%的OSA-PS可以自由悬浮,形成稳定的乳液,表明3%OSA-PS和5%OSA-PS具有良好的乳化性和乳化稳定性。

图6多孔淀粉和OSA改性多孔淀粉的乳化稳定性比较
3 结论
淀粉的多孔结构会影响OSA改性淀粉的DS,随着OSA浓度的增加,DS也随之增加,并赋予OSA改性淀粉更大的乳化性和乳化稳定性;OSA与淀粉之间形成酯键,但并不会破坏多孔淀粉孔结构和淀粉的晶型结构,改性主要发生在无定形区,OSA改性多孔淀粉后热稳定性降低。

