真核起始因子3e亚基与原发性肝细胞癌的发生与发展正相关
张 珊,陈忠伟,孟诗敏,丁庆林,钟自彪,魏艳红,叶啟发,胡康洪
张珊,陈忠伟,孟诗敏,丁庆林,魏艳红,胡康洪,湖北工业大学生物工程与食品学院湖北省工业微生物重点实验室中德生物医学中心 教育部及国家外专局“细胞调控与分子药物学科111创新引智基地” 湖北省武汉市 430068
钟自彪,叶啟发,武汉大学肝胆疾病研究院 武汉大学中南医院 湖北省武汉市 430071
0 引言
据国际癌症研究机构统计,原发性肝细胞癌(primary hepatocellular carcinoma,HCC)是全世界致死率高居第二位的恶性肿瘤,在我国发病率仅次于肺癌和胃癌[1].HCC恶性程度高,浸润和转移性强,发病时症状隐匿.在多数情况下,HCC在中晚期才被诊断出来,并且HCC患者的预后较差,其5年生存率不到5%.传统治疗手段包括手术切除、肝移植、经导管动脉化学栓塞、放化疗等,治疗效果和预后欠佳.因此,急切需要寻找药物干预新靶点,用于肝癌治疗,从而降低死亡率和医疗费用.目前,虽然以索拉非尼为代表的一批分子靶向药物的面世改善了肝癌高死亡率的严峻形势[2],但随着患者对药物耐受力的降低及耐药问题的出现,迫切需要疗效更好、副作用小的新药出现.总之,发现药物干预新靶点,一直以来都是一个极为重要的临床关切.
真核起始因子3 (eukaryotic initiation factor 3,eIF3)是一个800 kDa的分子,是真核起始因子家族中最大的调节蛋白复合物,由13个亚基组成,从eIF3a到eIF3m命名,是哺乳动物细胞中最复杂的翻译起始因子.通过控制细胞内蛋白质的合成,eIF3发挥调节细胞生长、增殖等重要功能.在eIF3的13个亚基中,真核起始因子3e亚基(eukaryotic initiation factor 3e subunit,eIF3e)是p48亚基,为细胞内mRNA 5’帽子依赖的翻译起始所必需.有报道eIF3e失调虽然不直接引发癌症,但却与癌症的发生和发展密切相关[3].在体内,eIF3e与eIF4G相互作用,且这种相互作用依赖于eIF3e的正常表达; 一旦eIF3e异常表达,会改变eIF3e-eIF4G互作,进一步损伤细胞内解旋的mRNA募集43S翻译前启动复合物,从而刺激mRNA的翻译模式从5’帽子依赖的方式向5’帽子不依赖的方式转换,最终使蛋白质合成和细胞生长发生紊乱[3].然而,eIF3e在恶性肿瘤中的作用在不同类型的肿瘤中的报道相互矛盾.在乳腺癌和肺癌中,eIF3e作为肿瘤抑制因子其表达水平降低,推测下调后的eIF3e通过TGF-β信号通路导致上皮细胞向间充质细胞转化(epithelialmesenchymal transition,EMT)[4,5].相反,在胶质母细胞瘤和结肠癌以及食道癌中,eIF3e被证明过度表达,其通过缺氧诱导因子促进肿瘤进展,且持续高表达的eIF3e与不良预后相关[6-8].迄今为止,eIF3e在HCC中的作用尚未公布.
因此,为了验证eIF3e是否与HCC发生发展相关,我们先通过手术切除的肝脏组织水平验证,再运用细胞模型改变eIF3e的表达水平,对细胞的增殖、迁移、凋亡等行为以及动物中致瘤的影响进行系统地调查.所取得的结果显示,eIF3e与肝癌发生和发展密切正相关,可能是HCC干预新靶点,该工作对于癌症的治疗或诊断及预后具有潜在的临床意义.
1 材料和方法
1.1 材料 组织标本来源: 5例HCC病人施肝移植手术后的新鲜肝癌组织及癌旁组织标本由武汉大学中南医院肝胆疾病研究院提供,并经过当事人签署知情同意书.癌旁组织预先通过免疫组化分析检测,显示为不含肿瘤细胞的正常肝组织.
1.2 方法
1.2.1 过表达质粒和干扰质粒的构建: 载体pcDNA3.1经Xho Ⅰ和Hind Ⅲ双酶切后,与预先PCR扩增的目的基因eIF3e (NM_001568.3)连接,构建成重组质粒pcDNA3.1-eIF3e,用于eIF3e在细胞中的过表达.
设计一对干扰eIF3e的序列,以及一对无关序列作为干扰的阴性对照,见表1.所设计的一对寡核苷酸链,每条均为60 nt,5’端和3’端分别含Bgl Ⅱ和Hind Ⅲ酶切位点,便于与pSuper载体连接.5’端19 nt的编码序列与靶基因同源,是干扰正义序列; 另一段19 nt的序列与其反向互补,是干扰反向序列,正义序列和反向序列在表1中以加粗标示,其间有9 nt的TTCAAGAGA间隔序列形成环状结构,末端加有转录终止信号TTTTT.具有上述结构特征的二条互补的寡核苷酸链经退火、磷酸化后形成双链DNA,然后定向插入预先经Bgl Ⅱ和Hind Ⅲ双酶切的含H1启动子的pSuper载体中,构建成pSupersheIF3e,该质粒在细胞内经转录后形成RNA自身发卡环,经Dicer酶切为siRNA发挥干扰作用.无关干扰序列构建的质粒为pSuper-Sn (pSuper-scramble),作为干扰的阴性对照组.
1.2.2 细胞培养和转染: 正常肝细胞系HL7702和二种肝癌细胞系HepG2及Huh7购自美国模式培养物集存库,并在含10%胎牛血清(Gibco,美国)的DMEM培养液(Gibco,美国)中生长,37 ℃,5%CO2细胞培养箱中培养.
用Lipofectamine 2000 (Invitrogen,美国)试剂盒将质粒瞬时转染导入细胞.转染pcDNA3.1-eIF3e 24 h、48 h、72 h后检测细胞内eIF3e蛋白表达的上调情况,转染pSuper-sheIF3e 24 h、48 h、72 h后检测细胞内其表达水平的下调情况.
为了获得稳定转染eIF3e的HepG2即eIF3e-HepG2,用含G418培养液筛选阳性细胞克隆子.按以上瞬时转染方法,先将含neo标记的pcDNA3.1-eIF3e加入培养24 h以上75%汇合度的HepG2中后,以500 μg/mL G418筛选2 wk,待对照组细胞全部死亡后,将G418浓度降至200 μg/mL维持筛选.挑选阳性克隆子扩大培养,抽提细胞RNA进行qRT-PCR,鉴定eIF3e的表达情况.该稳转细胞克隆子用于后续的裸鼠成瘤实验.

表1 引物序列表
1.2.3 RNA提取和qRT-PCR分析: RNA的提取: 根据供应商(Invitrogen,美国)提供的方法,使用Trizol试剂从病人手术切除的新鲜组织或细胞中提取总RNA.qRT-PCR分析: 使用Primescript RT试剂盒(Takara,日本)制备cDNA,进行PCR扩增.根据LightCycler®96实时PCR系统(Roche,瑞士)的标准协议,使用SYBR premix ex TAQ Ⅱ (Takara,日本)进行实时定量分析.以β-actin作为内部参比,将2-△△CT值归一化为β-actin.eIF3e的引物序列和β-actin的引物序列见表1,所有引物均由武汉Quintarabio公司化学合成.
1.2.4 Western Blot: 细胞裂解获取总蛋白质,采用分离胶为10%,浓缩胶为5%的SDS-聚丙烯酰胺凝胶电泳.用半干转移法将蛋白质样品转移至聚二氟乙烯膜上,使用1:300倍稀释的山羊抗兔eIF3e一抗(Abcam,英国) 4 ℃过夜孵育,随后用1:3000倍稀释的山羊抗兔IgG (H+L)二抗继续室温孵育1 h,最后用ECL免疫印迹试剂盒(Biorad,美国)成像曝光,用条带密度分析软件Image J对信号进行半定量分析.
1.2.5 细胞增殖、迁移和凋亡: 细胞增殖采用CCK-8法检测瞬时转染质粒24 h、48 h、72 h后在450 nm的OD值; 细胞迁移在转染质粒0 h、24 h、48 h、72 h后,采用划痕试验法,用软件自动测量划痕区域细胞迁移的距离,计算迁移率.划痕距离测量为等效测量,划痕宽度平均值=划痕空隙面积/长度.细胞迁移率=(0 h划痕宽度-N h培养后划痕宽度)/0 h划痕宽度×100%,N在本实验中分别代表24 h、48 h、72 h; 细胞凋亡选用Annexin V-FITC/PI双染细胞凋亡检测试剂盒 (凯基生物,产品编号KGA106,中国江苏),使用流式细胞仪(BD Accuri C6,BD Biosciences,美国)进行凋亡检测.
1.2.6 裸鼠皮下成瘤实验: BALB-c/c裸小鼠购自北京维通利华实验动物技术有限公司,动物实验方案预先经湖北工业大学动物伦理委员会批准.以eIF3e-HepG2为实验组,普通HepG2为对照组,皮下成瘤实验评价eIF3e对裸鼠肿瘤生长的影响.将5周龄、体重18-20 g的雄性BALB/c裸鼠按以上二种不同细胞分为二个处理组,每组14只小鼠,每只动物腹股沟部位接种0.1 mL 1×106-5×106处于对数生长期80%-90%汇合度的细胞.从第6天起从每组随机挑取3只小鼠,颈椎离断处死,分别测量和比较新生肿瘤的重量和体积; 每间隔6 d取一次样,至第24天结束,共计4次.24 d内,每组均有2只小鼠在不同时间死亡,统计数据时将其排除,每组实际统计12只小鼠数据,共24只.
统计学处理采用Prism 7图形软件(GraphPad软件公司,美国)整理实验数据,使用SPSS 19.0 (IBM,美国)进行统计分析,所有结果均为三次独立实验的平均值,结果为mean±SD,所有组之间的比较采用未配对学生t检验或单因素方差分析,P<0.05差异具有统计学意义,P<0.01差异显著.
2 结果
2.1 肝癌组织及肝癌细胞系中均发现内源性eIF3e表达上调 表2总结了5例施行肝移植手术的HCC病人的基本临床特征.用qRT-PCR检测肝癌组织和癌旁组织内eIF3e的mRNA水平,以及正常肝细胞系HL7702和二种肝癌细胞系HepG2及Huh7内eIF3e的mRNA水平,见图1A和图1B.从图1A结果看,5例病人肝癌组织内elF3e的mRNA量均高于癌旁组织内elF3e的mRNA量,最低者高出约30% (第3例病人),最高者是癌旁组织的3.1倍(第4例病人).5例肝癌组织中elF3e的mRNA量比癌旁组织内elF3e的mRNA量平均高出约2倍(第1例至第5例病人肝癌组织内elF3e的相对mRNA量(2.3+1.5+1.3+3.1+1.7)/5=1.98).图1B结果与图1A组织中的结果一致,二种肝癌细胞系HepG2及Huh7内elF3e的mRNA量均高于正常肝细胞系HL7702内elF3e的mRNA量,其中HepG2最高.HepG2中elF3e的mRNA量约为HL7702中elF3e mRNA量的1.8倍,Huh7中其mRNA量约为HL7702中的1.2倍.由于HepG2中eIF3e内源性表达水平稍高,在随后的实验中,我们以HepG2作为细胞模型进一步开展调查.

表2 5例施行肝移植手术的原发性肝细胞癌病人的基本临床特征
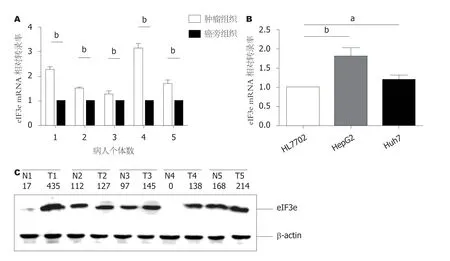
图1 肝癌组织和癌旁组织以及肝癌细胞系和正常肝细胞系中内源性eIF3e mRNA相对转录率及其表达水平的比较.A:qRT-PCR分析和比较5例病人新鲜肝癌组织(左)及癌旁组织(右)内elF3e mRNA相对转录水平.将每个病人自身的肝癌组织和癌旁组织分为一组,每组中癌旁组织内mRNA定量数据设置为1; B:qRT-PCR分析和比较正常肝细胞系HL7702和二种肝癌细胞系HepG2及Huh7内源性elF3e mRNA相对转录水平.将HL7702的mRNA定量数据设置为1.A和B的结果均以β-actin作为内部参比进行了校正,结果是三次独立实验的平均值(aP<0.05,bP<0.01); C:Western Blot分析和比较5例HCC组织(T)及癌旁组织(N)内eIF3e蛋白表达水平.N和T后面的数字相同则表示同一位病人,N与T之间的短线表示总是以相同病人的N和T二者的数据进行比较.N和T下面所列数字为对应Western Blot条带强度的量化值,分别以β-actin作为内部参比进行了校正.
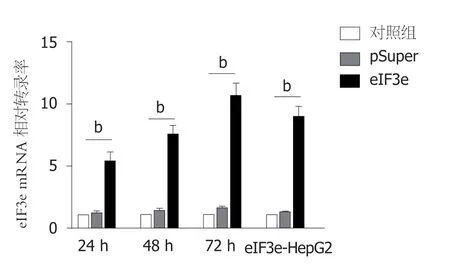
图2 qRT-PCR分析和比较瞬时转染pcDNA3.1-eIF3e不同时间后HepG2以及稳转细胞eIF3e-HepG2内eIF3e mRNA相对转录水平.加入等量脂质体转染试剂但未转染任何质粒的HepG2为对照组,其mRNA定量数据设置为1; 转染空载体pSuper的处理组为零对照组.以上结果以β-actin作为内部参比进行了校正,结果是3次独立实验的平均值(bP<0.01).
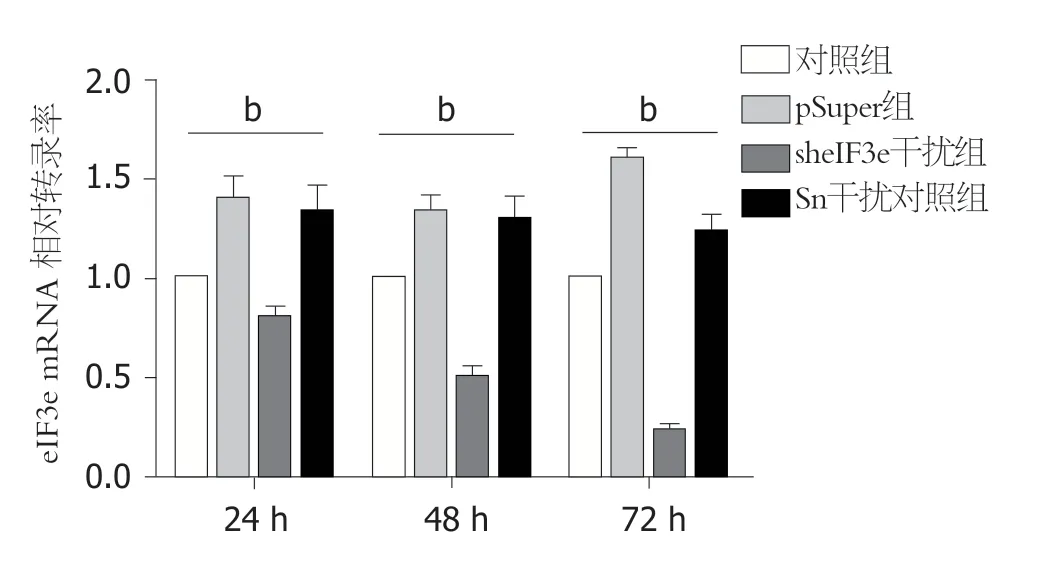
图3 qRT-PCR分析和比较瞬时转染pSuper-sheIF3e不同时间后HepG2细胞内eIF3e mRNA相对转录水平.加入等量脂质体转染试剂但未转染任何质粒的HepG2为空白对照组(Mock),其mRNA定量数据设置为1; 转染空载体pSuper的处理组为零对照组; Sn为无关干扰的阴性对照组.以上结果以β-actin作为内部参比进行了校正,结果是三次独立实验的平均值(bP<0.01).
对上述5例HCC病人手术后的HCC组织及癌旁组织同样开展Western Blot分析,比较HCC组织和癌旁组织eIF3e蛋白表达水平的差异,结果见图1C.观察到此5例病人HCC组织T中的eIF3e表达量均高于癌旁组织N中相应表达量.其中第1例病人和第4例病人最为明显,HCC组织中该蛋白表达量比癌旁组织中分别高出25倍(T1:N1=435:17)及138倍(T4:N4=138:0); 第2例病人二者差异为1.1 (T2:N2=127:112),第3例差异为1.5 (T3:N3=145:97),第5例1.3 (T5:N5=214:168).
2.2 eIF3e表达水平与HepG2增殖和迁移正相关 用qRTPCR及Western Blot定量检测转染质粒的细胞内elF3e转录水平和表达水平的变化.瞬时/稳定转染含eIF3e的过表达质粒pcDNA3.1-eIF3e或能特异性沉默eIF3e的干扰质粒pSuper-sheIF3e进入HepG2,验证细胞内eIF3e表达水平是否改变.
实验结果如图2所示.瞬时转染24 h、48 h、72 h后,或对于稳定转染eIF3e的细胞eIF3e-HepG2,用qRTPCR检测各组细胞内eIF3e mRNA的转录水平.从图2中可以看出,在转染24 h后,含eIF3e质粒的过表达组该基因mRNA相对表达量为空白对照组的5倍; 转染48 h后eIF3e过表达组上调了7.5倍; 72 h后eIF3e过表达组上调超过10倍; 稳转细胞eIF3e-HepG2内eIF3e mRNA的转录水平略低于10倍,结果高于瞬时转染48 h的但略低于72 h的.该结果说明,无论瞬时转染或是稳定转染pcDNA3.1-eIF3e后,细胞内eIF3e转录水平均明显上调,而且瞬时转染72 h后eIF3e的mRNA量与对照组差别达到最大,转录水平上升最多.
从图3可以看出,转染24 h后,eIF3e干扰组mRNA水平略低于细胞空白对照组; 转染48 h后,eIF3e干扰组mRNA水平与细胞空白对照组相比下降了一半; 转染72 h后,eIF3e干扰组mRNA与对照组相比仅剩余0.3,下降了70%,同时,空载体pSuper组和无关干扰Sn组mRNA表达量和细胞空白对照组相比在这三个时间段变化不大.综合实验结果,说明干扰质粒转染后,沉默eIF3e效果是明显的,且随着时间的推移下调程度越来越大,至72 h抑制程度最大.
由于72 h后的检测结果最好,接下来用Western Blot检测不同质粒瞬时转染72 h后HepG2细胞内的eIF3e蛋白表达水平,结果见图4.以加入等量脂质体转染试剂但未转染任何质粒的HepG2为空白对照组,将其Western Blot结果设置为100,发现pcDNA3.1及pSuper二组空载体组、以及Sn无关干扰组与空白对照组中的eIF3e条带相当(102:103:98:100); pcDNA3.1-eIF3e过表达组中eIF3e条带是空白对照组中相应条带的3倍(298:100),而sh eIF3e干扰组中该条带仅是空白对照组中相应条带的68%,下降了32%.以上结果证明对eIF3e的过表达和干扰均成功.
分别用pcDNA3.1-eIF3e或pcDNA3.1-sheIF3e瞬时转染肝癌细胞系HepG2,以空载体pcDNA或pSuper以及无关干扰载体pSuper-Sn作对照,用CCK-8法检测HepG2中eIF3e表达的变化对细胞增殖的影响.实验结果见图5.实验设置分组,分别在转染24 h、48 h和72 h后检测HepG2的增殖情况,结果用OD450nm值表示.图5A为转染pcDNA3.1-eIF3e质粒和空载质粒pcDNA3.1后24 h至72 h的HepG2增殖情况.从图中可以看出,eIF3e过表达组相较于空载体对照组,在第48 h和72 h,对HepG2增殖有一定的促进作用.图5B为转染pSuper-sheIF3e干扰质粒,pSuper空载体和Sn质粒后24 h至72 h的HepG2增殖情况,从中可以看出,干扰eIF3e的表达组相比较于空载体组和无关干扰对照组,48 h和72 h后,对HepG2细胞的增殖有一定的抑制作用.因此可以得出结论,在HepG2细胞中,过表达eIF3e可以促进HepG2细胞增殖,干扰eIF3e的表达则起到抑制增殖的相反作用.
分别用pcDNA3.1-eIF3e或pSuper-sheIF3e瞬时转染HepG2,以空载体pcDNA或pSuper为零对照,以无关干扰载体pSuper-Sn作阴性对照,用划痕法检测在HepG2中eIF3e表达的变化对细胞迁移的影响.实验结果如图6,7.图6为瞬时转染eIF3e过表达质粒pcDNA3.1-eIF3e与空载质粒pcDNA3.1后进行细胞划痕实验,分别在0 h、24 h、48 h和72 h用倒置显微镜下观察并拍照记录细胞的迁移情况,从图6A细胞原始迁移图以及图6B细胞迁移率统计结果图中,均观察到从24 h起过表达eIF3e促进HepG2细胞迁移,且这种差距在48 h和72 h一直维持.eIF3e组:pcDNA3.1对照组迁移率分别为: 24 h后8.1%:5.4%,48 h后14.3%:8.7%,72 h后22.3%:11.8%.图7为转染空载质粒pSuper、干扰质粒pSuper-sheIF3e,以及无关干扰质粒Sn的结果.同样在0 h、24 h、48 h和72 h后用倒置显微镜下观察并拍照记录细胞的迁移情况.从图7A细胞原始迁移图以及图7B细胞迁移率统计结果图中,均观察到从24 h起干扰质粒sheIF3e组细胞迁移率与空载体组和无关干扰组相比较变慢,且这种差距自48 h和72 h变得明显.sheIF3e组:Sn组:pSuper组迁移率分别为: 24 h后9.4%:11.0%:11.3%,48 h后13.7%:18.7%:15.6%,72 h后17.3%:22.4%:21.3%.结果说明干扰eIF3e的表达能抑制HepG2细胞的迁移.
综合以上实验结果可以发现: eIF3e表达水平与HepG2增殖和迁移正相关,上调eIF3e促进HepG2增殖和迁移,下调eIF3e则抑制其增殖和迁移.

图4 Western Blot分析瞬时转染不同质粒72 h后HepG2细胞内eIF3e蛋白的表达水平.对照组:加入等量脂质体转染试剂但未转染任何质粒的HepG2为空白对照组; 空载体pcDNA3.1和pSuper:零对照组; eIF3e:过表达组; sheIF3e:干扰组; Sn:无关干扰组.所列数字为对应条带强度的量化值,将空白对照组设置为100,分别以β-actin作为内部参比进行了校正.
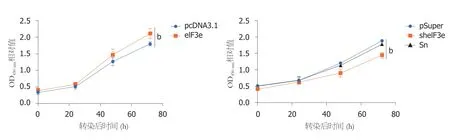
图5 CCK-8法分析eIF3e表达的变化对细胞增殖的影响.A:过表达质粒eIF3e瞬时转染HepG2细胞后,eIF3e表达的变化对细胞增殖的影响; B:干扰质粒sheIF3e瞬时转染HepG2细胞后,eIF3e表达的变化对细胞增殖的影响.空载体pcDNA3.1(A)或pSuper(B):对照组; Sn:无关干扰组.图中显示瞬时转染质粒24 h、48 h、72 h后的各组细胞OD450nm吸收值的变化趋势,每个处理组设置3个重复样品,结果是三次独立实验的平均值(bP<0.01).
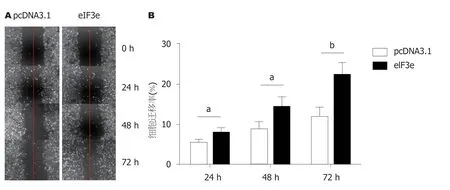
图6 划痕法分析过表达质粒eIF3e瞬时转染HepG2不同时间后,eIF3e表达上调对细胞迁移的影响.A:pcDNA3.1空载体转染的对照组(左)与eIF3e过表达转染组(右)的细胞原始迁移图; B:是将A的原始迁移数据转换为细胞迁移率后的比较图.每个处理组设置3个重复样品,结果是三次独立实验的平均值(aP<0.05,bP<0.01).
2.3 敲低eIF3e表达水平后促进HepG2凋亡 实验设置为过表达组(图8A)和干扰敲低组(图8B)共二个组.对于A组,以加入等量脂质体转染试剂但未转染任何质粒的HepG2为空白对照组,以转染空载体pcDNA的为零对照组.对于B组,以pSuper作零对照组,Sn干扰的阴性对照组.用流式分选法检测不同质粒转染72 h后HepG2中eIF3e表达的变化对细胞凋亡的影响.用Annexin V-FITC/PI染色细胞48 h后观察凋亡结果,二组结果见图8A和8B.
从图8A中发现,eIF3e过表达组的细胞凋亡情况,与不加质粒的HepG2及空载体pcDNA3.1二个对照组相比较,基本没有差别.右上角Q1-UR第二象限方框中代表双染色阳性死细胞比例,eIF3e:HepG2:pcDNA3.1三组分别为1.4%:1.0%:2.8%,数据差别无统计学意义,说明上调eIF3e表达水平后对HepG2细胞凋亡没有影响.
与此相对照,图8B却显示,sheIF3e实验组与pSuper和Sn二个对照组相比较,细胞凋亡明显增多: 观察右上角Q1-UR方框内死细胞比例,pSuper组1.8%,Sn组2.3%,sh eIF3e组上升至13.2%,是二种对照组的6-7倍,数据差别有统计学意义,说明下调eIF3e表达水平后促进HepG2细胞凋亡.
2.4 动物实验证实eIF3e促进肿瘤生长 运用裸鼠皮下成瘤实验评价eIF3e对肿瘤生长的影响,二组动物分别接种HepG2 (对照组)和eIF3e-HepG2 (实验组).
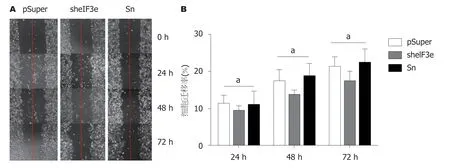
图7 划痕法分析干扰质粒sheIF3e转染HepG2不同时间后,eIF3e表达下调对细胞迁移的影响.A:pSuper空载体组(左)、eIF3e干扰组(中)及无关干扰组(右)的细胞原始迁移图; B:将A的原始迁移数据转换为细胞迁移率后的比较图.每个处理组设置3个重复样品,结果是三次独立实验的平均值(aP<0.05).
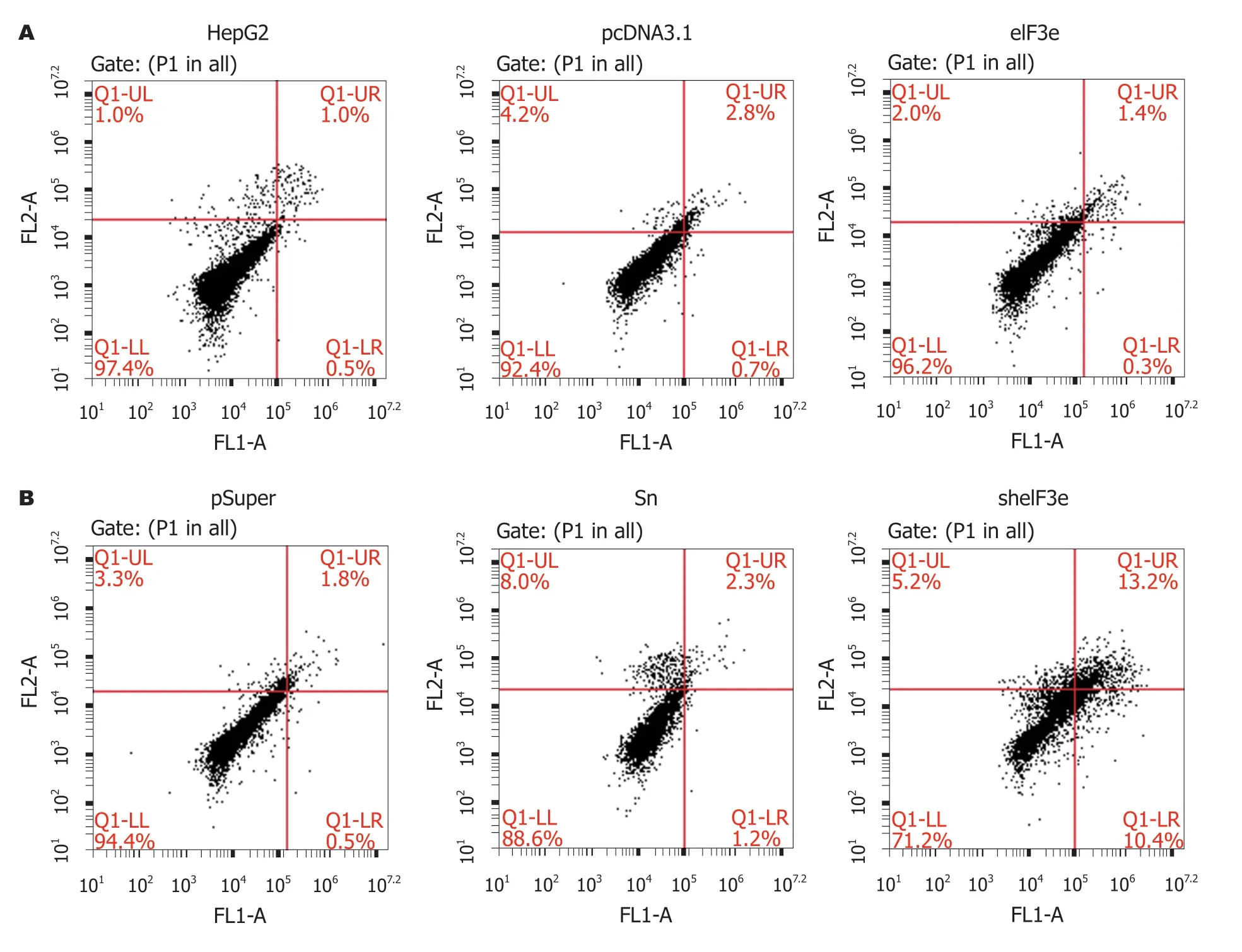
图8 Annexin V-FITC/PI法评价eIF3e表达水平的变化对HepG2细胞凋亡的影响.A:eIF3e过表达组中eIF3e表达水平的变化对HepG2细胞凋亡的影响; B:eIF3e干扰组中eIF3e表达水平的变化对HepG2细胞凋亡的影响.横坐标代表FITC染色细胞数,纵坐标代表PI染色细胞数.每个处理组设置3个重复样品,以上结果是三次独立实验的代表性数据.
图9结果显示,从第6天起,eIF3e-HepG2组的平均肿瘤体积和重量就大于对照组,且这种差距随后进一步拉大,第24天eIF3e-HepG2组平均肿瘤达到2000 mm3和2300 mg,而对照组平均值仅为700 mm3和770 mg,二者相差近3倍,显示eIF3e过表达后促进肿瘤生长.
3 讨论
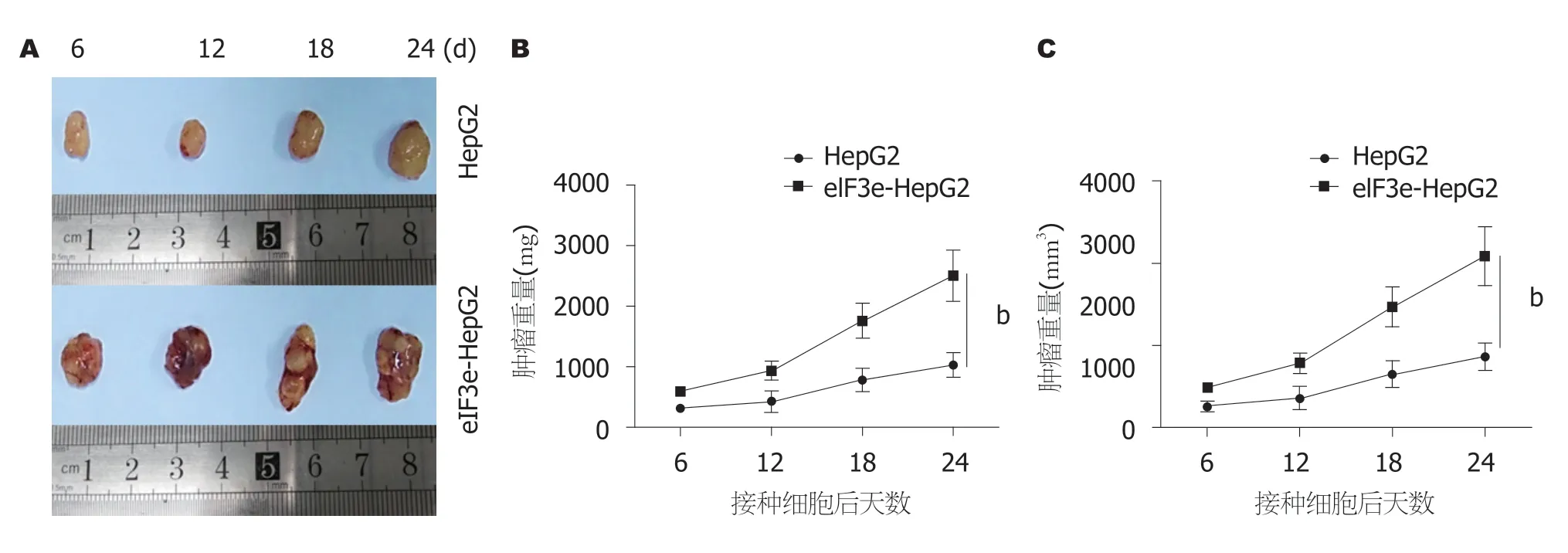
图9 裸鼠皮下成瘤实验结果.A:5周龄、体重18-20 g的雄性BALB/c裸小鼠分为二组,分别皮下接种HepG2及eIF3e-HepG2二组细胞,每只小鼠接种1×106-5×106细胞,从第6天起,每隔6 d从每组中随机颈椎离断处死3只小鼠摘瘤,24 d后汇集4次摘除的肿瘤,按组别分类,取代表性样本按时间顺序由左至右摆放,下置游标卡尺直观地显示肿瘤体积大小; B,C:接种细胞第6、12、18、24天后测量肿瘤的重量和体积,绘制肿瘤生长趋势图.每次结果是同组3个肿瘤数据的平均值(bP<0.01).
HCC是最常见的癌症类型,在与癌症相关的死亡率中,HCC排名第二位[10-13],2012年全球估计有746000例死亡[14].据估计,每年HCC发病率在60万至80万之间,占所有人类癌症的5.6%,预计到2030年将达到约一百万例[15].在发展中国家,HCC的地域差异很大,超过80%的HCC发生在亚洲和撒哈拉以南非洲[16].尽管如此,在美国和其他发达国家,HCC的发病率仍在上升[10].与HCC相关的危险因素包括慢性HBV和HCV感染、酒精性肝病和非酒精性脂肪肝[16].据2015年中国各类肿瘤发病率和死亡率统计,我国肝癌的年死亡率为466.1/100000人,在恶性肿瘤死亡顺位中占第3位,在城市中仅次于肺癌,农村中仅次于胃癌和食管癌[17].早期肝癌的治疗选择包括: 手术切除,射频/微波消融,经动脉化学栓塞,肝移植以及化疗[14].然而,治愈性治疗的主要挑战是肝癌的复发,导致其在5年内的发生率超过70%[13],并且无法获得适当匹配的供体进行肝移植[14].此外,在无法切除的复发性基础肝功能不全患者中,全身化疗无效,生存率低[13].由于目前临床上越来越多的患者对以索拉非尼为代表的一批常见药物的耐受力降低并出现耐药问题,迫切需要探索治疗干预新靶点从而发现新药,该工作具有重要的科学意义和临床价值.
eIF3e是eIF3复合物的组分,为调节蛋白质合成的翻译起始所必需,它在蛋白质合成机制和翻译控制中的改变可导致特异性mRNA的选择性翻译,其促进肿瘤细胞存活、血管生成、转化、侵袭和转移[18].翻译起始因子在功能上也与癌基因相互作用,并且通常是构成大多数人类癌症的信号转导途径的主要目标[18].因此,翻译控制在癌症发展的复杂机制中起着关键作用.
近年陆续有报道eIF3e在不同类型的恶性肿瘤中发挥作用,但其究竟是致癌基因还是抑癌因子仍有争议[4-8].迄今为止,eIF3e在HCC中的作用尚不清楚.本论文通过组织水平、细胞模型和动物实验首次系统地调查了eIF3e在HCC发生和发展中的作用,发现该基因的表达与HepG2增殖、迁移等行为正相关.值得注意的是,我们发现下调eIF3e表达后促进凋亡,但上调其表达后视乎对HepG2凋亡无影响.这种情况在真实的体内是可能存在的,既某种原癌基因的表达对细胞凋亡的影响并不是双向调节的.HCC的发生和发展涉及多种基因、转录本和蛋白质的相互作用及调控.从单个基因的角度来看,某个基因的表达量的改变只能对肝癌发生发展的局部作出解释,而无法从整体行为进行因果关系的推理,必须看到疾病进展过程中多种基因协调作用而产生的高度复杂的网络调控.另外,由于本研究仅运用了Annexin V法评价细胞凋亡行为,方法学上显得比较单一,尚不能确切地定论eIF3e过表达后不影响细胞凋亡,如今后结合TUNEL法、Caspase-3活性检测法或荧光显微镜观察细胞核中DNA形态是否形成凋亡小体,则可以对该基因是否影响细胞凋亡行为作一客观评价.同时,毕竟要看到本研究采用的HepG2是一个过分简化的体外细胞模型,其与人体内HCC在病理生理学方面仍存在较大差距,这也是本工作的局限性.通过小鼠或土拨鼠等动物模型进一步研究eIF3e在HCC中的作用,并揭示相关机理,代表了未来研究的方向.
肿瘤细胞的增殖受多种信号通路影响,目前我们的研究还无法确定eIF3e引起的细胞增殖、迁移、凋亡等行为的改变与信号通路的详细关系.eIF3复合物在肿瘤上的功能已被广泛研究,其中eIF3e亚基是影响癌症发生和发展的重要因素[19].Desnoyers等[4]人进一步证明,肺和乳腺上皮细胞中eIF3e表达水平降低后能激活TGF-β信号通路而导致EMT.以斑马鱼为模式生物,通过遗传学和化学遗传学方法,eIF3e被确定为MEK-ERK信号通路的组织特异性调节剂[20].用siRNA沉默eIF3e表达后,细胞中MEK蛋白水平降低.MEK是一种双重特异性激酶,位于Ras和Raf的下游,通过关键的酪氨酸和苏氨酸残基的磷酸化进一步激活ERK1/2[21].MEK-ERK途径的异常调节可导致不受控制的细胞生长并导致恶性转化[22],靶向MEK-ERK途径的小分子是治疗癌症的潜在方法[23,24].在今后研究中,我们将着重研究在动物模型和人体组织内,eIF3e通过哪些信号通路推动HCC发生和发展,这对于了解HCC致病机理,寻找HCC治疗干预新靶点,均具有十分积极的意义.
文章亮点
实验背景
原发性肝细胞癌(primary hepatocellular carcinoma,HCC)恶性程度高,浸润和转移性强,发病时症状隐匿.在多数情况下,HCC在中晚期才被诊断出来,预后较差,现有治疗手段效果欠佳.因此,急切需要寻找药物干预新靶点.真核起始因子3e亚基(eukaryotic initiation factor 3e subunit,eIF3e)是eIF3的13个亚基中的一个,为细胞内mRNA 5’帽子依赖的翻译起始所必需.有报道eIF3e表达失调与癌症的发生和发展密切相关,但在不同类型的恶性肿瘤中eIF3e所发挥的作用相互矛盾.迄今eIF3e在HCC中的作用尚不清楚.
实验动机
本工作首次运用组织标本、肝癌细胞系模型以及裸鼠实验,系统地调查eIF3e在HCC发生和发展中的作用.
实验目标
先通过手术切除的肝癌组织水平验证,再运用HepG2细胞模型改变eIF3e的表达水平,对细胞的增殖、迁移、凋亡等行为进行系统评估.最后,开展裸鼠致瘤实验观察eIF3e对肿瘤生长的影响.
实验方法
随机采集5例实施肝移植手术的HCC病人的新鲜肝癌组织及癌旁组织,用qRT-PCR和Western Blot分析和比较组织内eIF3e的mRNA转录水平和蛋白表达水平.瞬时转染pcDNA3.1-eIF3e或pSuper-eIF3e进入HepG2,用qRT-PCR及Western Blot分别验证细胞内eIF3e mRNA转录和蛋白表达水平的变化,证实其过表达上调和干扰后的下调.分别采用Kit-8细胞计数法、划痕法和Annexin V-FITC/PI双染细胞流式分析评价eIF3e表达水平的变化对HepG2增殖、迁移、凋亡的影响; 运用裸鼠成瘤实验评价eIF3e对肿瘤生长的影响.
实验结果
发现肝癌组织及肝癌细胞系HepG2和Huh7中eIF3e表达水平均明显上升.过表达质粒和干扰质粒分别瞬时转染HepG2后,发现eIF3e表达升高后增强HepG2增殖和迁移,但不影响凋亡; 而eIF3e表达降低后抑制HepG2增殖和迁移,促进凋亡.体内某种原癌基因的表达对细胞凋亡的影响可能并不是双向调节的,HCC的发生和发展涉及多种基因、转录本和蛋白质的相互作用及调控,单个基因的表达量改变只能对肝癌发生和发展的局部作出解释,而无法从整体行为进行因果关系的推理,必须看到疾病进展过程中多种基因协调作用而产生高度复杂的网络调控.另外,本研究仅运用了Annexin V-FITC/PI法评价细胞凋亡,方法学上显得比较单一,尚不能确切地定论eIF3e过表达后不影响细胞凋亡.最后,裸鼠实验证实,和HepG2对照组比较,持续表达eIF3e的稳转细胞系eIF3e-HepG2促进肿瘤生长.
实验结论
本研究初步发现过表达eIF3e与HCC的发生和发展正相关,这将对HCC诊断、预后及寻找药物治疗的新靶点提供线索.
展望前景
本研究仅采集5例HCC病人肝癌组织标本分析,样本量有限; 另外,采用的HepG2毕竟是一个过分简化的体外细胞模型,其与人体内HCC在病理生理学方面仍存在差距.未来需要通过大规模HCC组织标本分析及动物实验,进一步验证eIF3e在HCC发生和发展中的作用,并揭示相关分子机理,以探究该基因是否能提示诊断和预后,或作为药物干预的新靶点.
——一道江苏高考题的奥秘解读和拓展

