基于综合素质培养的高分子综合实验设计与探索
王士凡,么 冰,董黎明,朱文友,堵锡华
(徐州工程学院材料与化学工程学院,江苏徐州221018)
0 引 言
高分子综合实验是以高分子化学和高分子物理实验为主的专业实验课程,要求学生通过对高分子化学和物理实验的学习,加深对高分子化学和物理基础知识和基本原理的理解。能够熟练和规范地进行高分子化学实验的基本操作,掌握实验技术和基本技能,了解实验室通用设备技术、精密仪器使用注意事项、实验数据分析与处理,为以后的科研工作打下坚实的实验基础[1]。因此,许多高校把科学前沿课题融入大学生综合基础实验课程,赋予基础实验前沿性、交叉性和综合性。这有利于为高校培养创新型人才和应用型人才发挥积极作用[2-6]。
随着工业的快速发展,重金属污染日益严重,重金属污染给动植物的生活环境、繁殖以及人类的衣食住行带来了严重的威胁,因此,建立重金属离子废水高效、环保、低成本的处理方法是环保领域的一项重要课题[7-10]。其中吸附是处理含重金属离子和染料废水的最有效的方法之一[11]。水凝胶含有大量官能团,例如羟基,氨基,羧基和酰胺基,对重金属离子和染料具有很强的结合能力,对重金属离子废水和染料废水的深度处理具有良好的效果[12]。其制备方法和吸附性质受到广泛关注,但外界环境因素对水凝胶吸附性能的影响尚缺乏系统研究[13-15]。
本设计实验利用无毒无害的聚丙烯酸系水凝胶对水中铅离子进行吸附,不会造成水体的二次污染。采用水溶液聚合法制备水凝胶,该方法制备水凝胶传热速率快,简单经济。
1 实验设计
1.1 实验目的
(1)了解高分子水凝胶处理工业污水的应用和发展。
(2)掌握溶液聚合制备高分子水凝胶的过程与吸附方法。
(3)熟悉红外光谱和扫描电子显微镜表征高分子材料。
1.2 实验原理
水溶液聚合法是单体和引发剂在水中进行的聚合反应。优点为聚合整个过程的黏度低,传热速率快,聚合温度容易控制,并且水作为反应溶剂经济环保。因此,本实验以丙烯酸、丙烯酰胺和甲基丙烯磺酸钠为单体,以过硫酸钾为引发剂,N,N′-亚甲基双丙烯酰胺为交联剂,水溶液法制备P(AA/AM/SMAS)水凝胶(见图1)。
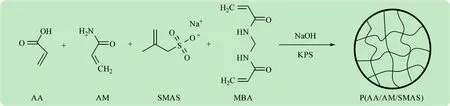
图1 P(AA/AM/SMAS)的合成
合成高分子水凝胶结构上含有羧基、羟基、酰胺基等功能性基团对重金属离子有很强的结合作用。其具有来源丰富、合成工艺简单、可以重复使用等优点,所以聚丙烯酸系的水凝胶受到人们的广泛关注。吸附量为吸附重金属性能的重要指标,吸附量计算如下:
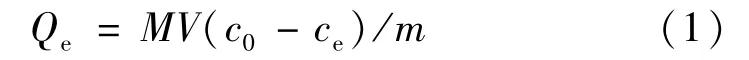
式中:Qe为水凝胶的吸附量(mg/g),V为加入重金属离子体积(L),c0为吸附前溶液中重金属离子的初始浓度(mol/L),ce为吸附饱和平衡后溶液中重金属离子的初始浓度(mol/L),M为称取吸附金属离子的分子量(mg/mol),m为称取水凝胶的质量(g)。
在吸附实验的研究当中,拟一级、二级动力学模型和颗粒扩散模型是最常用的两个模型。根据不同吸附时间水凝胶吸附铅离子的测试结果,对时间拟一、二级动力学模型和颗粒扩散模型[16]。
(1)对时间进行拟一级动力学模型计算。拟一级动力学方程为:
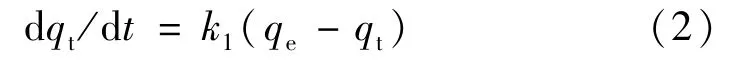
式中:qt为水凝胶在t时刻的吸附量(mmol/g),k1为一级动力学速率常数(min-1),qe为平衡时的吸附量(mmol/g)。
从临界条件t=0到t=t及qt=0到qt=qt对方程求积分得:
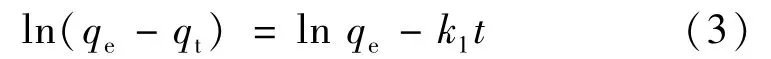
该式也可以表示为:
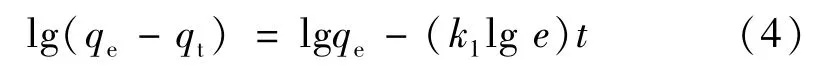
以lg(qe-qt)对t作图,得k1值和线性相关系数R2。
(2)对时间进行拟二级动力学模型计算。拟二级动力学方程为:
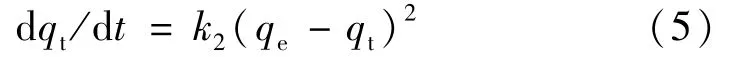
式中:qt为水凝胶在t时刻的吸附量(mmol/g),k2为二级动力学速率常数(mmol·g-1·min-1),qe为平衡时的吸附量(mmol/g)。
从临界条件t=0到t=t及qt=0到qt=qt,对方程求积分得:
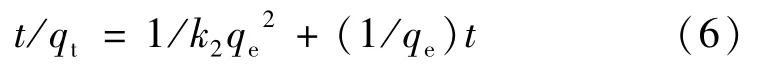
以t/qt对t作图,得k2和线性相关系数R2。
(3)对时间进行颗粒扩散模型计算。颗粒扩散方程为:

式中:qt为水凝胶在t时刻的吸附量(mmol/g),k3为颗粒扩散速率常数(mmol·g-1·min-0.5),C为常数(mmol/g),取决于吸附剂表面的界面层厚度。
以qt对t0.5作图,得k3和线性相关系数R2。
1.3 仪器与试剂
仪器:天平,磁力搅拌水浴锅,移液器,pH计,250 mL三口烧瓶,100 mL和250 mL锥形瓶,100 mL量筒,表面皿,茶叶袋,真空干燥箱,原子吸收分光光度计(AAS),红外光谱仪(FTIR),扫描电子显微镜(SEM)。
试剂:丙烯酸,丙烯酰胺,甲基丙烯磺酸钠,N,N′-亚甲基双丙烯酰胺,硝酸铅,过硫酸钾,氢氧化钠,盐酸和去离子水。
1.4 实验内容
本综合实验设计内容丰富(见图2),学时较多,可根据具体教学安排进行选择,下面对部分内容的操作方法进行详细描述。
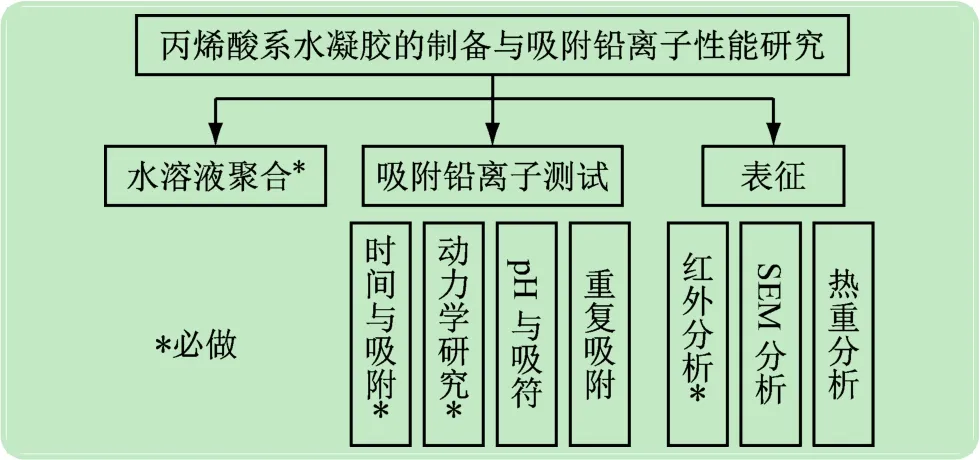
图2 综合实验模块与内容
1.4.1 水溶液聚合
量取20 mL的丙烯酸置于250 mL三口烧瓶中,在冷水浴中,缓慢滴加23.2 mL的40%氢氧化钠水溶液,如果滴加过快会有白色沉淀产生,冷却至室温,加入10.357 g的丙烯酰胺和1.895 g甲基丙烯磺酸钠溶解,然后加入1.01 g过硫酸钾引发剂,搅拌10 min后再加入0.403 gN,N-亚甲基双丙烯酰胺交联剂,搅拌待溶液澄清后升温至60℃反应8 h,用无水乙醇洗涤产物,浸泡和过滤,重复多次,然后80℃恒温干燥至恒重,粉碎,筛分200目左右的高分子水凝胶P(AA/AM/SMAS)。
1.4.2 吸附铅离子测试
(1)吸附时间对高分子水凝胶吸附性能的影响。在室温下,取一个100 mL锥形瓶,配置20 mL的浓度为0.024 mol/L 的Pb(II)离子溶液,然后加入0.2 g 的高分子水凝胶P(AA/AM/SMAS),磁子进行搅拌,约200 r/min。分别在5、10、20、40、80 和120 min 时取其上清液1 mL,采用原子吸收分光光度计测量Pb(II)的浓度,根据式(1)计算吸附量。
(2)pH值对高分子水凝胶吸附性能的影响。在室温下,取6个100 mL锥形瓶,配置20 mL的浓度为0.024 mol/L 的Pb(II)离子溶液,然后加入硝酸溶液或氢氧化钠溶液调节溶液pH值,并通过pH计确定pH 大小,分别将溶液的pH 调至1.5、2.5、3.5、4.5、5.5和6.5,在200 r/min 匀速的条件下振荡加入0.2 g的高分子水凝胶P(AA/AM/SMAS),搅拌240 min,然后取上清液1 mL,用原子吸收分光光度计测定溶液中Pb(II)的浓度,根据式(1)计算吸附量。
(3)高分子水凝胶的可重复利用性研究。取3个250 mL锥形瓶,使用长条状的称量纸准确称取0.2 g的干燥水凝胶粉末,通过称量纸送入茶叶袋底部,避免茶叶袋其他地方沾到水凝胶。然后将茶叶袋裁剪至略高于锥形瓶的长度,放入锥形瓶中,要将茶叶袋与磁子之间留有一定空隙,防止磁子打到茶叶袋,导致茶叶袋损坏,然后加入20 mL重金属离子溶液,其中Pb(II)浓度为0.024 mol/L。在室温匀速的条件下振荡2 h,静置沉降,然后取上清液将液,用原子吸收分光光度计测定溶液中重金属离子的浓度。用蒸馏水将吸附完的茶袋冲洗3遍,悬挂静置10 min,将静置的水凝胶放入pH为1的硝酸溶液中,振荡2 h进行解吸附。循环吸附5次,平行3次实验。
1.4.3 吸附动力学研究
通过式(1)计算Pb(II)离子各时间水凝胶的吸附量Qt,对应t时间的吸附量即记作qt,以及平衡时的吸附量Qe,计算结果记录在表1中。根据动力学方程(2~7),计算相应数据,填入表1。

表1 水凝胶吸附铅离子动力学研究(实例)
1.4.4 红外光谱测定
将干燥粉碎后的高分子水凝胶混入溴化钾中,充分研磨后进行压片,压片必须厚薄均匀,不能出现裂缝,把压好溴化钾盐片放入傅里叶变换红外光谱仪中进行分析。观察吸附后高分子水凝胶官能团的变化,以此推测其吸附机理。
1.4.5 扫描电子显微镜观察形貌
高分子水凝胶的吸附性能与水凝胶的形态和形貌有着密切的关系,树脂的表面、断面和界面都影响其吸附性能。称取一定量干燥的高吸水性树脂,粘合后喷碳,观察其形态和形貌。
2 结果与讨论
2.1 吸附时间对高分子水凝胶吸附性能的影响
图3 所示为P(AA/AM/SMAS)水凝胶对Pb(II)的吸附量随时间变化曲线,水凝胶对Pb(II)的吸附量及吸附率随着吸附时间的增加而增大,然后趋于平稳。90 min左右吸附达到平衡。这种趋势的主要原因是吸附刚开始时,水凝胶上有大量空的吸附位点,故吸附速度较快,吸附量增长很迅速。随着时间的推移,吸附位点减少,吸附过程受到阻碍,导致吸附速度逐渐缓慢。
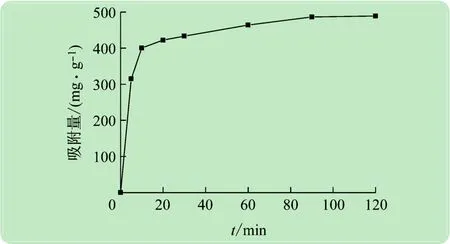
图3 吸附时间与吸附量的关系
2.2 pH值对高分子水凝胶吸附性能的影响
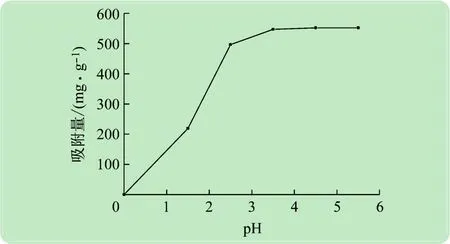
图4 pH与吸附量的关系
图4所示为pH对P(AA/AM/SMAS)水凝胶吸附的影响。pH过低时,溶液中存在大量的H+,而这些大量的H+离子与溶液中原本存在的金属离子对吸附位点形成竞争关系,从而阻碍了金属离子进入水凝胶内的吸附位点,所以在pH较低的时候,水凝胶对Pb(II)吸附量很少,当pH升高时,溶液中H+相对较少,竞争减弱,水凝胶对Pb(II)的吸附量增加。综上,当pH在3.5 ~5.5 之间,Pb(II)吸附量最大为552.2 mg/g。
2.3 高分子水凝胶的可重复利用性分析
由图5可知,随着第1次解吸后,P(AA/AM/SMAS)水凝胶对Pb(II)的吸附能力明显下降,但之后水凝胶的吸附量保持稳定。这是由于使用pH=1的硝酸作为解吸液,酸性过强,硝酸会一定程度上破坏吸附剂的结构,影响了水凝胶再次吸附。但用pH=1的硝酸溶液对水凝胶进行解吸了4次,水凝胶对Pb(II)仍具有205.4 mg/g左右的吸附量,说明了水凝胶具有一定的脱附再生性能,可以重复利用。
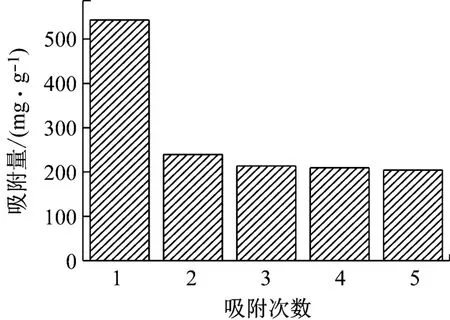
图5 吸附次数对P(AA/AM/SMAS)吸附性能的影响
2.4 高分子水凝胶吸附动力学研究
以lg(qe-qt)对t作图,得到一级动力学方程图(见图6),以t/qt对t作图,得到二级动力学方程图(见图7),以qt对t0.5作图得颗粒扩散模型(见图8)。拟合得到的动力学速率常数k和线性相关系数R2(见表2)。通过图表分析可得,Pb(II)的一级动力学方程中,R2=0.929 5 <0.995,Pb(II)的二级动力学方程中,R2=0.999 6 >0.995,故水凝胶吸附Pb(II)的过程很好地拟合了拟二级动力学模型。但是拟二级动力学模型不能解释扩散过程,这时就需要水凝胶对Pb2+的粒子内扩散模型,由图7可见,R2=0.897 3说明虽然水凝胶对Pb(II)的吸附过程中存在粒子扩散,但只是在吸附初期,并不是控制速率阶段,对于整个吸附过程相关性不高。
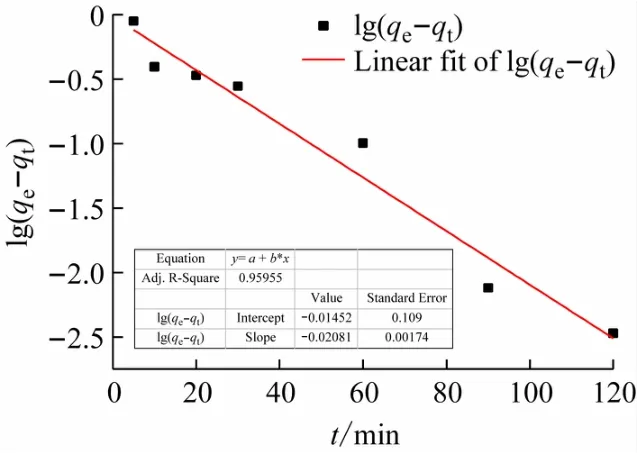
图6 拟一级动力学方程
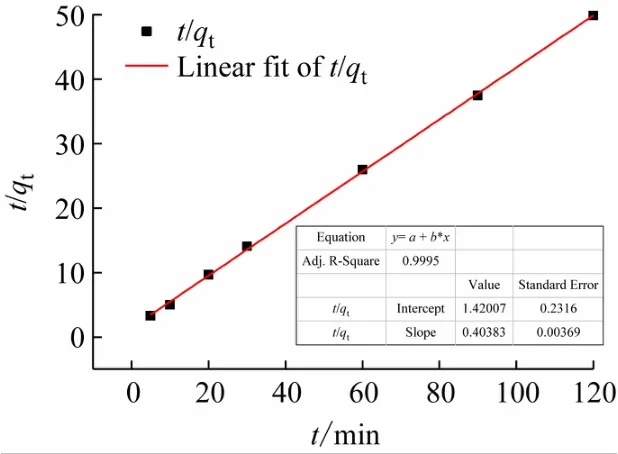
图7 拟二级动力学方程
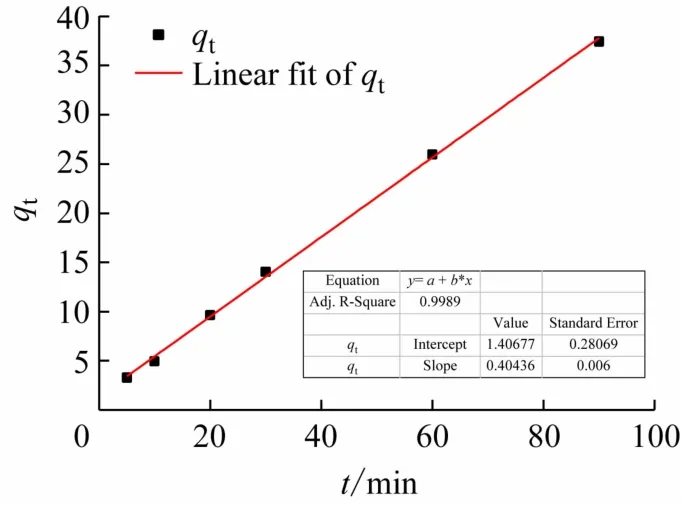
图8 拟颗粒扩散模型

表2 水凝胶对Pb(II)吸附的动力学研究
2.5 高分子水凝胶红外分析
图9所示是P(AA/AM/SMAS)高分子水凝胶红外光谱图。在3 449 cm-1处出现了—NH和—OH的伸缩振动峰,在1 595 cm-1附近则是苯环骨架的振动峰,1 388 cm-1和1 166 cm-1处分别是—COO-中C O和C—O的振动峰,1 190 cm-1和1 130 cm-1处归属于SO双键的反对称伸缩峰。为了进一步了解吸附机理,分析吸附Pb(II)后的官能团变化。在3 449 cm-1处归属于—NH2和—OH的伸缩振动峰,吸附Pb(II)后发生偏移,说明胺基与Pb(II)发生了相互作用,1 568 cm-1处N—H的弯曲振动峰的偏移也证实了这一点。另外—COO-反对称伸缩振动和—S O双键的反对称伸缩峰的偏移,说明羧基和磺酸基也与Pb(II)发生了相互作用。
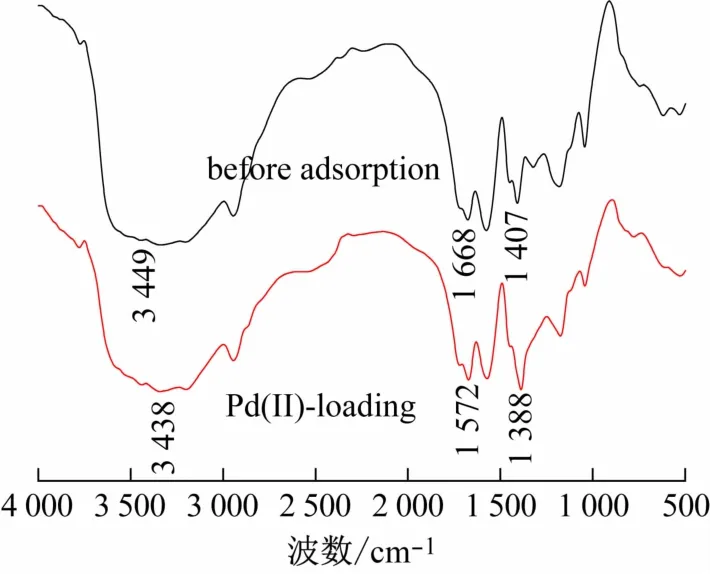
图9 P(AA/AM/SMAS)高分子水凝胶和吸附Pb(II)后的红外光谱图
2.6 高分子水凝胶SEM分析
通过扫描电镜对P(AA/AM/SMAS)高分子水凝胶的微观结构进行表征,如图10所示。高分子水凝胶表面疏松,具有相互连接的孔隙,使其能在表面和内部提供更多的吸附点,促进了水凝胶对金属离子的吸收。

图10 不同放大倍数的P(AA/AM/SMAS)高分子水凝胶SEM图像
3 实验教学安排
聚丙烯酸系水凝胶的制备与吸附铅离子性能研究综合实验适用于大三下学期开设,3~5人1组。实验教学安排分为3个阶段(见图11)。准备阶段一般提前两周公布实验内容,由学生自主查阅文献,设计方案。并重点复习高分化学中自由基聚合、溶液聚合的原理和方法,以及高分子研究方法中的红外光谱,扫描电子显微镜和原子分光光度计的相关知识。具体实施时,从图2中选做,其中4个必选,其他可根据不同学时要求选做,教师提供实践与理论指导。最后实验完成后,要求每位同学撰写科技论文或报告一份,主要包括分析结果,如上文提供的结果与讨论部分,进行效果评价,根据结果调整方案,给后续研究提供理论与数据支持。另外鼓励有兴趣的同学深入研究,以此为课题解决工厂实际污水处理问题,同时参与各类化工创新创业竞赛。
4 结 语
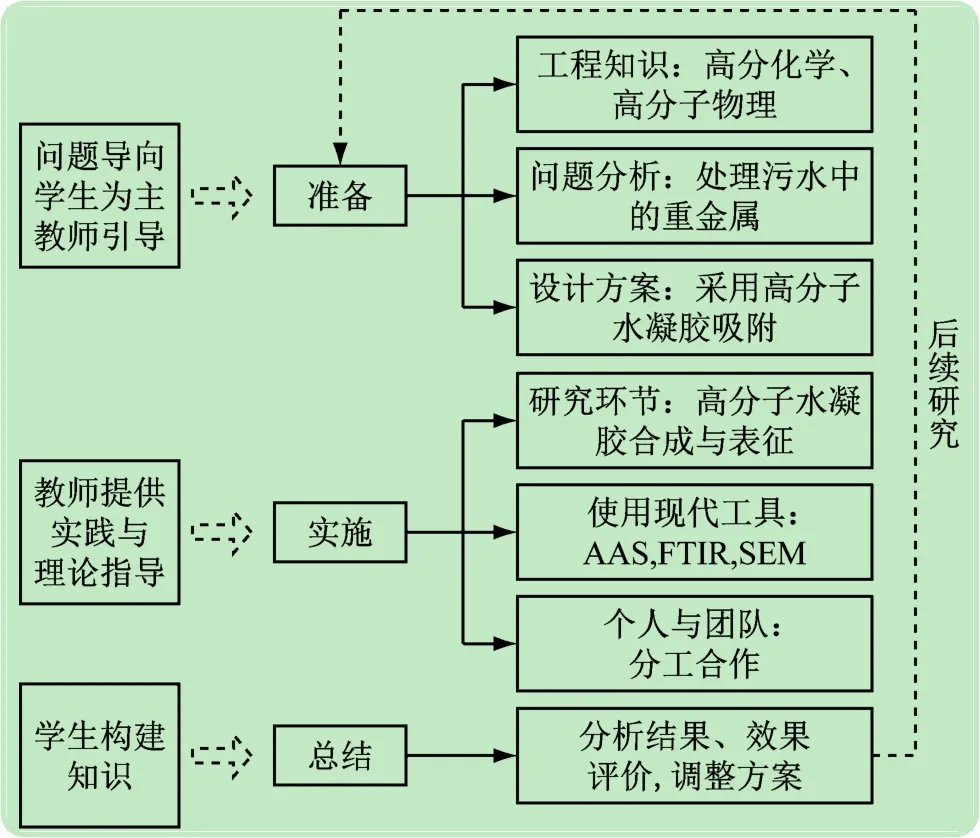
图11 实验教学安排流程图
本设计题为“聚丙烯酸系水凝胶的制备与吸附铅离子性能研究”高分子综合实验,应用于基础实验教学中。学生在掌握高分子化学和高分子物理基础上,学习和掌握高分子材料研究方法的理论与实践,为学好高分子专业其他的后续课程和开展科学研究打下坚实的基础。同时进一步培养学生分析问题,研究问题和解决问题的能力,从而提高解决复杂工程问题的能力。

