穿心莲内酯对急性淋巴细胞白血病细胞的生长抑制及凋亡诱导作用*
李晓文,周越菡△,邓健志,罗珍华,江海键,张漫丽,覃楚玲
(1桂林医学院,广西桂林541100;2桂林理工大学,广西桂林541004)
急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)是中国十大高发恶性肿瘤之一[1]。目前,临床上治疗ALL的手段主要以应用糖皮质激素,如地塞米松等作为基础化疗药物从而减少ALL细胞的数量为主[2],但现有治疗方案易引发水盐代谢紊乱、高血压、骨质疏松等不良反应,且会引起耐药,从而使预后变差[3]。因此,开发可替代现有治疗方案的新型抗ALL化疗药物,将在ALL的治疗中发挥重要作用。
穿心莲内酯(andrographolide,AND)是爵床科穿心莲属植物穿心莲(Andrographis paniculata)的主要活性成分,具抗炎、保肝、抗病毒等作用[4-6],还对多种肿瘤发挥抗增殖、抗凋亡等作用[7]。当前关于AND对ALL的作用的研究非常有限,且AND对耐药性ALL的作用仍未有报道。本研究以地塞米松耐药的人源ALL细胞株CEM-C1为实验对象,观察AND对CEM-C1细胞生长的抑制作用,探讨AND对凋亡相关因子 cleaved caspase-3、cleaved caspase-7、Bcl-2和Bax的影响以及对线粒体膜电位(mitochondrial membrane potential,MMP)的作用,并观察AND对CEMC1细胞构建的BALB/c-nu雌性裸鼠异位移植瘤模型的影响,最后应用免疫组化法检测裸鼠肿瘤组织凋亡蛋白cleaved caspase-3的改变,以期为ALL的临床治疗提供了新策略。
材料和方法
1 主要材料
1.1 细胞株及动物 人源急性淋巴细胞白血病细胞株CEM-C1购于中科院上海细胞库。5周龄Balb/c-nu雌性裸鼠购自湖南斯莱克景达实验动物有限公司,许可证号SYXK(湘)2016-0002,在桂林医学院科学实验中心SPF级屏障系统中饲养。
1.2 主要试剂及仪器 AND(Sigma-Aldrich);RPMI-1640培养基(Gibco);青/链霉素(HyClone);胎牛血清(Lonsera);CCK-8试剂盒和Annexin V-FITC凋亡检测试剂盒(DOJINDO);Corning®Matrigel®Basement Membrane Matrix(BD);Wright-Giemsa染色试剂盒(Solarbio);辣根过氧化物酶标记的山羊抗兔IgG(H+L)和细胞周期与细胞凋亡检测试剂盒(碧云天);抗 caspase-3、cleaved caspase-3、caspase-7和cleaved caspase-7抗体(Cell Signaling Technology);JC-1线粒体膜电位试剂盒(Thermo Fisher)。FACSAria™ Ⅲ流式细胞仪(BD);酶标仪(Bio-Rad);正置显微镜和荧光倒置显微镜(Olympus);CO2培养箱(SANYO);凝胶成像系统(Tanon);Centro LB 960微孔板发光检测仪(Berthold)。
2 方法
2.1 细胞培养及药物配制 CEM-C1细胞培养于完全培养基,即含有1%青/链霉素和10%胎牛血清的RPMI-1640培养基中,在37℃、5%CO2培养箱中培养。AND用DMSO配成40 mmol/L的贮存液,无菌处理后分装保存于-20℃中,临用前用培养基稀释至相应的浓度。
2.2 CCK-8法检测细胞活力 取生长对数期的CEM-C1细胞,用完全培养基配成单细胞悬液,以每孔1×104个的密度接种于96孔板中,每孔接种100 μL,每个实验组设置3个复孔。24 h后,加入相应浓度的AND,正常对照(control)组加入无药物的完全培养基,溶剂对照(vehicle)组加入与AND最高剂量相应浓度的DMSO。药物作用12、24和48 h后,使用CCK-8法于酶标仪450 nm处检测细胞吸光度(A)值。细胞相对活力(%)=加药组平均A值/对照组平均A值×100%。
2.3 Wright-Giemsa染色观察细胞形态 取对数期的CEM-C1细胞,给药处理24 h后,将细胞悬液转移到离心管中,1 000 r/min离心3 min,去除上清液。加入PBS,1 000 r/min离心3 min,去除上清液。再加适量的PBS重悬细胞,取30 μL细胞悬液均匀涂布于载玻片上自然晾干,用4%多聚甲醛室温下固定30 min。按照Wright-Giemsa染色试剂盒说明书进行染色,于显微镜下采集图像。
2.4 流式细胞术检测细胞周期分布 AND处理CEM-C1细胞24 h后,收集细胞至离心管1 000 r/min离心3 min,弃上清并用预冷PBS洗涤,再次离心沉淀细胞,用在70%乙醇在4℃中固定过夜。次日,用1 000 r/min离心3 min,沉淀细胞。用PBS洗涤后,将细胞与碘化丙啶(propidium iodide,PI)染色液在37℃避光孵育30 min。使用流式细胞术检测细胞周期的变化情况,并分析检测结果。
2.5 流式细胞术检测细胞凋亡 AND处理CEM-C1细胞24 h后,按Annexin V-FITC Apoptosis Detection Kit所述步骤进行annexin V-FITC及PI染色,然后上流式细胞仪检测[激发波长488 nm,发射波长530 nm;annexin V-FITC的绿色荧光通过FITC通道(FL1)检测,PI的红色荧光通过PI通道(FL2或FL3)检测]。
2.6 Western blot法检测凋亡相关蛋白的表达 AND处理CEM-C1细胞24 h后,收集细胞至离心管,1 000 r/min离心3 min沉淀收集细胞,弃上清并用预冷PBS洗涤,再次离心沉淀细胞,将细胞用RIPA裂解液裂解后,用BCA试剂盒检测蛋白浓度,加5×上样缓冲液混匀,煮沸5 min。进行SDS-PAGE,转移到聚偏二氟乙烯膜上。用5%脱脂奶粉封闭2 h,将膜在4℃与I抗温育过夜。次日,将膜用1×TBST洗涤3次,之后用辣根过氧化物酶标记的II抗,在室温下孵育2 h,用1×TBST漂洗3次。避光处,将ECL显色液滴加到PVDF膜上,反应1~3 min。凝胶成像系统采集图像,应用ImageJ软件对条带进行灰度分析。
2.7 JC-1法检测细胞MMP 将CEM-C1细胞接种于6孔板中并用AND处理24 h。以羰基氰化氯苯腙(carbonyl cyanide 3-chlorophenylhydrazone,CCCP;10 μmol/L)作为阳性对照,按照JC-1检测试剂盒说明书所述步骤进行染色。对染色的CEM-C1细胞进行细胞涂片、封片,并应用荧光显微镜采集图像。将细胞接种于96孔黑色底透微孔板中,按上述分组应用药物处理24 h后,每孔加入JC-1,使其终浓度为5 μmol/L。37℃避光孵育20 min后,参照文献[8]的方法,在激发波长488 nm、发射波长600 nm处检测红光荧光强度A1,在激发波长488 nm、发射波长530 nm处检测绿光荧光强度A2。各组的荧光值A=A1/A2,最终以相对荧光比例对MMP数据进行定量分析:相对荧光比例(%)=相应组别A/control组A×100%。每组实验重复3次。
2.8 AND对Balb/c-nu荷瘤鼠肿瘤生长的影响 将CEM-C1细胞重悬于无血清RPMI-1640培养基中,细胞密度控制在1×1011/L。将细胞悬液与人工合成基质胶按1∶1的体积比例混匀,然后皮下注射到5周龄雌性BALB/c-nu裸鼠右胁腹侧,每只接种200 μL。从接种当天开始,每天应用数显游标卡尺测量并按以下公式计算肿瘤体积(V):V=L×W2×0.5,L为长度,W为宽度。将动物随机分为4组,每组4只。以注射细胞当天的天数记为0,第7天起每天分别腹腔注射生理盐水(空白组)或不同剂量的AND(0.5、1或2 mg/kg),注射容积为10 mL/kg。AND用生理盐水配制。在初次腹腔注射给药后2周(第21天)处死动物,完整剥离肿瘤组织并应用分析天平测量其重量。
2.9 免疫组化法检测荷瘤鼠肿瘤组织中cleaved caspase-3的水平 将上述所得荷瘤鼠肿瘤组织于4%多聚甲醛中固定24 h后进行石蜡包埋、切片;参照文献[9],对切片进行热固定、去石蜡、重新水化、高温高压修复处理后,于3%H2O2室温孵育15 min以消除内源性过氧化物酶,再用PBS漂洗3次;兔抗人cleaved caspase-3Ⅰ抗(1∶500)4℃孵育过夜,PBS冲洗3次,加入Ⅱ抗孵育20 min,再用PBS充分淋洗,最后DAB显色、苏木精复染、脱水透明、树胶封片,于正置显微镜下观察并拍照。
3 统计学处理
应用SPSS 17.0软件对数据进行方差齐性检验和方差分析。实验数据以均数±标准差(mean±SD)表示,组间差异用单因素方差分析,两两间比较采用SNK-q检验。以P<0.05时为差异有统计学意义。
结 果
1 AND对CEM-C1细胞的生长抑制作用
CCK-8结果所示,AND对CEM-C1细胞活力的抑制作用呈时间及剂量依赖性,见图1A。Wright-Giemsa染色结果显示,应用AND后,CEM-C1细胞缩小、凝聚,细胞染色加深,细胞质均质红染并且细胞数减少,进一步证明AND对CEM-C1细胞具有生长抑制作用,见图1B。
2 AND对CEM-C1细胞的周期阻滞及凋亡诱导作用
AND处理细胞24 h后,流式细胞术检测结果证明,随着药物浓度的增加,处于第2、4象限的细胞数增多,即凋亡细胞数量增多;对3次实验结果进行定量分析,结果显示,8 μmol/L AND处理24 h后,CEMC1细胞的凋亡率与空白对照组相比显著升高(P<0.05),见图2A。AND处理24 h后,随着药物AND浓度增大,停留在G2期的细胞增加,证明细胞周期被阻滞在G2期,细胞的生长被抑制,见图2B。
3 AND对凋亡相关蛋白的影响
Western blot结果显示,AND作用 24 h,随着AND浓度的增加,活化的凋亡蛋白cleaved caspase-3/-7蛋白的量增加,当AND为10 μmol/L时,cleaved caspase-3/-7显著增加(P<0.05);且与空白对照组相比,随着AND的浓度增加,促凋亡蛋白Bax和抗凋亡蛋白Bcl-2的比值增大(P<0.01),见图3。
4 AND对CEM-C1细胞MMP的影响
JC-1在空白对照组的线粒体中正常聚集并呈现红色荧光,提示MMP正常;应用阳性对照药CCCP作用于CEM-C1细胞24 h后,细胞MMP明显降低,呈现绿色荧光;AND作用于CEM-C1细胞24 h后,随着AND的浓度增大,CEM-C1细胞的绿色荧光强度增加,指示较低的MMP,荧光定量结果进一步证明,AND剂量依赖性地降低CEM-C1细胞的MMP,见图4。因此,AND可能通过降低MMP而引起CEM-C1细胞凋亡。
5 AND对ALL裸鼠移植瘤的体积、重量及cleaved caspase-3蛋白水平的影响
观察期结束后处死动物,取瘤称重,结果发现AND各给药组的瘤体重量明显轻于control组,体积亦明显小于control组(P<0.05或P<0.01),见图5。这表明AND对CEM-C1细胞裸鼠移植瘤具有明显的生长抑制作用。
免疫组化结果显示,AND各给药组移植瘤组织中的棕染比例明显高于control组,染色亦明显深于control组,即AND组肿瘤细胞的cleaved caspase-3蛋白水平高于control组,且随着AND剂量的增加,棕色信号增强,说明AND在体内对ALL的凋亡诱导效应呈剂量依赖性,见图6。
讨 论
ALL的治疗手段,目前仍以地塞米松为基础药物对患者进行化疗为主,然而长期应用地塞米松引发的不良反应及耐药问题,严重降低了患者的生存质量[3]。作为广西特色中草药之一的穿心莲,其主要成分AND已被证明有较强的抗炎和抗病毒作用[10],并对多种类型的肿瘤具有生长抑制效应[7]。有研究表明,AND可抑制ALL细胞株Jurkat的生长[11],为AND对ALL的治疗作用提供了一定的线索。然而,当前关于AND对ALL作用的研究较为有限,且AND对耐药性ALL的作用仍未有报道。因此,我们选用对地塞米松耐药的ALL细胞株CEMC1,研究AND是否对其生长及凋亡存在调控作用。
Hanahan等[12]曾经综述过恶性肿瘤的6大生物学特征,其中第一大特征就是肿瘤细胞的无限生长。我们应用CCK-8和Wright-Giemsa染色法证实,浓度低至2.5 μmol/L时,AND作用24 h即可对CEM-C1细胞产生明显的生长抑制作用,形态上表现为细胞缩小、凝聚,细胞染色加深,细胞质均质红染。流式细胞周期检测结果进一步证明,AND能将CEM-C1细胞周期阻滞在G2期从而抑制细胞生长。因此,AND对耐地塞米松ALL细胞具有生长抑制作用,具备作为ALL患者对地塞米松耐药后候选药物的潜质。
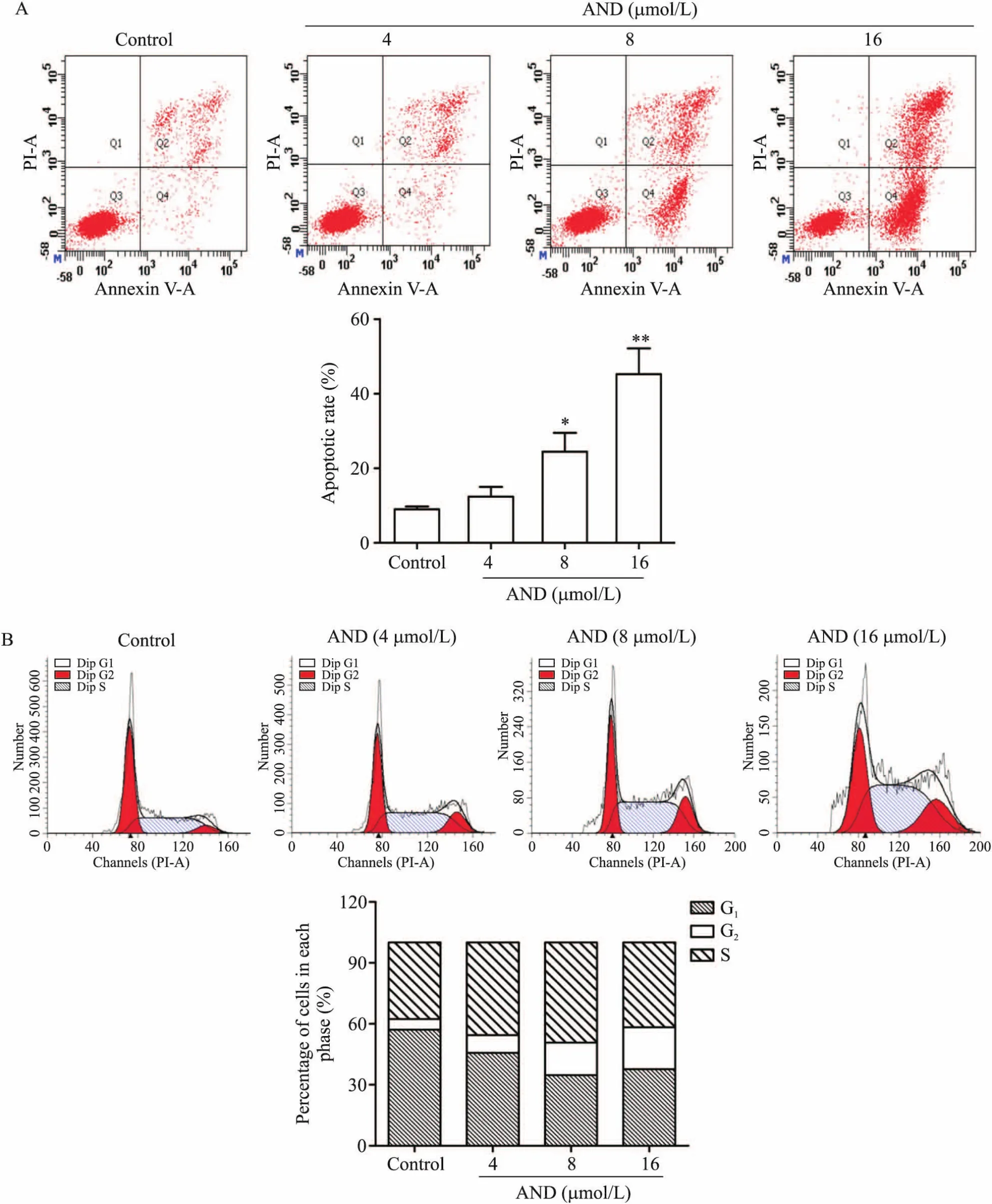
Figure 2.AND induced apoptosis and cell cycle arrest of CEM-C1 cells.A:flow cytometry was utilized to detect the apoptosis of CEM-C1 cells treated with AND for 24 h;B:flow cytometry was utilized to detect cell cycle distribution of CEM-C1 cells treated with AND for 24 h.Mean±SD.n=3.*P<0.05,**P<0.01 vs control group.图2 AND诱导CEM-C1细胞凋亡及周期阻滞
细胞凋亡属于生理性程序性细胞自杀,是由进化保守和遗传决定的,即细胞在一定的生理及病理条件下,遵循自身的程序,以细胞内caspases激活为起点自我结束生命,最后裂解为若干凋亡小体,被其他细胞吞噬,通常不伴有死亡细胞内容物释放而无炎症[13]。细胞凋亡在细胞生长过程中发挥着重要的作用。我们采用annexin V-FITC/PI双染和流式细胞术检测AND用药后的细胞凋亡情况。结果显示,不同浓度梯度的AND处理CEM-C1细胞24 h后,8 μmol/L AND对CEM-C1细胞即可发挥凋亡诱导效应,随着药物浓度增加,CEM-C1细胞凋亡率逐渐增大。

Figure 3.The effects of AND on the expression of apoptosis-related proteins in CEM-C1 cells.A:the effects of AND on the protein levels of caspase-3 and cleaved caspase-3;B:the effects of AND on the protein levels of caspase-7 and cleaved caspase-7;C:the effects of AND on the protein levels of Bax and Bcl-2.Mean±SD.n=3.*P<0.05,**P<0.01 vs control group.图3 AND对CEM-C1细胞凋亡相关蛋白水平的影响

Figure 4.AND induced reduction of mitochondrial membrane potential in CEM-C1 cells(JC-1 staining,×400).The fluorescence values of JC-1 obtained from fluorescence microplate reader were calculated as red/green fluorescence ratio and normalized as percentage of control group from 3 independent experiments.Mean±SD.n=3.**P<0.01 vs control group.图4 AND降低CEM-C1细胞的线粒体膜电位

Figure 5.The in vivo growth-inhibitory effect of AND on the ALL cell xenograft tumors.Mean±SD.n=3.*P<0.05,**P<0.01 vs control group.图5 AND对ALL细胞移植瘤模型的体内生长抑制作用

Figure 6.The effect of AND on the protein level of cleaved caspase-3 in ALL cell xenograft tumors(×400).图6 AND对ALL细胞移植瘤组织cleaved caspase-3蛋白水平的影响
为验证AND诱导CEM-C1细胞凋亡的效应,我们应用Western blot法检测应用AND后CEM-C1细胞凋亡相关蛋白的情况。作为caspase家族的关键因子,caspase-3和caspase-7是凋亡被诱导的过程中最主要的效应凋亡蛋白酶,其活化可诱导细胞发生凋亡[14];cleaved caspase-3和cleaved caspase-7分别是caspase-3和caspase-7活化过程中经剪切产生的活性片段,其活化程度及其与caspase-3和caspase-7的比值越高,细胞凋亡越明显[15-16]。在本研究中,AND剂量依赖性地升高 caspase-3、caspase-7、cleaved caspase-3、cleaved caspase-7、cleaved caspase-3/caspase-3和cleaved caspase-7/caspase-7的水平。在此基础上,我们进一步观察AND对凋亡相关蛋白Bcl-2和Bax的调控作用。Bcl-2蛋白通过抑制促细胞凋亡家族成员Bax的激活来阻止细胞凋亡[17]。而作为预测抗肿瘤药物临床疗效的指标之一,Bax/Bcl-2的比值与肿瘤缓解率成正比[18]。本研究表明,AND下调CEMC1细胞抗凋亡蛋白Bcl-2的表达,上调促凋亡蛋白Bax的表达,提高Bax/Bcl-2的比值,从而抑制ALL细胞生长。
在细胞凋亡信号转导途径中,线粒体是发挥关键调节作用的细胞器。线粒体内膜两侧的电化学梯度的存在(即MMP)是维持线粒体生物能量合成等正常功能所必需的,MMP的下降是细胞凋亡的特异性标志[19-20]。我们应用MMP指示剂JC-1对药物处理后的CEM-C1细胞进行染色,荧光显微镜下观察MMP的变化情况。JC-1是一种能透过细胞膜的荧光染料。正常细胞的MMP较高,JC-1能依赖线粒体跨膜电势进入线粒体基质,并形成聚合物从而产生红色荧光;而当细胞发生凋亡时,MMP较低,JC-1不能聚集在线粒体基质中,此时JC-1为单体,产生绿色荧光。我们发现应用低至2.5 μmol/L的AND即可降低CEM-C1细胞的MMP,浓度为10 μmol/L时,对MMP的影响已几乎接近CCCP,提示AND能通过降低MMP从而诱导CEM-C1细胞的凋亡。而在体内实验中,应用AND后,裸鼠肿瘤生长减慢,瘤体重量和体积明显减小。鉴于caspase-3是细胞凋亡相关蛋白级联反应的终结者,且caspase-3活化成cleaved caspase-3也就意味着细胞凋亡进入了无法逆转的阶段[21],因此我们将cleaved caspase-3作为检测凋亡的代表性指标,用免疫组化方法检测其在肿瘤组织的含量,发现AND明显提高荷瘤鼠肿瘤组织中cleaved caspase-3的水平,提示AND在体内对ALL亦有凋亡诱导作用。
综上所述,AND可诱导耐地塞米松的CEM-C1细胞发生凋亡,从而抑制其生长,说明AND有望成为新型的天然、安全的ALL治疗药物。尽管对诱导凋亡从而抑制生长的具体机制仍需进一步深入探索,然而本研究为耐药性ALL的治疗提供了初步的理论依据及新策略,并为民族医药在肿瘤药物治疗学的应用提供了新思路。

