姥鲛烷诱导法建立小鼠狼疮肾炎模型*
沈立军,颜天铭,王玉玉,孔 永
(苏州大学 1生物医学研究院,2医学部免疫学系,江苏苏州215123;3江苏荃信生物医药有限公司,江苏泰州225300)
系统性红斑狼疮(systemic lupus erythematosus,SLE)是由环境、遗传和内分泌等多种因素导致机体免疫耐受丧失、免疫功能紊乱进而造成包括肾脏在内的多组织器官慢性损伤的自身免疫性疾病[1]。研究表明环境因素在致机体氧化应激、细胞凋亡过度及促进自身抗原产生并引发自身免疫应答中发挥重要作用[2-3]。来源于矿物油中的烯烃化合物姥鲛烷(pristane)为细胞膜激活剂,可导致细胞毒性、诱导凋亡及产生活性氧中间体,促进产生自身抗原及形成炎性内环境,激活自身免疫细胞,从而打破自身免疫耐受,导致SLE的发生[4-5]。
SLE动物模型主要有自发性和诱导性之分,其中自发性模型有NZB×NZ、MPL/lpr、BXSB等;诱导性模型有化学物质诱导模型及慢性移植物抗宿主病模型,化学物质诱导模型的诱导剂有伴刀豆球蛋白A、细菌脂多糖、姥鲛烷等。1994年,McGaha等[6]应用姥鲛烷诱导BALB/c小鼠出现类似于人类SLE的症状,首次建立了姥鲛烷诱导的狼疮小鼠模型。与自发性狼疮小鼠模型所不同的是该模型侧重于研究环境因素打破机体免疫耐受以及导致SLE的机制,为探究非遗传因素在SLE发病过程中的作用提供了有力的工具,现在也成为最常用的SLE小鼠模型之一[7]。Calvani等[8]的研究表明,姥鲛烷在体内外均可诱导细胞凋亡,为打破免疫耐受提供了自身核抗原,引发自身抗体形成,进而形成免疫复合物沉积于各脏器,造成病理损害。鉴此,本文采用姥鲛烷单次腹腔注射诱导建立C57BL/6小鼠狼疮肾炎(lupus nephritis,LN)模型,通过对免疫细胞活化、自身抗体产生、细胞因子表达及肾脏病理改变等指标的综合分析,并首次使用透射电镜观察该模型肾脏组织超微结构的改变,研究诱导模型形成及病理损伤的表现及演变过程并探讨其免疫机制。
材料和方法
1 材料
6~8周龄雌性清洁级C57BL/6小鼠购自苏州大学实验动物中心。胎牛血清购自HyClone;DMEM基础培养基购自Gibco;姥鲛烷购自Sigma;抗核抗体(antinuclear antibodies,ANA)及抗双链DNA(doublestanded DNA,dsDNA)抗体检测试剂盒购自北京和杰创新生物医学科技公司;Albustix试纸购自Bayer;PE标记的抗CD11b、CD11c、Gr1及CD21抗体,FITC标记的抗B7-1及B7-2抗体,APC标记的抗MHC-Ⅱ抗体均购自eBioscience;PE标记的抗小鼠IgG抗体购自杭州联科生物技术公司;兔抗鼠干扰素γ(interferon-γ,IFN-γ)及白细胞介素4(interleukin-4,IL-4)抗体、HRP标记的羊抗兔IgG抗体、DAB及DAPI染液购自武汉博士德公司。
CO2细胞培养箱购自Thermo;高速离心机和流式细胞仪购自Beckman Coulter;倒置显微镜购自Olympus;超低温冰箱购自Thermo;超净工作台购自Airtech。
2 方法
2.1 动物分组与模型建立 全部小鼠在整个实验过程中置于苏州大学实验动物中心屏障系统SPF级饲养。小鼠随机分组,每组15只:模型(model)小鼠组予一次性腹腔注射0.5 mL姥鲛烷;阴性对照(control)组小鼠以同一方式注射等量生理盐水。
2.2 脾脏免疫细胞活化分析 注射后第10天每组处死5只小鼠,制备脾脏细胞悬液,经破除红细胞、洗涤后分别采用直接免疫荧光法标记及流式细胞术分析脾脏细胞的CD11b、CD11c、Gr1和CD21表达及CD21+B细胞表面B7-1、B7-2和MHC-Ⅱ的表达。
2.3 ANA和抗dsDNA抗体的检测 每月眼眶静脉丛取血及分离血清,参照试剂盒说明采用间接免疫荧光法测定ANA和抗dsDNA抗体表达及滴度。血清稀释后,与HEp2细胞玻片或dsDNA抗原玻片反应区室温孵育30 min,并设阳性及阴性对照,经洗涤、与FITC标记的羊抗鼠IgG避光孵育30 min后洗去未结合抗体,封片置于正置荧光显微镜(Leica)下观察。
2.4 尿蛋白检测 每月取小鼠晨尿,采用Albustix试纸测定蛋白尿程度。根据试纸反应区显色程度判定尿蛋白含量(g/L):(-):0;(±):0.15~0.30;(+):0.30~1.00;(++):1.00~3.00;(+++):3.00~20.00;(++++):>20.00。
2.5 肾脏免疫复合物沉积检测 注射后8个月处死小鼠,分离肾脏以4%中性甲醛固定,5 μm石蜡切片,常规脱蜡及水化,进行微波加热抗原修复,5%BSA封闭,PE标记的抗小鼠IgG抗体室温孵育2 h,PBS洗去未结合抗体,DAPI液染色10 min,PBS冲洗,封片后于荧光显微镜下观察。
2.6 肾脏组织IFN-γ和IL-4免疫组化分析 同2.5操作进行肾脏组织固定、切片、脱蜡及抗原修复,封闭后分别用兔抗鼠IFN-γ及IL-4抗体室温孵育2 h,洗片后予0.3%H2O2孵育15 min,加入HRP标记羊抗兔IgG抗体室温孵育1 h,洗涤后加入DAB孵育10 min,蒸馏水终止反应,玻片经烘干、二甲苯透明及封片后于光镜下观察。
2.7 肾脏病理学检查 同2.5操作进行肾脏组织固定、切片及脱蜡后,常规HE染色,制片完毕后于光镜下观察。
2.8 肾脏组织超微结构透射电镜分析 取注射8个月后处死的小鼠肾脏,切成1 mm×1 mm×1 mm小组织块,4%戊二醛前固定24 h及1%锇酸后固定1 h,30%及50%丙酮各脱水15 min,70%丙酮饱和醋酸铀处理过夜,80%及90%丙酮各脱水15 min,无水丙酮脱水10 min,3次。100%丙酮与包埋剂等量混合液浸透1 h及包埋剂浸透2 h,进行包埋后于35℃、45℃及55℃下依次聚合12 h,聚合完成后进行超薄切片及染色,于透射电镜下观察。
3 统计学处理
采用SPSS 19.0软件进行统计分析。正态分布计量资料以均数±标准差(mean±SD)表示,两组间比较采用独立样本t检验;有序分类等级资料采用Ridit分析。以P<0.05为差异有统计学意义。
结 果
1 小鼠的生存状态及一般病变
从第14周起,模型组小鼠出现脱毛、毛色暗淡、行动迟缓等表现;随着时间推移,3只小鼠出现不同程度腹水,1只小鼠极度消瘦并于第7个月时死亡。8个月时小鼠腹腔内可见各脏器根部、肠系膜上附有大小数量不一的白色颗粒状或团块状脂肪肉芽肿,见图1A,经检查证实为肌肉、脂肪及炎性细胞包裹姥鲛烷增生形成的异位淋巴组织,见图1B、C。模型组小鼠可见脾脏肿大并呈暗红色,见图1D;正常对照组小鼠的脾脏呈鲜红色,形态正常,见图1E。

Figure 1.Pathological change of pristane-induced mouse lupus nephritis model.A:lipogranulomas in abdominal cavity of model mice;B,C:HE staining of lipogranulomas;D:the appearance of spleen in model group;E:the appearance of spleen in control group.图1 姥鲛烷诱导的小鼠狼疮肾炎模型的一般病变
2 脾脏免疫细胞的活化状况
小鼠给予姥鲛烷后第10天,脾脏中巨噬细胞(CD11b+)、DC(CD11c+)、粒细胞(Gr1+)及 B 细胞(CD21+)均出现不同程度活化,与对照组相比差异有统计学显著性(P<0.05),见图2A。CD21+B细胞表面的B7-1、B7-2及MHC-Ⅱ表达率也呈现显著上调(P<0.05),见图2B。

Figure 2.In vitro assay of the activation degrees of mouse splenic immune cells.A:the expression rates of CD11b,CD11c,Gr1 and CD21 on the mouse splenic immune cells;B:the expression rates of B7-1,B7-2 and MHC-II on the splenic CD21+B cells.Mean±SD.n=5.*P<0.05 vs control group.图2 脾脏免疫细胞的活化
3 血清ANA和抗dsDNA抗体的检测
3个月时模型组小鼠的ANA和抗dsDNA抗体阳性率为30%和10%,滴度分别为1∶100~1∶300与1∶10~1∶30,4~7个月间二者阳性率及滴度不断上升,至第8个月时ANA与抗dsDNA抗体表达的阳性率分别达到100%(+++:6只;++:2只;+:1只)和89%(+++:5只;++:3只;-:1只),见图3A,同时ANA检测亦显示出不同的染色形态,见图3B,而对照组未检测到ANA与抗dsDNA抗体的表达。

Figure 3.Detection of ANA and anti-dsDNA antibodies in serum.A:the ANA and anti-dsDNA antibodies in serum of pristane-induced mouse lupus nephritis model(×400);B:staining type of ANA by indirect immunofluorescence assay(×400).图3 血清ANA和抗dsDNA抗体的检测
4 尿蛋白的测定
4个月时,模型组30%小鼠出现蛋白尿,尿蛋白含量为0.3~3 g/L,随着时间推移,蛋白尿阳性率和尿蛋白含量不断增加,8个月时蛋白尿阳性率达100%,尿蛋白含量为1~20 g/L,与对照组相比差异具有统计学显著性(P<0.05),见表1。
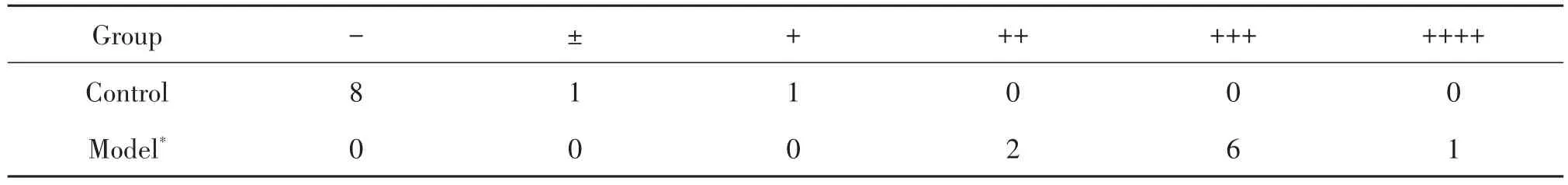
表1 小鼠蛋白尿程度的比较Table 1.Comparison the degree of proteinuria(n=10)
5 肾脏免疫复合物沉积的检测
8个月时,小鼠肾脏组织经直接免疫荧光法检测,模型组小鼠可见荧光呈线状、团块状沿肾小球毛细血管壁、系膜区连续性分布,衬托出肾小球轮廓,免疫复合物沉积严重,而对照组肾脏中荧光微弱或未见,与模型组呈现出明显的差异,见图4。

Figure 4.Immune complex deposition on mouse kidneys observed by fluorescene microscopy(×400).图4 肾脏免疫复合物的沉积
6 肾脏组织IFN-γ和IL-4免疫组化分析
8个月时模型组及对照组小鼠肾脏毛细血管壁及肾小管上皮细胞均可检测到IFN-γ和IL-4的表达。模型组IFN-γ表达强度明显高于对照组,而IL-4表达强度的差别不明显,见图5。

Figure 5.The images of immunohistochemical analysis for determining the expression of IFN-γ和IL-4 in mouse kidneys(×400).图5 肾脏IFN-γ和IL-4的免疫组化分析
7 肾脏HE染色及病理检查
8个月时,模型组小鼠部分肾小球细胞数量明显增多,系膜基质和系膜细胞增生,肾小球内淋巴细胞侵润;部分肾小球毛细血管袢萎缩以及变性坏死,肾小囊腔增大;少数肾小球呈现阶段性坏死并伴有内皮细胞增生。对照组小鼠肾小球未见明显的淋巴细胞侵润及明显体积增大或坏死现象,毛细血管袢薄及囊腔清晰分明,内皮细胞和系膜细胞正常,见图6。

Figure 6.HE staining analysis of mouse kidneys(×400).图6 肾脏HE染色分析
8 肾脏的超微结构透射电镜分析
模型组小鼠在第8个月时可见肾小球基底膜增厚、层次模糊、系膜插入、足突融合、足细胞及内皮细胞微绒毛化坏死,系膜基质增生等现象,并可见基膜内、系膜区及内皮下等部位呈不同程度电子致密物沉积;对照组小鼠肾小球仅见足细胞轻微融合和内皮下少量电子致密物沉积,但基底膜厚度均匀,肾脏超微结构基本正常,见图7。
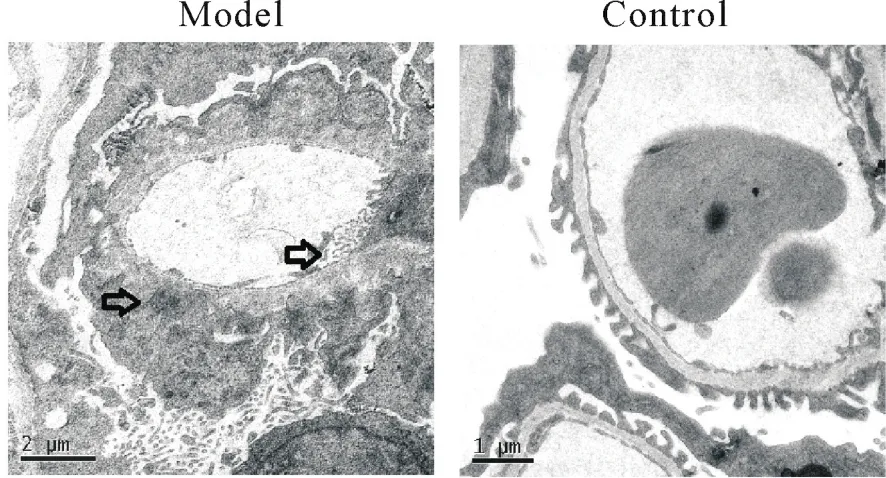
Figure 7.Ultrastructure analysis of mouse kidneys by transmission electron microscopy.图7 肾脏超微结构透射电镜分析
讨 论
建立狼疮动物模型是研究该类疾病病因、发病机制进而寻找相应治疗手段的必要途径,对于SLE的认识和治疗具有重要的促进作用。目前常用的SLE动物模型有自发性、诱发性和基因调控型3种。自发性和基因调控型模型侧重研究遗传因素对SLE发病的影响,对于全面理解由多种因素综合作用而导致的SLE具有其局限性。诱发性模型是采用非自身免疫病易感小鼠运用物质诱导产生狼疮症状,具有发病早、动物源广泛及经济实用等特点,尤其在当今环境问题突出,环境因素的致病作用和机理正日益引起重视的背景下,该类模型为研究环境因素如何诱导SLE发病提供了有力的手段。
姥鲛烷也称降植烷,化学名为 2,6,10,14-四甲基十五烷(2,6,10,14-tetramethylpentadecane,TMPD),是来源于矿物油、植物、海洋生物的类异戊二烯烷烃类化合物[8]。姥鲛烷可促进巨噬细胞分泌IL-6等细胞因子以及导致活性氧簇产生与炎性环境的形成,并可通过线粒体途径诱导腹腔内细胞凋亡而产生自身抗原[9],从而诱导机体打破免疫耐受及T、B细胞的异常活化与应答。本研究中发现姥鲛烷注射后第10天脾脏巨噬细胞、粒细胞、树突状细胞、抗体产生细胞(B细胞)较对照组均呈现显著的活化。Bruns等[10]也检测到姥鲛烷诱导的BALB/c小鼠模型中CD3+CD28+T细胞增加,本研究8个月时模型组小鼠大量异位淋巴组织形成及脾脏肿大的表型也印证了姥鲛烷诱导后小鼠免疫应答的异常增强。
姥鲛烷诱导腹腔内细胞凋亡以致产生大量细胞碎片和自身抗原,在炎性环境和免疫细胞活化的背景下,导致自身抗体产生。本研究采用间接免疫荧光法检测了狼疮肾炎指标抗体ANA和抗dsDNA抗体的情况[11],结果显示二者于3个月时出现,并且其阳性率和滴度随着时间的推移均逐渐增加,这些结果说明了该物质可诱导小鼠产生针对核抗原的自身抗体及自身免疫反应的持续增强。
自身抗体识别结合沉积于肾脏组织的循环抗原、肾脏细胞凋亡形成的原位抗原及肾脏组分形成的复合物,以及循环中自身抗原、抗体形成的复合物成为肾脏组织中免疫复合沉积的主要来源[12-14]。本研究对免疫复合物在肾脏沉积状况进行了检测,结果显示8个月时模型组小鼠肾小球毛细血管壁、系膜区出现明显的连续性分布的荧光,提示本模型免疫复合物肾脏沉积现象严重。
肾脏组织中自身抗原及免疫复合物可刺激肾脏组织细胞表达趋化因子及受体,进而促进炎性细胞侵润、炎性细胞因子分泌、补体激活,从而导致肾脏组织的慢性损伤[15-16]。本研究免疫组化分析显示,肾脏组织中IFN-γ出现明显的表达上调,提示LN疾病晚期Th1型细胞因子占优势作用,此结果与Richards等[17]的报道一致,但此结果可能只展现了疾病特定阶段、特定受累组织的状况,而细胞因子的表达谱实际受到疾病状态及进展的密切影响[15]。
自身抗原及免疫复合物导致的炎性损伤持续进行最终可导致姥鲛烷诱导的小鼠出现免疫复合物型肾炎[18],本研究中小鼠肾脏HE染色及透射电镜病理分析结果均显示出淋巴细胞侵润、组织坏死、电子致密物沉积等明显的肾脏病理损伤,符合符合狼疮肾炎分类标准中的Ⅲ、Ⅳ、Ⅴ型改变[19-20]。同时本研究中模型组8个月时出现的较高的尿蛋白含量表明模型鼠肾脏功能严重受损。
综上所述,本研究采用姥鲛烷诱导的方法成功建立C57BL/6小鼠狼疮肾炎模型,具有LN特异性抗体、蛋白尿及免疫复合物型肾炎等类似人类SLE的症状,证明了环境因素影响SLE发病的重要性。同时通过对免疫细胞活化、自身抗体产生及组织病理学改变等指标的分析探讨了环境因素诱导模型形成和病理损伤的机制,为研究对该模型的免疫干预效应奠定了实验基础。

