尖吻蝮蛇毒抑瘤组分I通过PERK/eIF2α通路诱导Tca8113细胞凋亡的机制研究*
王振杰,柴 琳,徐 冉,张根葆,3
(皖南医学院 1病理生理学教研室,2口腔医学院,3蛇毒蛇伤研究所,安徽芜湖241001)
口腔鳞癌是头颈部常见的恶性肿瘤,多数为舌鳞癌[1-2]。舌部血运丰富导致舌鳞癌细胞生长快,浸润性强,易转移[3]。虽然舌鳞癌的治疗方法在不断发展,但患者的5年生存率仅为55%左右[4],且各种治疗方法都有不同程度的不良反应。因此,寻求一种安全、高效、廉价的治疗方式对舌鳞癌患者具有重要的意义。
蛇毒为我国丰富的天然药用资源,具有降压、镇痛、抗炎、抗血栓、抗肿瘤等作用[5],其中的抗肿瘤作用仍是目前研究的热点。尖吻蝮蛇毒抑瘤组分I(anti-tumor component I fromAgkistrodon acutusvenom,AAVC-I)是由皖南医学院蛇毒蛇伤研究所利用蛋白分离纯化技术从皖南尖吻蝮蛇毒中提取的一种活性成分[6],对肺癌、白血病等[7-10]多种肿瘤细胞具有抑制增殖和促进凋亡的作用。但AAVC-I具体是如何诱导肿瘤细胞凋亡目前尚未完全明确。内质网应激(endoplasmic reticulum stress,ERS)介导的细胞凋亡途径是近些年发现的一种独立于死亡受体和线粒体途径的新凋亡通路[11-12],而其中的蛋白激酶R样内质网激酶(protein kinase R-like endoplasmic reticulum kinase,PERK)/真核翻译起始因子 2α(eukaryotic translation initiation factor 2α,eIF2α)通路最为关键。因此,本实验基于ERS相关的PERK/eIF2α通路探讨AAVC-I对人舌鳞癌Tca8113细胞凋亡的影响,为寻找蛇毒抗肿瘤作用靶点的临床应用提供实验依据。
材料和方法
1 细胞
人舌鳞癌Tca8113细胞于2014年10月购自江苏凯基生物技术股份有限公司,由皖南医学院病理生理学教研室冻存保留。
2 主要药品试剂
胎牛血清(广州鸿泉生物科技有限公司,批号:180809);DMEM 高糖细胞培养液(Gibco,批号:8118392);0.25%胰蛋白酶溶液(批号:J150003)和PBS(批号:NAG1434)购自 HyClone;AAVC-I(皖南医学院蛇毒蛇伤研究所提供);MTT细胞增殖及细胞毒性检测试剂盒(编号:C0009)、HE染色试剂盒(编号:C0105)和BCA蛋白浓度测定试剂盒(增强型,编号:P0010S)均购自碧云天生物技术有限公司;4%组织细胞固定液(合肥睿捷生物科技有限公司,批号:7J21BL014);annexin V-FITC/PI双染细胞凋亡检测试剂盒(上海贝博生物科技有限公司,批号:BB19061);RIPA组织/细胞裂解液(北京索莱宝科技有限公司,批号:20180809);十二烷基硫酸钠-聚丙烯酰胺凝胶快速制备试剂盒(编号:BL522A)、十二烷基硫酸钠-聚丙烯酰胺凝胶蛋白上样缓冲液(5×,编号:BL502A)和聚偏二氟乙烯膜(编号:BSPVDF-45)均购自 BioSharp;PageRuler™ Prestained Protein Ladder(ThermoFisher,批号:00505780);Ⅰ抗[葡萄糖调节蛋白78(glucose-regulated protein 78,GRP78)兔单克隆抗体(货号:3177T)、p-PERK兔单克隆抗体(货号:3179S)、p-eIF2α兔单克隆抗体(货号:3398T)、活化转录因子4(activating transcription factor 4,ATF4)兔单克隆抗体(货号:11815S)、CCAAT/增强子结合蛋白同源蛋白(CCAAT/enhancerbinding protein homologous protein,CHOP)兔单克隆抗体(货号:5554T)、Bax兔单克隆抗体(货号:5023T)、Bcl-2兔单克隆抗体(货号:4223T)和GAPDH兔单克隆抗体,货号:4970T)]和Ⅱ抗(辣根过氧物酶标记的山羊抗兔IgG,货号:7074P2)均购自 Cell Signaling Technology;ImmobilonTMWestern Chemiluminescent HRP Substrate(Millipore,批号 :1722101)。
3 主要实验仪器
CO2细胞培养箱(Thermo Fisher,型号:311);酶标仪(Tecan Austria GmbH,型号:Sunrise);流式细胞仪(BD,型号:FACSVerse);电泳和转模系统(Bio-Rad,型号:PowerPacTMBasic);凝胶成像仪(Bio-Rad,型号:Universal Hood II)。
4 实验方法
4.1 细胞培养 在5%CO2、37℃恒温恒湿的细胞培养箱中用含10%胎牛血清的DMEM高糖培养液培养Tca8113细胞,取对数生长期细胞进行实验。
4.2 MTT法检测AAVC-I对Tca8113细胞活力的影响 取对数生长期的Tca8113细胞,经胰蛋白酶消化离心去上清后,用含10%胎牛血清的DMEM高糖培养液制备细胞悬液,调整细胞浓度为1×107/L。按每孔200 μL细胞悬液的量均匀接种到96孔细胞培养板中,然后将其于细胞培养箱中培养24 h。待细胞贴壁后,去除孔内原有培养液,加入100 μL含10%胎牛血清和不同浓度(2.0、4.0、8.0、16.0和24.0 mg/L)AAVC-I的DMEM高糖培养液,同时设置空白对照(blank control)组和正常对照(normal control)组,每组各6个复孔,将其继续于培养箱内培养24 h后向每孔内加入10 μL浓度为5 g/L的MTT,再于培养箱内继续孵育4 h。4 h后再向每孔内加入100 μL的formazan溶解液,适当混匀。最后在培养箱内继续孵育至formazan全部溶解,于酶标仪570 nm波长测定每孔吸光度(A)并计算细胞生长抑制率(inhibitory rate,IR)。公式如下:IR(%)=[1-(药物浓度组平均A值-空白对照组平均A值)/(正常对照组平均A值-空白对照组平均A值)]×100%。
4.3 HE染色观察AAVC-I对Tca8113细胞形态的影响 收集对数生长期的Tca8113细胞制备细胞悬液,调整细胞浓度为2×107/L。按每孔3 mL细胞悬液的量将细胞均匀接种到6孔细胞培养板中,于细胞培养箱中培养24 h。待细胞贴壁后,去除孔内原有培养液,每孔加入3 mL含10%胎牛血清和不同浓度AAVC-I的DMEM高糖培养液,同时设置正常对照组;继续培养24 h后取出培养板,吸弃孔内培养液,用PBS液轻轻清洗每孔2遍,加入4%组织细胞固定液2 mL固定细胞30 min;去除固定液,用PBS清洗每孔2遍,加入1 mL苏木素染液染色5 min;吸去苏木素染液并用单蒸水流水冲洗每孔2 min;向每孔加入1 mL伊红染液染色1 min;单蒸水流水冲洗每孔1 min;最后于倒置显微镜下镜检拍照。
4.4 annexin V-FITC/PI法检测细胞凋亡 密度为2×107/L的对数生长期Tca8113细胞悬液按每孔3 mL接种到6孔板中。培养24 h细胞贴壁后去除孔内原有培养液并加入实验浓度的AAVC-I,每孔3 mL,同时设置正常对照组继续培养24 h;收集每孔上清液中的细胞和胰酶消化的贴壁细胞于相对应10 mL离心管中,4℃、500×g离心5 min,弃上清;用预冷的PBS洗涤细胞沉淀,再4℃、300×g离心5 min,弃上清液,每支离心管加入400 μL的annexin V结合液(1×)重悬细胞;每支离心管加入5 μL的FITC染色液,轻轻混匀,于4℃避光条件下孵育15 min;每支离心管再加入10 μL的PI染色液,轻轻混匀,于4℃避光条件下孵育5 min;最后用流式细胞术检测细胞凋亡,使用FlowJo 10.0.7软件分析细胞凋亡情况。
4.5 Western blot法检测相关蛋白的表达量 取密度为2×107/L的对数生长期Tca8113细胞悬液按每孔3 mL接种到6孔板中。24 h细胞贴壁后去除孔内原有培养液并加入实验浓度的AAVC-I,每孔3 mL,同时设置正常对照组继续培养24 h;吸去孔内培养液加入冷PBS液轻轻清洗每孔2遍,清洗后再向每孔加入RIPA细胞裂解液(含1%的PMSF)200 μL;把6孔板置于冰上轻轻刮下孔内细胞使其与细胞裂解液充分接触。待细胞充分裂解后收集孔内总蛋白液于1.5 mL离心管内,4℃、12 000×g离心5 min;收集离心管内总蛋白上清液于新的1.5 mL离心管内,并用BCA法测定总蛋白浓度,然后加入相应量的5×蛋白上样缓冲液,沸水中煮10 min使蛋白充分变性。取相同质量变性后的总蛋白液行SDS-PAGE分离;然后把凝胶中的蛋白转移到聚偏二氟乙烯膜上;转膜后用5%的牛血清白蛋白室温下对膜进行封闭1.5 h;对封闭完成的膜于4℃摇床上孵育Ⅰ抗过夜,Ⅰ抗孵育结束后用TBST液洗膜3次(每次5 min);加入Ⅱ抗室温孵育1 h,Ⅱ抗孵育结束后再次用TBST洗膜3次(每次5 min);在膜上滴加化学发光剂于凝胶成像仪上曝光显影;最后利用图像分析软件Image Lab 5.2.1对条带进行分析。
5 统计学处理
实验数据使用SPSS 20.0统计软件处理,符合正态分布的计量资料以均数±标准差(mean±SD)表示,多组间比较差异比较采用单因素方差分析(one-way ANOVA),组间两两比较采用最小显著性差异t检验(LSD-t),以P<0.05为差异有统计学意义。
结 果
1 AAVC-I对Tca8113细胞活力的抑制作用
不同浓度的AAVC-I处理Tca8113细胞24 h,MTT法检测结果显示,随着AAVC-I浓度(2.0、4.0、8.0、16.0和24.0 mg/L)的增加,细胞抑制率逐渐升高,AAVC-I各浓度组与正常对照组比较差异均有统计学意义(P<0.01),见表1。AAVC-I处理Tca8113细胞24 h的IC50为17.69 mg/L(图1),故选择4.0、8.0和16.0 mg/L作为AAVC-I的实验浓度。
2 AAVC-I对Tca8113细胞形态的影响
实验浓度的AAVC-I作用Tca8113细胞24 h,对细胞进行HE染色可以明显观察到细胞的形态变化。正常对照组细胞的胞核经苏木素染成蓝紫色,胞质经伊红染成粉红色,细胞饱满呈良好的贴壁生长状态,形态多为梭形或不规则多边形;随着AAVC-I实验浓度的增加,实验组细胞逐渐皱缩变小,细胞间隙增大,其中AAVC-I(16 mg/L)组大部分细胞胞膜消失,仅看到染色加深呈固缩状态的胞核,并且出现大量的细胞碎片和凋亡小体,见图2。
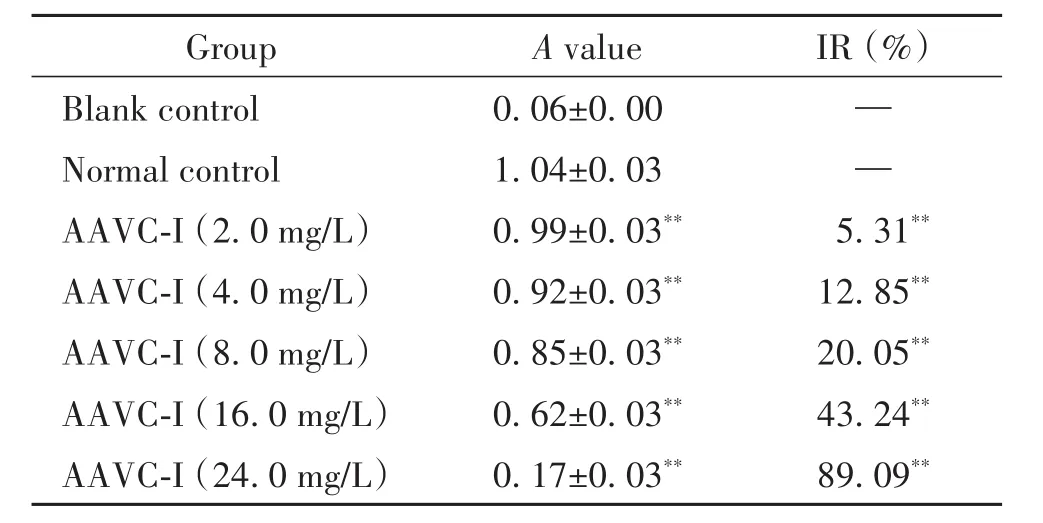
表1 AAVC-I对Tca8113细胞活力的影响Table 1.Inhibitory effect of AAVC-I on viability of Tca8113 cells(Mean±SD.n=6)

Figure 1.Inhibitory effect of AAVC-I on viability of Tca8113 cells.图1 AAVC-I对Tca8113细胞活力的影响
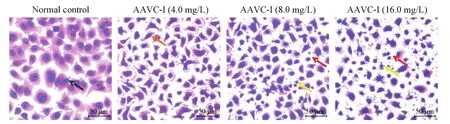
Figure 2.Effects of AAVC-I on morphological changes of Tca8113 cells(HE staining).图2 AAVC-I对Tca8113细胞形态的影响
3 AAVC-I对Tca8113细胞凋亡的影响
实验浓度的AAVC-I处理Tca8113细胞24 h后,用annexin V-FITC/PI法检测细胞凋亡情况,结果显示,正常对照组细胞凋亡率为(2.27±0.36)%,AAVC-I(4.0 mg/L)组凋亡率为(11.04±2.03)%,AAVC-I(8.0 mg/L)组凋亡率为(18.71±0.71)%,AAVC-I(16.0 mg/L)组凋亡率为(35.50±2.26)%,AAVC-I各浓度组的细胞凋亡率较正常对照组显著升高(P<0.05),且各浓度组的细胞凋亡率之间差异也具有统计学意义(P<0.05),见图3。
4 AAVC-I对Tca8113细胞相关蛋白表达的影响
实验浓度的AAVC-I处理Tca8113细胞24 h后,Western blot法检测了ERS相关蛋白GRP78、PERK/eIF2α通路中的p-PERK和p-eIF2α、PERK/eIF2α通路下游的ATF4和CHOP,以及细胞凋亡相关蛋白Bax和Bcl-2的表达水平,结果显示,与对照组相比,AAVC-I各浓度组 GRP78、p-PERK、p-eIF2α、ATF4、CHOP和Bax表达上调,Bcl-2表达下调(P<0.05),且AAVC-I各浓度组的蛋白表达水平之间的差异同样具有统计学意义(P<0.05),见图4~6。
讨 论
临床治疗肿瘤以诱导肿瘤细胞凋亡为有效策略之一[13],其中,细胞凋亡实验是一种评价和筛选抗肿瘤药物快捷有效的方法[14]。ERS介导的细胞凋亡是近年来抗肿瘤药物研发的重要靶点[15]。研究表明,ERS介导的细胞凋亡通路是促进人白血病细胞、人肝癌细胞、人肺癌细胞等多种肿瘤细胞凋亡的有效途径[16-18]。本实验室基于ERS相关的PERK/eIF2α信号通路,进一步研究AAVC-I促人舌鳞癌Tca8113细胞凋亡的机制。

Figure 3.Effect of AAVC-I on apoptosis of Tca8113 cells.The apoptosis of the Tca8113 cells treated with AAVC-I for 24 h was detected by flow cytometry.Mean±SD.n=3.*P<0.05 vs normal control group;#P<0.05 vs AAVC-I(4.0 mg/L)group;△P<0.05 vs AAVC-I(8.0 mg/L)group.图3 AAVC-I对Tca8113细胞凋亡的影响

Figure 4.The protein levels of GRP78,p-PERK and p-eIF2α in Tca8113 cells treated with different concentrations of AAVC-I.Mean±SD.n=3.*P<0.05 vs normal control group;#P<0.05 vs AAVC-I(4.0 mg/L)group;△P<0.05 vs AAVC-I(8.0 mg/L)group.图4 AAVC-I对Tca8113细胞GRP78、p-PERK和p-eIF2α蛋白水平的影响

Figure 5.The protein expression levels of ATF4 and CHOP in Tca8113 cells treated with different concentrations of AAVC-I.Mean±SD.n=3.*P<0.05 vs normal control group;#P<0.05 vs AAVC-I(4.0 mg/L)group;△P<0.05 vs AAVC-I(8.0 mg/L)group.图5 AAVC-I对Tca8113细胞ATF4和CHOP蛋白表达水平的影响
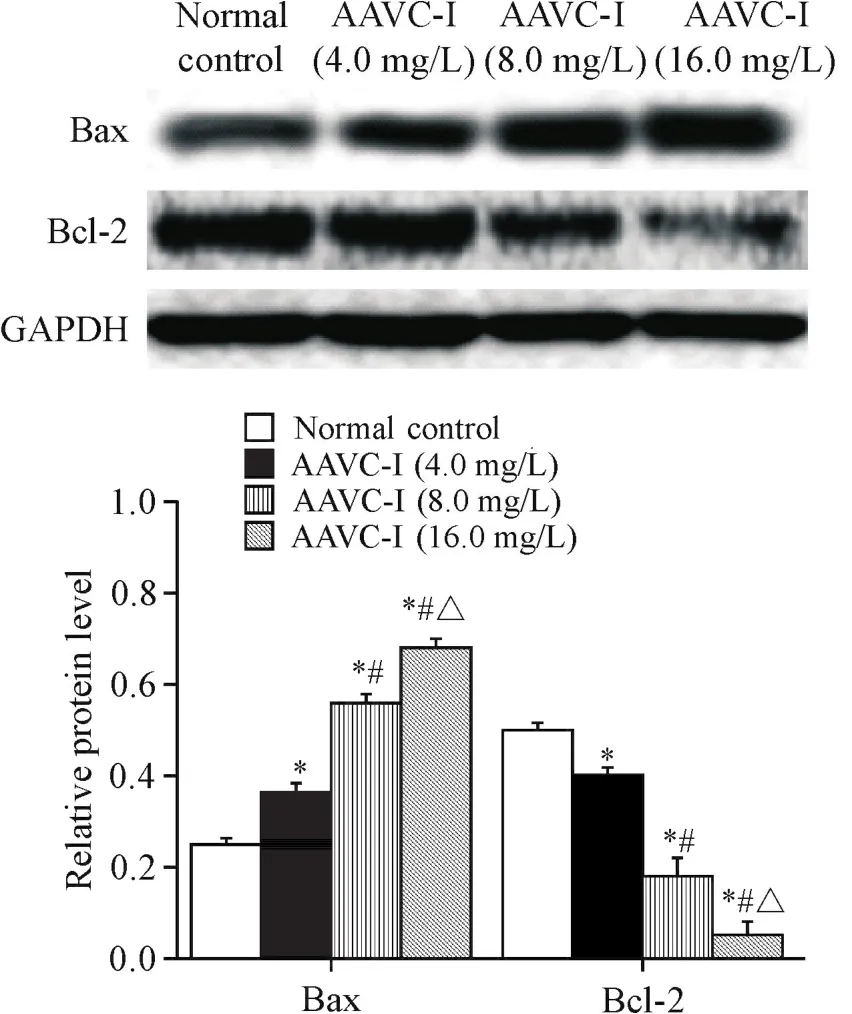
Figure 6.The protein expression levels of Bax and Bcl-2 in Tca8113 cells treated with different concentrations of AAVC-I.Mean±SD.n=3.*P<0.05 vs normal control group;#P<0.05 vs AAVC-I(4.0 mg/L)group;△P<0.05 vs AAVC-I(8.0 mg/L)group.图6 AAVC-I对Tca8113细胞Bax和Bcl-2蛋白表达水平的影响
本实验首先应用MTT法检测不同浓度的AAVCI对人舌鳞癌Tca8113细胞活力的抑制作用。结果显示,在AAVC-I处理Tca8113细胞24 h后,随着浓度的增加,AAVC-I对细胞活力的抑制作用逐渐增强;另外,根据IC50值确定AAVC-I的合适实验浓度,继续作用细胞24 h,HE染色结果可以直接观察到细胞凋亡的形态学变化。在AAVC-I作用肺癌、白血病等[7-10]肿瘤细胞的既往研究表明,AAVC-I在抑制肿瘤细胞增殖的同时也诱导细胞的凋亡,与本文结果一致,且本实验采用annexin V-FITC/PI法检测细胞凋亡水平的结果进一步显示了AAVC-I诱导Tca8113细胞凋亡的作用呈剂量依赖性。相关文献报道,细胞凋亡主要是由于抗凋亡蛋白与促凋亡蛋白的平衡失衡而导致的,其中Bcl-2蛋白家族在当中起着重要作用[19-21]。我们应用Western blot检测显示,在AAVC-I诱导细胞发生凋亡时促凋亡蛋白Bax的表达水平升高,而抗凋亡蛋白Bcl-2的表达水平降低。有研究证实,在ERS诱导细胞凋亡的过程中,过表达的CHOP蛋白会引起Bcl-2蛋白家族的失衡而导致细胞凋亡[22-23]。本实验结果也显示,随着AAVC-I浓度的增加,细胞凋亡率逐渐上升,CHOP蛋白的表达水平也随之升高。在这一过程中,当AAVC-I诱导细胞发生凋亡时,我们又进一步检测了ERS标志性蛋白GRP78的表达量,结果显示其表达水平亦升高。有研究发现,ERS标志性蛋白GRP78在细胞发生ERS时表达量显著增加,进而减缓ERS对细胞的损伤,同时GRP78与内质网跨膜蛋白PERK解离,导致PERK蛋白激活自身磷酸化,磷酸化的PERK会进一步导致eIF2α蛋白磷酸化以抑制蛋白质的合成,从而减少错误折叠蛋白在内质网的聚集,有助于恢复内质网稳态[24-25]。本实验同样观察到AAVC-I各浓度组的磷酸化PERK和磷酸化eIF2α蛋白水平均高于正常对照组,同时ATF4蛋白水平也升高。ATF4蛋白是ERS相关的PERK/eIF2α通路下游重要的转录因子,持续ERS时磷酸化的eIF2α蛋白会导致ATF4蛋白合成大量增加并与CHOP基因启动子结合使CHOP蛋白大量表达,最终引起细胞凋亡[26-27]。国内外研究表明,敲除CHOP基因和在缺氧条件下发生的ERS中沉默PERK基因,均可显著抑制细胞凋亡[28-29]。这进一步佐证了本研究的结果。
在之前的蛇毒抗肿瘤研究中,我们只是针对蛇毒抗肿瘤效应进行简单研究分析[7-10],而本实验在蛇毒抗肿瘤效应的基础上进一步探讨其诱导凋亡的机制,表明AAVC-I在诱导人舌鳞癌Tca8113细胞凋亡时ERS相关的PERK/eIF2α通路发挥着重要作用,这为蛇毒抗肿瘤的机制提供了实验依据。但还需注意的是,由于蛇毒成分复杂,纯化技术难度大,蛇毒促肿瘤细胞凋亡的ERS相关PERK/eIF2α通路机制是否与其它促凋亡机制之间存在联系等问题还有待深入研究。
同时,细胞系作为体外模型而被广泛应用于生物医学研究。不同细胞系之间可能存在交叉污染,其中最为常见的是多种细胞系受到HeLa细胞污染[30-32],而本研究中所用到的人舌鳞癌Tca8113细胞也不能排除受到HeLa细胞的污染[33],但本教研室对蛇毒抗多种肿瘤细胞的大量研究证实,蛇毒抑制肿瘤细胞增殖及促进凋亡的作用是值得肯定的。

