胆管癌脾酪氨酸激酶表达增高对肿瘤微环境巨噬细胞M2型极化的影响*
袁 辉,林泽龙,胡 敏,蒋煜川,刘 珂,曲 辰,洪 健,,△
(1南方医科大学中西医结合医院肿瘤中心,广东广州510315;2暨南大学附属第一医院肝胆外科,3暨南大学药学院药学系,4暨南大学基础医学院病理生理系,广东广州510632)
胆管癌(cholangiocarcinoma,CCA)恶性程度高,易向周围组织侵犯及远处转移,预后极差[1-2],患者的5年生存率仅为20~30%。手术切除、化疗和辅助放疗是胆管癌的主要治疗手段,尚缺乏有效的靶向药物[3]。胆管癌发生发展是一个多因素、多阶段和多步骤的慢性演变过程,主要包括胆管增生、胆管异型增生、胆管瘤和胆管癌[4-5]。因此,探索胆管癌发生发展的调控机制与有效靶标,是目前胆管癌研究的重要方向。前期研究中我们观察到肝脏增生的胆管中脾酪氨酸激酶(spleen tyrosine kinase,SYK)表达显著升高[6],本研究拟通过构建自发诱导的大鼠和小鼠肝内胆管癌模型,进一步探究胆管癌演变进程和人胆管癌组织中SYK的表达变化及其作用机制。
材料和方法
1 组织标本
本研究涉及的48例人胆管癌标本和癌旁肝组织(距肿瘤边缘<2 cm)及15例人正常肝组织标本(患者因血管瘤接受切除手术)均来自暨南大学附属第一医院。上述标本均获明确的病理学诊断,术前未接受过任何抗肿瘤治疗。本研究获得暨南大学附属第一医院伦理委员会的批准,符合医学伦理学规定。
2 实验动物
SPF级雄性SD大鼠40只[8~9周龄,体重(350±20)g]和SPF级雄性BALB/c小鼠30只(7周龄)均购于南方医科大学动物实验中心[许可证号为SCXK(粤)2016-0041],饲养于独立通气笼盒(individually ventilated caging,IVC)系统中,温度为(23±1)℃,湿度为45%,自由饮食。
3 实验试剂
硫代乙酰胺(thioacetamide,TAA)和二乙基亚硝胺(diethylnitrosamine,DEN)均购自 Sigma-Aldrich;SYK抑制剂entospletinib(GS-9973)购自Selleck;苏木精-伊红(hematoxylin and eosin,HE)染色试剂盒购自珠海贝索生物技术有限公司;磷酸盐缓冲液(phosphate-buffered saline,PBS)、柠檬酸盐缓冲液、山羊血清和抗体稀释液均购自北京中杉金桥生物技术有限公司;抗SYK、CK19、CD163和诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)抗体均购自Abcam;免疫组化II抗及辣根过氧化氢酶DAB显色试剂盒购自Dako;荧光II抗和细胞核染色试剂(DAPI)购自Thermo Fisher。
4 主要方法
4.1 大鼠肝内胆管癌模型的构建[7]、分组及处理将40只大鼠随机分为实验组(35只,每天饮用含300 mg/L TAA的饮用水)和空白对照组(5只,正常饮水),饲养于IVC系统中,每周2次监测体重变化,分别于第9、12和16周末每次处死3只大鼠,第24周末处死16只大鼠,开腹观察肝脏表面及其病变情况,切取部分肝脏(病变)组织,中性福尔马林固定,常规石蜡包埋。24周后,将剩余的10只SD大鼠随机分为对照组和SYK抑制剂(7.5 mg/kg)组,每组5只,每天定时灌胃给药,对照组给予等体积的溶剂。每周2次监测体重变化并观察大鼠状态,共持续4周。麻醉下开腹观察肝脏表面及其病变情况,切取部分肝脏(病变)组织,中性福尔马林固定,常规石蜡包埋。
4.2 小鼠肝内胆管癌模型的构建[5]雄性BALB/c小鼠30只,饲养于IVC系统中。将小鼠随机分为空白对照组(6只,不作任何处理)和实验组(24只)。实验组小鼠于第1和2周,给予DEN(100 mg/kg)腹腔注射;于第5周末,在1%戊巴比妥钠(50 mg/kg)麻醉下,开腹行左中位胆管结扎;从第6周开始至第28周,每周给予DEN(25 mg/kg)灌胃1次。每周2次监测体重变化,分别于第9、12和16周末每次处死5只小鼠,第28周时处死剩余小鼠,开腹观察肝脏病变情况,切取部分肝脏(病变)组织,中性福尔马林固定,常规石蜡包埋。
4.3 免疫组织化学染色 制备2 μm厚的肝组织连续切片,常规脱蜡水化,滴加3%双氧水,消除内源性过氧化物酶的活性后微波修复抗原,冷却至室温后山羊血清37℃封闭30 min,抗SYK、CK19、iNOS和CD163抗体用抗体稀释液1∶100稀释,4℃孵育过夜;PBS漂洗后滴加生物素标记的II抗,室温孵育30 min,DAB显色,苏木精染色,常规脱水透明封片。
4.4 免疫荧光染色 切片常规脱蜡水化,微波修复抗原,冷却至室温,山羊血清37℃封闭30 min,加入混合抗体[抗SYK抗体(1∶100)+抗iNOS抗体或抗CD163抗体(1∶50)],4℃孵育20小时;PBS漂洗后滴加荧光标记的II抗,室温孵育60 min;PBS漂洗后DAPI染色,吹干封片,使用荧光显微镜观察。
5 统计学处理
采用GraphPad Prism 7软件进行统计分析,数据以均数±标准差(mean±SD)表示,组间均数比较采用t检验或单因素方差分析,两变量的相关分析采用Pearson直线相关分析法。以P<0.05为差异有统计学意义。
结 果
1 成功构建大鼠和小鼠肝内胆管癌模型
在大鼠胆管癌模型中,肝脏大体形态与显微镜下肝组织改变:第9周末肝脏形态正常,镜下可见部分汇管区小胆管增生,即胆管细胞数目增多,增生后的胆管有明确的边界和管腔结构,未见细胞异型性;第12周末大鼠肝脏表面有凹凸不平小颗粒,镜下可见部分胆管异型增生,即增生的胆管具有异常的管腔轮廓,细胞核大、深染、异型性,核膜不规则,明显的核仁和核极性丧失,未侵犯周围组织;第24周末大鼠肝脏颜色晦暗,表面凹凸不平,可见多个白色圆形质硬结节(直径最大约10 mm),通过HE染色法观察到细胞发生癌变,具有细胞核大、深染、异型性等组织学改变,侵及周边正常肝组织,CK19染色(肝脏胆管细胞来源的特征性标志物)确诊为胆管癌,见图1(红色箭头所指分别为大鼠正常胆管、胆管增生、胆管异型增生和胆管癌中的CK19阳性细胞)。
在小鼠胆管癌模型中,第12周末小鼠肝脏形态大致正常,镜下可见部分小胆管增生(具体组织学改变同大鼠胆管增生);第16周末小鼠肝脏表面有质软囊性肿物,镜下HE染色可诊断为胆管瘤,肝汇管区可见局灶性紊乱排列的胆管,细胞未见明显异型性;第28周末肝脏可见不规则白色质硬结节(最长径约10 mm),HE染色可见异型肿瘤细胞,CK19染色证实为胆管细胞来源,见图2(红色箭头所指分别为小鼠正常胆管、胆管增生、胆管瘤和胆管癌中的CK19阳性细胞)。
2 胆管癌演变进程中SYK表达逐渐升高
肝组织中SYK阳性染色为棕黄色或棕褐色,定位于细胞质和细胞核,正常肝细胞存在SYK阳性表达,而正常胆管细胞未见SYK阳性表达。与大鼠正常肝组织的胆管细胞相比,胆管增生时开始出现SYK异常表达(表达水平相对较低),随着疾病进展,SYK表达水平逐渐增高,在胆管异型增生和胆管癌组织中SYK均呈阳性表达(P<0.01),见图3A(红色箭头所指为胆管结构和胆管癌中的SYK阳性细胞)。小鼠模型中SYK表达呈现相似趋势:肝脏胆管增生组织中开始呈现SYK异常表达,在胆管瘤和胆管癌中SYK表达逐步升高(P<0.01),见图3B(红色箭头所指为胆管结构和胆管癌中的SYK阳性细胞)。
3 胆管癌组织中M2型巨噬细胞浸润增加
与大鼠和小鼠正常肝组织相比,相应胆管癌组织中M2型巨噬细胞(CD163阳性)浸润数目增多,而M1型(iNOS阳性)数目相对减少(P<0.01),见图4(红色箭头所指为iNOS/CD163阳性细胞);但在胆管癌发生早期(胆管增生、异型增生和胆管瘤)的病变组织中,未见M1和M2型巨噬细胞的浸润数目显著变化。此外,在48例人胆管癌/匹配癌旁肝组织和15例正常肝组织中,免疫组化染色显示CD163阳性细胞在肿瘤周围区域的浸润数量显著高于肿瘤内区域和正常肝组织(P<0.01),见图5A(红色箭头所指为CD163阳性细胞)。
4 胆管癌组织中SYK与M2型巨噬细胞的相关性
检测48例人胆管癌/匹配癌旁肝组织和15例正常肝组织中SYK的表达情况,结果显示人胆管癌组织中的SYK表达量均显著高于癌旁和正常肝组织(P<0.01),见图5A(红色箭头所指为胆管癌中SYK阳性细胞)。对人胆管癌组织的SYK和CD163表达进行Pearson相关分析显示,SYK的异常表达与浸润的CD163阳性细胞数呈正相关,即与M2型巨噬细胞浸润数量呈正相关(r=0.57,P<0.01),见图5B。通过SYK与iNOS或CD163免疫荧光共染显示,正常肝脏胆管组织存在大量的M1型巨噬细胞,少量M2型巨噬细胞,未见SYK表达;胆管癌组织中SYK与CD163高表达,未见iNOS明显表达,见图5C。
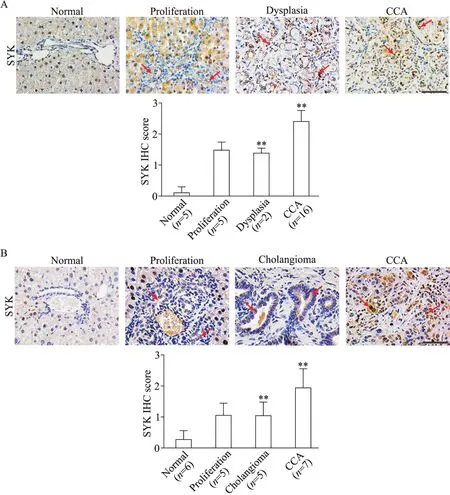
Figure 3.SYK expression was gradually increased in two murine spontaneous induction models of cholangiocarcinoma(CCA).Immunohistochemical(IHC)analysis for SYK protein expression in the development of rat(A)and mouse(B)CCA models.The scale bar=100 μm.Red arrows indicate SYK positive cells.Mean±SD.**P<0.01 vs normal group.图3 SYK在大鼠和小鼠胆管癌演变进程中的异常表达
5 靶向SYK治疗抑制大鼠胆管癌的肿瘤生长和巨噬细胞M2型极化
对照组的大鼠肝脏表面可见多个白色圆形质硬结节(直径最大约10 mm),SYK抑制剂(GS-9973)组的大鼠肝脏肿瘤直径较小,数量较少,差异有统计学意义(P<0.01),见图6(黄色圆圈部分为胆管癌)。通过HE染色,进一步证实肝脏表面的白色圆形质硬结节为胆管癌病变;此外,与对照组相比,SYK抑制剂组肝脏组织中M2型巨噬细胞的数量显著减少(P<0.01),见图6。
讨 论
胆管癌是一种预后较差的肝脏原发恶性肿瘤。近年来,其发病率和死亡率逐年升高[8]。胆管癌发病隐匿,确诊时常为晚期,手术、化疗和放疗等传统治疗手段疗效有限,因此发展胆管癌早期诊断(干预)与新靶向治疗手段是胆管癌防治研究的重要方向。本研究通过构建大鼠和小鼠原发肝内胆管癌模型,模拟了包括胆管增生、胆管异型增生和胆管瘤,到最终形成胆管癌的人类胆管癌发生发展演变进程。结果显示,增生的胆管细胞和胆管癌细胞中高表达的SYK可能通过诱导M2型巨噬细胞极化和浸润,促进胆管癌发生发展。

Figure 4.The infiltration of M2 macrophages was increased in two murine spontaneous induction models of cholangiocarcinoma(CCA).Immunohistochemical analysis for M1 macrophages(iNOS)and M2 macrophages(CD163)infiltrating in rat(A)/mouse(B)CCA and normal liver tissues.The scale bar=100 μm.Red arrows indicate iNOS/CD163 positive cells.Mean±SD.n=5 in normal group;n=16 in CCA group.**P<0.01 vs normal group.图4 胆管癌自发诱导动物模型中M2型巨噬细胞浸润增加

Figure 5.Relationship between SYK expression and M2 macrophage infiltration in human cholangiocarcinoma(CCA)tissues.A:immunohistochemical(IHC)staining of SYK and CD163(M2 macrophage marker)in 48 human CCA tissues(peritumor and intratumor),and analysis of SYK IHC scores and CD163+M2 macrophage infiltration(red arrows indicate SYK/CD163 positive cells);B:the expression of SYK is positively correlated with M2 macrophage infiltration in human CCA tissues;C:double immunofluorescence images for SYK(green)and CD163/iNOS(red)in normal and CCA liver tissues.The scale bar=100 μm.Mean±SD.**P<0.01 vs normal group;##P<0.01 vs peritumor group.图5 人胆管癌组织中SYK表达与M2型巨噬细胞浸润的关系

Figure 6.SYK inhibitor GS-9973 inhibited the tumor growth and M2 macrophage polarization in progressive rat model of cholangiocarcinoma(CCA).Gross images,HE staining and immunohistochemical analysis for M2 macrophages(CD163)were shown.Red arrows indicate CD163 positive cells.The scale bar=100 μm.Mean±SD.n=5.**P<0.01 vs vehicle group.图6 SYK抑制剂GS-9973抑制大鼠胆管癌的肿瘤生长和巨噬细胞M2型极化
SYK是一种非受体型酪氨酸激酶,正常生理条件下主要参与淋巴细胞成熟及免疫细胞活化[9]。近年来研究显示,在免疫性疾病[10]、白血病[11]、乳腺癌[12]、肝癌[13]、卵巢癌[14]等病理过程中,SYK同样发挥重要功能。我们前期研究结果显示,肝纤维化组织中,SYK表达增高;SYK可促进肝星状细胞的激活与增殖;靶向SYK可有效抑制动物肝纤维化进展及其肝癌发生,是治疗肝脏纤维化的潜在靶点[6]。目前,已研发出多种SYK小分子化合物抑制剂,并应用于多种疾病(包括类风湿性关节炎、慢性淋巴细胞白血病等)的Ⅱ/Ⅲ期临床试验。
具有免疫抑制作用的M2型巨噬细胞,在多种恶性肿瘤的发生发展过程中发挥重要促进作用[15-16]。SYK参与了血液肿瘤和多种实体肿瘤的免疫应答和反应,对巨噬细胞的增殖分化及其产生的生物学效应具有重要作用[17]。本课题组在前期关于肝纤维化的研究中观察到:在大鼠胆管结扎模型中,由胆管结扎引起的增生胆管细胞内出现SYK表达显著升高,并且增生胆管周围伴有M2型巨噬细胞浸润增加。为进一步研究增生胆管细胞中SYK高表达与M2型巨噬细胞浸润的关系,以及对胆管癌发生发展的影响。在本研究中,我们构建了两种动物胆管癌自发诱导模型,模拟了人胆管癌从胆管增生、胆管异型增生、胆管瘤,到最终形成胆管癌的演变过程。上述两个动物模型的结果显示:随着胆管癌的发生过程,SYK表达水平逐渐增高,提示SYK表达与胆管癌发生发展相关;胆管癌中SYK异常表达伴随M2型巨噬细胞浸润数目增多,提示SYK可能参与诱导巨噬细胞M2极化,这一结果在人胆管癌组织标本中得到进一步验证。此外,TAA诱导的大鼠自发胆管癌模型给予SYK抑制剂处理,结果显示SYK抑制剂可以显著减少胆管癌组织中的M2型巨噬细胞浸润,并抑制胆管癌发生发展。上述结果表明,随着胆管癌的演变进展,SYK表达逐渐升高,可能是通过影响巨噬细胞M2型极化促进肿瘤进展,SYK抑制剂可以有效抑制肿瘤生长和巨噬细胞M2型极化。
本研究表明,SYK异常表达与胆管癌发生发展密切相关:在胆管癌发生早期,即胆管增生时就已经出现SYK异常表达,并随着病程进展逐渐升高;而增生胆管细胞和胆管癌细胞中高表达的SYK可以通过诱导微环境M2型巨噬细胞极化与浸润进,促进胆管癌进展。这些结果虽然揭示了胆管癌中SYK对M2型巨噬细胞浸润的影响,但其具体调控机制仍不明确。有研究报道,巨噬细胞的极化依赖于PI3K信号通路,PI3K可引起肿瘤中致瘤性巨噬细胞(多数为M2型巨噬细胞)的增多。此外,SYK是激活巨噬细胞中PI3K所必需的,在PI3K的上游发挥重要作用。基因敲除或药理抑制SYK和PI3K,均可以阻断肿瘤的生长和巨噬细胞介导的免疫抑制,激活先天性和适应性抗肿瘤免疫力。因此,SYK可能通过PI3K通路影响肿瘤中巨噬细胞极化,是重要的肿瘤免疫学靶标之一[18]。在后续研究中,本课题组将继续深入探索胆管癌进展中SYK的功能与调控机制,重点关注SYK对胆管癌细胞旁分泌细胞因子的影响与调控作用,以进一步明确胆管癌细胞SYK影响M2型巨噬细胞极化的分子机制。
综上所述,本研究提示SYK在胆管癌发生发展过程中发挥重要作用,可能成为胆管癌早期干预与靶向治疗的潜在靶点。此外,我们还初步探讨了胆管癌中SYK异常表达对巨噬细胞M2型极化的影响,为进一步深入开展胆管癌SYK的具体调控机制提供了参考资料。

