肾移植术后再次体外循环心脏手术1 例报道
倪寅凯,赵金龙,付 亮,路喆鑫,陈宗辉,励 峰
上海交通大学附属第六人民医院心血管外科,上海 200233
心脏疾病是肾移植术后患者死亡的主要原因,约占全因死亡的40%[1]。目前临床上肾移植患者中合并心脏疾病者逐渐增多,肾移植已非心脏手术的禁忌。但体外循环可能导致肾功能受损,肾移植后免疫抑制治疗可能导致严重感染,肾移植后钙代谢异常会导致瓣膜钙化,这些都增加了肾移植患者心脏手术围术期管理的难度。总体来说,有关肾移植术后进行心脏瓣膜手术的报道较少。
1 临床资料
1.1 基本资料
患者71 岁,男性,反复活动后胸闷、气促半年余入院。超声心动图提示二尖瓣瓣尖对合、对位欠佳,瓣叶增厚,重度反流;三尖瓣重度反流;轻度肺动脉高压(40 mmHg,1 mmHg=0.133 kPa);左心房扩大(82 mm×58 mm),右心房扩大(73 mm×67 mm),右心室扩大,基底段左右径61 mm;房间隔缺损修补术后,心房水平未见残余分流,左心室射血分数为60%。
1.2 既往史
患者1983 年曾因先天性心脏病、房间隔缺损行体外循环下房间隔缺损修补术。2009 年曾诊断为心房颤动。2010年曾因肾功能衰竭行右肾移植术;术后长期口服环孢素(50 mg/次,2 次/d)及吗替麦考酚酯(250 mg/次,2 次/d)。
1.3 查体
患者身高168 cm,体质量54 kg,胸部正中陈旧性手术瘢痕,双肺呼吸音粗,心率80 次/min,律不齐,二尖瓣听诊区可及2/6 级收缩期杂音,双下肢不肿。
1.4 辅助检查
血常规检查示血红蛋白112 g/L。肾功能检查示尿素19.34 mmol/L、肌酐155 μmol/L、尿酸460.3 μmol/L。心电图检查示心房颤动。双肾超声检查示肾移植术后右肾区2个肾脏,其一73 mm×38 mm,皮、髓质结构不清,内见囊状暗区,46 mm×39 mm;其二100 mm×33 mm,形态正常,肾包膜完整,皮、髓质结构清晰。彩色多普勒血流显像示肾血流正常分布,左肾73 mm×38 mm,皮、髓质结构不清,内见数个囊状暗区,较大者28 mm×27 mm。
1.5 诊断及治疗
诊断为心脏瓣膜病、二尖瓣重度关闭不全、三尖瓣重度关闭不全、心房颤动、心功能不全Ⅱ级、房间隔缺损修补术后慢性肾功能不全、右肾移植术后。
患者术前予以强心、利尿、低分子肝素抗凝、维持电解质平衡等治疗。于2019 年4 月26 日在全身麻醉下行二尖瓣生物瓣置换+三尖瓣生物瓣置换+心房颤动消融术。术中游离右侧股动脉备用,同时摇摆锯劈开胸骨,分离粘连,升主动脉及上、下腔静脉分别插管,上下腔静脉套带,阻断升主动脉、心脏停搏,切开右心房、房间隔,左心房、右心房分别单极消融,显露二尖瓣,二尖瓣瓣叶对合差,瓣叶增厚钙化,重度关闭不全,植入生物瓣(圣犹达,27 号),丝线关闭房间隔切口,复温,主动脉根部排气,开放主动脉阻断后心脏自动复跳,窦性心律。探查三尖瓣瓣环显著扩大、重度关闭不全,植入生物瓣(圣犹达,31 号)。关右心房切口。心外膜缝临时起搏导线。术中浅低温体外循环,共转机97 min,阻断44 min,灌注流量3 000 ~3 690 mL/min,灌注压力50 ~70 mmHg,术中超滤1 000 mL。免疫抑制剂的应用剂量同术前,术后口插管期间置胃管注入,进食后改为口服。患者术后第2 日拔除口插管,术后第3 日转回普通病房。术后应用头孢呋辛(1 g/次,2 次/d,静脉滴注)预防感染。患者术后3 d体温未超过38 ℃,血常规、C 反应蛋白、降钙素原及胸片等指标基本正常,停用预防性抗生素。患者术后未发生急性排斥及严重感染。围术期患者未进行透析,尿量维持可,尿素及肌酐水平与术前相仿。患者围术期尿量、肾功能指标见表1。
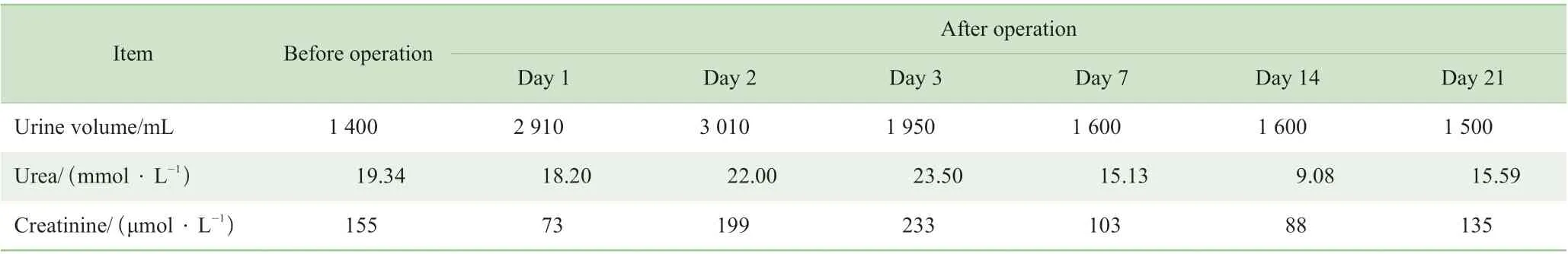
表1 患者围术期尿量及肾功能指标Tab 1 Perioperative urine volume and renal function
2 讨论
体外循环的低温、低灌注容易造成移植肾功能的损害,因此,肾移植患者行体外循环心脏手术的风险较正常人高,国外报道[2]患者死亡率为0 ~20%。
肾移植患者行体外循环心脏手术,围术期应注意以下几点:术前保证肾脏灌注,适量应用利尿剂减轻移植肾的负担;术中缩短体外循环时间,保证足够的灌注流量[70 ~75 mL/ (kg·min) ]和灌注压(50 ~65 mmHg)[3];术后选用低肾毒性的抗生素,若长期应用抗生素,应警惕真菌感染。
对于术后免疫抑制剂的应用,仍有不同观点。王明岩等[4]认为,免疫抑制剂可能导致患者术后免疫力过低,造成感染和切口愈合不良,建议采用适当减量的方法;但是,免疫抑制治疗的中断或减量,也可能导致急性排斥反应发生。因此,张秋霞等[5]认为,术后可按照原有的方案和剂量使用免疫抑制剂。
本例患者因超声心动图检查提示二尖瓣瓣叶增厚伴有钙化,合并重度反流,三尖瓣瓣环明显扩大,结合患者年龄及肾功能等情况,我们选择了更为确切的二尖瓣、三尖瓣生物瓣置换,保留瓣下结构。术后复查超声心动图,显示二尖瓣及三尖瓣生物瓣无明显异常,使患者安全度过围术期。因为患者为第二次心脏手术,存在广泛粘连,无法游离双侧肺静脉及左心耳,因此我们仅选择了单极消融,并且未处理左心耳。患者术后复查心电图仍存在心房颤动,可能与术前心房较大、单极消融效果不确切有关;后期如有必要可进一步行经股静脉左心耳封堵术。患者术后3 d 肾功能有一过性升高改变,考虑与体外循环期间肾脏低灌注有关,后逐步回落至术前水平,说明体外循环下瓣膜置换手术对患者肾功能的影响是安全可控的。
肾移植术后行体外循环心脏手术的病例并不多见,再次行体外循环心脏手术的病例报道更少。我们认为,通过术中缩短体外循环时间,保证足够灌注流量和灌注压,围术期继续应用免疫抑制剂等方法,能够减轻肾功能损害,避免急性排斥反应和严重感染的发生。因此,对移植肾功能良好的患者行体外循环心脏手术是可行的。
参·考·文·献
[1] ShaRma A, GilBerTson DT, Herzog CA. Survival of kidney transplantation patients in the United States after cardiac valve replacement[J]. Circulation, 2010, 121(25): 2733-2739.
[2] Dresler C, Uthoff K, Wahlers T, et al. Open heart operations after renal transplantation[J]. Ann Thorac Surg, 1997, 63(1): 143-146.
[3] 陈燕桦, 张炳东. 体外循环的肾损伤及其保护[J]. 广西医科大学学报, 2013, 30(3): 478-480.
[4] 王明岩, 高长青, 李伯君, 等. 肾移植术后行体外循环心脏手术的围术期处理[J]. 中华胸心血管外科杂志, 2010, 26(6): 419-425.
[5] 张秋霞, 刘梅. 肾移植术后体外循环下主动脉瓣置换1 例[J]. 局解手术学杂志, 2017, 26(1): 76-77.
——体外循环质量控制的基石

