CT表现为肺内纯磨玻璃样患者浸润性腺癌的影响因素
廖建勇,杜静波,刘迎新,勾振恒,苏晓华,陈天金
随着低剂量胸部CT体检广泛开展,肺内结节,特别是磨玻璃密度结节(ground glass nodule, GGN)检出率大大提高[1]。GGN根据是否含有实性成分分为纯磨玻璃结节(pure ground glass nodule, pGGN)和混合磨玻璃结节(mixed ground glass nodule, mGGN)。pGGN是指半透明状密度增高影,但不掩盖其内走行的血管和支气管,只能在CT肺窗可见,纵隔窗不可见[2]。pGGN可为炎性反应、局灶性纤维化,也可以是肺腺癌。2011年肺腺癌被重新分类为浸润前病变[不典型腺瘤样增生(atypical adenomatous hyperplasia, AAH)、原位腺癌(adenocarcinoma in situ, AIS)],微浸润性腺癌(minimally invasive adenocarcinoma, MIA),浸润性腺癌(invasive adenocarcinoma, IA)。目前肺腺癌被广泛认同是由AAH-AIS-MIA-IA逐步演变而来[1]。AAH、AIS、MIA与IA的临床诊治原则及手术方式不一致,且预后也不一致,因此术前对pGGN肺腺癌浸润程度评估至关重要。本研究旨在明确IA的独立影响因素。
1 对象与方法
1.1 对象 回顾性分析我院2013-01至2019-01术前CT表现为pGGN经手术病理证实为AAH、AIS、MIA或IA患者81例,男28例,女53例。纳入标准:(1)CT检查为术前1个月以内;(2) pGGN病灶为单发病灶;(3)pGGN病灶在肺窗可见,纵隔窗不可见;(4)患者及家属均知情同意。排除标准:(1)具有其他恶性肿瘤病史;(2) 伪影显著,图像质量差;(3)无明确病理结果者。
1.2 方法
1.2.1 设备仪器及扫描方法 采用美国GE公司Lightspeed 64层螺旋CT扫描仪。取仰卧位、双臂上举、头先进、深吸气后屏气扫描,扫描范围从胸廓入口至肋膈角下缘2~3 cm,扫描参数为管电压120 kV,管电流150~250 mA,层厚及层间距均为5 mm,常规后处理拆薄至1.25 mm。标准重建算法重建肺窗(窗宽1600 Hu,窗位-500 Hu)和纵隔窗(窗宽400 Hu,窗位40 Hu)。
1.2.2 图像分析 所有患者CT图像均由两位多年从事胸部影像诊断工作的副主任医师双盲法阅片,观察并记录病灶最大径、CT值、位置、分叶征、毛刺征、胸膜凹陷征、空泡征、血管集束征、支气管充气征、血管穿行及肺-瘤界面等CT表现。病灶最大径定义为轴位上病灶最大长径与正交最大短径的一半[3]。CT值定义为最大轴位截面所测CT值,ROI测量时尽可能大并避开空泡、大的支气管和血管[4]。位置分类为左、右叶及上、中下叶。空泡征定义为病灶内小于5 mm的空气密度影。血管集束征定义为周边小血管向病灶边缘聚集的改变[5]。血管穿行定义为病灶内小的穿支血管走行。当两位医师意见不一致时,协商达成一致。

2 结 果
2.1 两组一般资料的比较 IA组与非IA组年龄、性别比较差异无统计学意义,见表1。
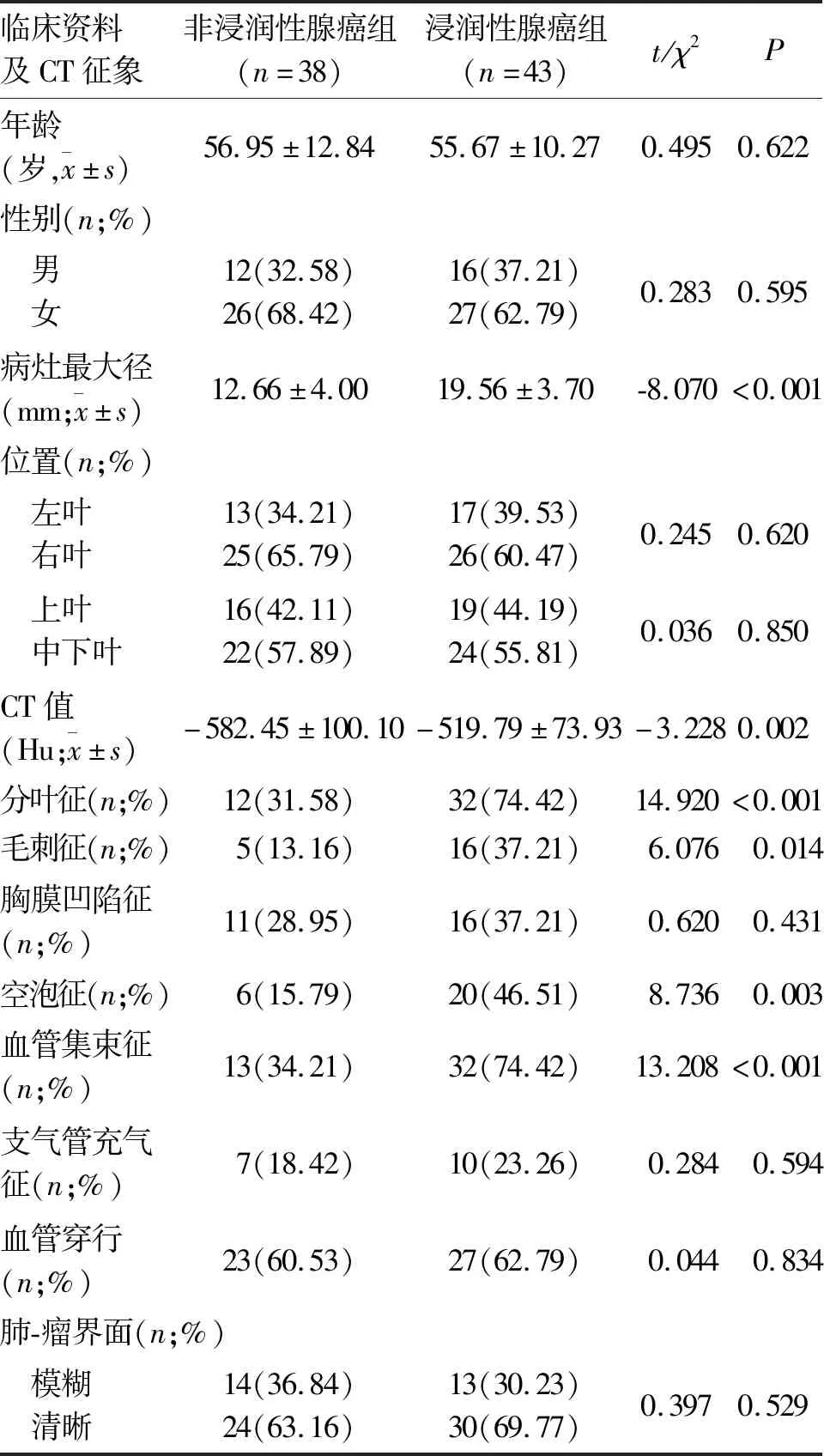
表1 两组CT表现为纯磨玻璃结节患者临床资料及CT征象的比较
2.2 病灶最大径和CT值诊断效能的比较 ROC曲线分析显示病灶最大径曲线下面积(AUC)为0.897,临界值为15.5 mm;CT值AUC为0.701,临界值为-575 Hu;将病灶最大径和CT值联合诊断时,AUC为0.912,诊断效能更佳,见表2。

表2 病灶最大径、CT值及两者联合对预测CT表现为纯磨玻璃结节患者肺腺癌侵袭性的ROC曲线分析
2.3 两组病灶CT征象的比较 IA组与非IA组在病灶最大径、CT值、分叶征、毛刺征、空泡征、血管集束征差异具有统计学意义(P<0.05),而在位置、胸膜凹陷征、支气管充气征、血管穿行及肺-瘤界面差异无统计学意义(P>0.05),见表1、图1。

图1 CT表现为纯磨玻璃结节患者浸润性腺癌
A.女,68岁,病灶位于左肺下叶,病灶大小约23 mm×19 mm,CT值约-452.6 Hu,肺窗轴位可见清晰的肺-瘤界面,其内可见血管穿行;B.女,69岁,病灶位于左肺上叶,病灶大小约21 mm×19 mm,CT值约-567.8 Hu,肺窗轴位可见胸膜凹陷征、分叶征、毛刺征、血管集束征及清晰的肺-瘤界面
2.4 logistic回归分析结果 将病灶最大径及CT值分别按<15.5 mm, ≥15.5 mm和<-575 Hu, ≥-575 Hu分组转换为计数资料,并且把差异有统计学意义的分叶征、毛刺征、空泡征、血管集束征纳入二元logistic协变量,采用后退法得出病灶最大径≥15.5 mm,分叶征及CT值≥-575 Hu为IA的独立影响因素,其OR值分别为17.504、7.258、3.613,见表3。
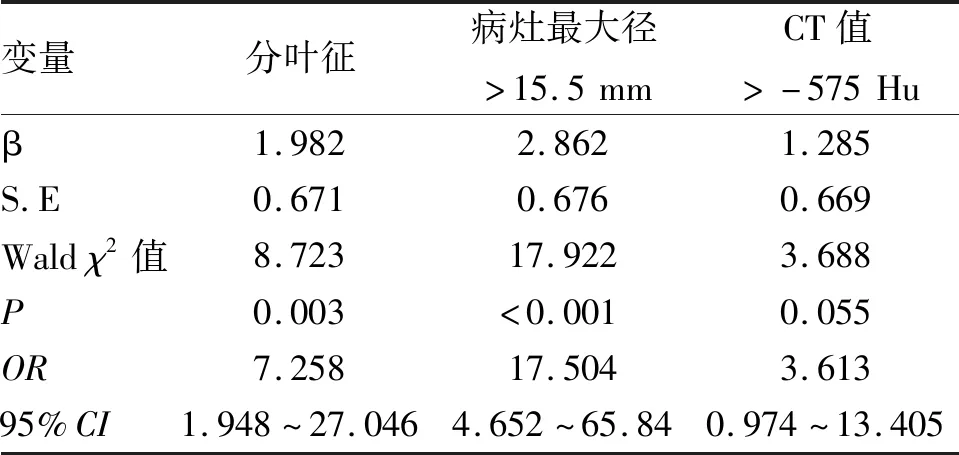
表3 多因素二元logistic回归分析结果
3 讨 论
肺癌已经成为我国恶性肿瘤的首位,每年约59万人死于肺癌[4]。肺癌的高死亡率已经成为影响人类健康最主要的因素之一,其原因主要是不能早发现病灶[4]。随着高分辨率CT的普及,特别是低剂量CT体检的广泛使用,肺内pGGN检出率大大提高[5]。pGGN可以是良性病变,也可以是腺癌的不同发展阶段,有学者认为随诊3个月后还持续存在的pGGN恶性率大大增高[6],但有学者对122例pGGN研究发现90%的pGGN在长期随访中均无明显变化[7]。所以,目前对pGGN定性诊断依然是一个巨大挑战[3]。
本研究显示,pGGN病灶最大径是判断浸润程度的最重要指标。组间比较IA的大小显著大于非IA病变,ROC曲线显示病灶最大径的诊断效能优势明显(AUC=0.897),而且logistic回归分析显示病灶大小是最主要的独立影响因素,其OR值高达17.504倍,意味着pGGN最大径≥15.5 mm患者是小于15.5 mm患者罹患IA的概率达17倍之多。孙梦等[8]认为结节的大小与恶性程度是呈正相关的,它是影响诊疗方案的一个重要因素。刁竹帅等[5]研究发现病灶大小从AAH到AIS、MIA、IA是一个逐步增大的过程,病灶大小是评价pGGN浸润程度检验效价最高且最可靠的客观指标。但目前诊断IA的阈值尚无统一的定论。赵冲[9]报道pGGN浸润前病变与浸润性腺癌的临界值为10.5 mm。时代等[10]分析84例pGGN病灶得出浸润前病变与浸润性腺癌阈值为8.75 mm。张宁等[11]在MRI检查评估下得出鉴别诊断浸润性腺癌与非浸润性腺癌的临界值是11.52 mm。虽然各研究所得临界值不一,但pGGN最大径越大,浸润性腺癌的可能性越大。
本研究显示,CT值同样是一个具有显著鉴别肺腺癌侵袭性的主要因素。肿瘤细胞侵入正常肺组织引起肌成纤维细胞基质增厚的程度决定磨玻璃密度肺腺癌CT值的高低,病灶的CT平均值越高意味着浸润程度越高、侵袭性越强[8]。本研究IA组与非IA组CT临界值为-575 Hu,与胡帅等[1]所报道的IA组与非IA组CT阈值-561.5 Hu,及时代等[10]所报道的浸润前病变组与浸润性病变组CT临界值-605 Hu相近。但有学者研究发现,pGGN的CT值在肺腺癌的组织学亚类之间差异无统计学意义,考虑可能与病变多较小、存在测量误差有关[8]。本研究还进行多变量联合诊断ROC曲线分析发现,当病灶最大径和CT值联合诊断时,诊断效能更佳,AUC达到0.912,灵敏度为83.7%,特异度为86.8%。
本研究还显示IA组分叶征、毛刺征、空泡征及血管集束征显著高于非IA组,其中分叶征在logistic回归分析中成为判断肺腺癌浸润程度独立高危因素,与胡帅等[1]研究结果一致。考虑IA肿瘤细胞差异性生长、对周围的侵袭、对含气肺泡腔的融合破坏及局部摄血量增加导致上述表现,而非IA组相对少见[12]。此外,两组在胸膜凹陷征、支气管充气征占比均较小,而在血管穿行和肺-瘤界面清晰方面占比均较大,差异无统计学意义,与罗继元等[13]研究结果一致,但有学者研究发现胸膜凹陷征是判断肺腺癌侵袭性的一个重要指标[9],考虑结果差异可能与样本量及入组病例的位置有关。
由于本次研究样本量不大,病例选择存在偏倚,结果可能存在偏差,另外未对病灶的横轴面积、头足径线、体积等客观方面进行全面分析,有待今后扩大样本量深入研究,从而为判断肺腺癌浸润程度提供更加详实的数据。
综上所述,pGGN浸润性腺癌更易出现毛刺征、分叶征、空泡征及血管集束征。当肺内出现pGGN病灶最大径≥15.5 mm、CT值≥-575 Hu,同时具有分叶征,高度提示为浸润性腺癌,建议尽早积极手术治疗。

