金属颗粒与纤维悬浮液中天然气水合物生成实验研究
刘真真, 杨 亮, 刘道平, 谢育博
(上海理工大学 能源与动力工程学院,上海 200093)
天然气水合物是在高压、低温条件下形成的类冰状笼型晶体化合物簇[1]。天然气的使用已成为未来能源发展的主要趋势,水合物法储运天然气是近年来业内关注的热点,但在工业应用过程中遇到的最典型的问题是其形成速度慢、转化率低导致储存能力不足。在水合物技术应用上一般使用动态强化或静态强化的方法改善水合物的生成能力。常用的动态强化方法包括搅拌[2-4]、喷雾[5-6]、气体鼓泡[7]等,从节约成本和操作灵活的角度出发,额外引入的机械设备与能耗成本显然是不经济的。静态强化生成技术主要有冰粉接触、添加介质、加入表面活性剂、引入换热结构等方法[8]。十二烷基硫酸钠(sodium dodecyl sulfate, SDS)作为一种常用的水合物生成表面活性剂,在水合物增长期内,可以明显提高水合物生长速率[9],并且能够大大缩短水合物成核的诱导时间[10]。然而,表面活性剂溶液中快速形成水合物的过程中会释放大量水合反应热,滞留在反应体系中的热量将会扰乱水合体系温度稳定性,进而影响整体的气体吸收速度[11]。
大量研究表明,通过改善水合物生成反应过程中的传热和传质条件,可显著加速其生成速率。目前,国内外学者多采用添加多孔介质或导热介质的水/溶液体系进行水合物生成强化研究。文献[12-13]研究了A型沸石在反应溶液中甲烷水合物生成效果,结果表明,A型沸石的存在促进了甲烷水合物的形成,在利用单壁碳纳米管-干法和水合物法两种方法储存甲烷的研究中,证明具有多孔特性的单壁碳纳米管-水合物法储甲烷的过程相对比较稳定,对比单壁碳纳米管-干法甲烷储气量提高80%。Bhattacharjee等[14]利用浮石和防火红粘土的硅质材料作为多孔沉积物来研究水合物生成特性,并研究粒度对水合物形成动力学的影响,观察到水合物的生成随着粒度分数的减少而增强。稳定的多孔结构可以促进水合物在较缓和的环境下生成。然而,多孔介质占据反应溶液中水合物的存储空间,并且在一定程度上限制了水合反应的热传递,从而限制了水合物的储气量和反应速率。
金属纳米材料是具有良好的导热率和表面自由能以及稳定化学性质的介质,近年来被越来越多的学者用于水合物的生成强化研究。Li等[15]研究了在不同质量分数的纳米铜悬浮液中改善水合物反应过程的传热传质效果,实验结果表明,纳米铜的加入增强了 HFC134a水合物的形成。Mohammadi等[16-17]研究了添加合成银纳米粒子与氧化锌纳米粒子对CO2水合物形成的影响,证明了在纳米颗粒存在下可以缩短水合物生长时间并改善储气效果。Kakati等[18]研究了不同质量分数的纳米颗粒与SDS的复配体系对 CH4+C2H6+C3H8水合物的影响,结果发现,此体系能够提高水合物的生成速率、气体消耗量并缩短诱导时间。单一的纳米金属颗粒悬浮溶液中通常不具有连续性,导致水合物形成过程中的热量不能及时释放,从而达不到应有的储气潜能。
通常在静态强化水合物生成实验研究中,研究人员尝试将不同的添加剂进行复配用于促进天然气水合物的生成。不锈钢纤维(stainless steel fiber,SSF)是一种新型工业材料,具有高导热性、高导电性、高强度及耐腐蚀等性能。本文选用SSF和纳米铜颗粒(copper nanoparticles, CNP)作为悬浮材料添加到表面活性剂溶液中,开展压力为4.0~7.0 MPa下天然气水合物生成实验,以研究这种复合体系中天然气水合物的生成特性,复配溶液中均匀散布的纳米铜颗粒与不锈钢纤维构成三维网络,促进水合物生成过程的传热传质。
1 实 验
1.1 材料与装置
实验采用的天然气(甲烷含量87.94%)由上海伟创标准气体分析技术有限公司提供。采用SDS(化学纯CP)作为水合物生成促进剂,由国药集团化学试剂有限公司提供。直径为50~80 nm的CNP以及长度为40 mm,直径为5~10 μm的SSF均由上海凯信纤维科技有限公司(中国)提供,实验中使用尺寸范围为5~10 μm的结冷胶用于稳定反应溶液中的金属颗粒和纤维。
典型的水合实验平台由高压反应系统、温度控制系统、压力控制系统以及数据采集系统构成,实验装置如图1所示,主要由高压反应釜、低温恒温槽、热电阻、压力传感器及数据采集仪等组成,反应釜有效容积为300 cm3。
1.2 实验过程
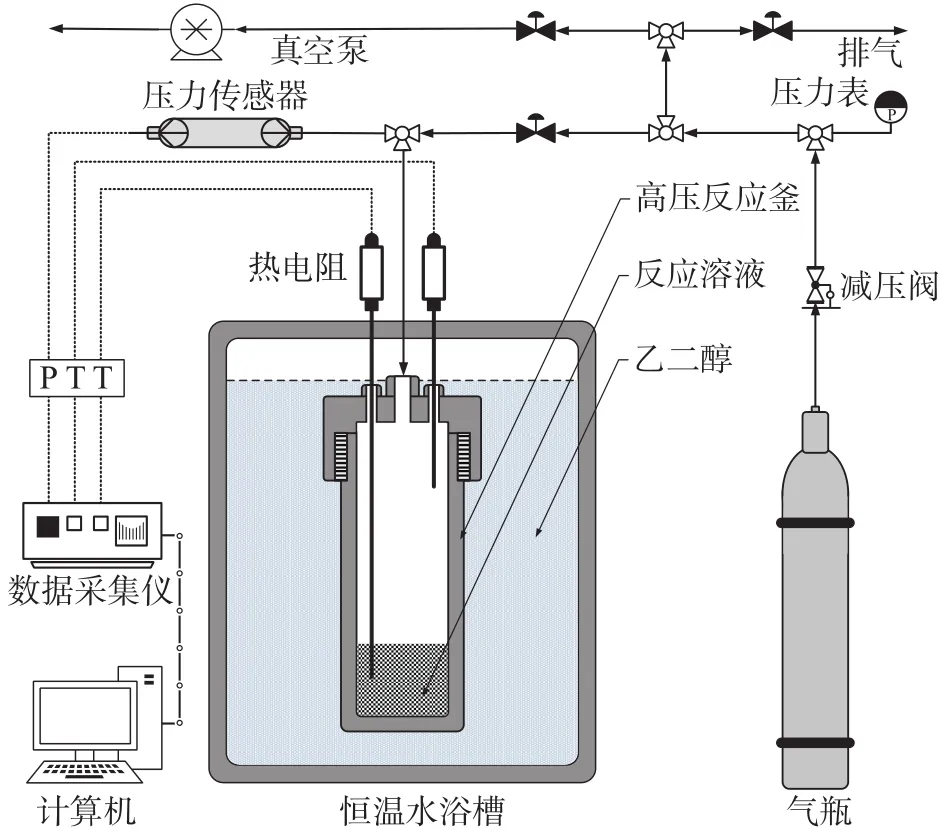
图1 水合物生成实验装置示意图Fig. 1 Schematic diagram of the experimental system
为了制备表面活性剂悬浮液,将SDS溶解在去离子水中,制备质量分数为0.05%(质量分数以溶液为基准,下同)的SDS基础溶液,同时作为对比实验(SDS溶液体系)的反应溶液,在此浓度时表面活性剂对水合物的生成具有良好的促进作用[19]。然后将结冷胶粉末加入到SDS溶液中,制备结冷胶质量分数为0.30%的透明稀释溶液。将此溶液与纳米铜粒子粉末混合倒入搅拌器中搅拌获得悬浮CNP的表面活性剂溶液,然后将SSF加入烧杯中超声振动,最终制备以悬浮溶液为基准的CNP和SSF质量分数均为0.15%的表面活性剂复配反应溶液。
CNP和SSF在表面活性剂溶液中的分布特征如图2所示,从中可以看出,纳米铜颗粒高度分散在溶液中,并存在部分纳米铜颗粒粘附在不锈钢纤维周围。
实验采用恒容法合成天然气水合物,根据合成过程中温度和压力的变化求得水合物的储气量和储气速率。因此,实验开始前需要对反应釜的承压能力、气密性、温度和压力传感器的零点进行检验和校准,其具体的实验步骤如下:
a. 实验前用自制蒸馏水清洗反应釜2次,干燥处理后,将20 ml的反应溶液倒入反应釜,拧紧反应釜盖,连接热电阻和进气管线,然后抽真空。
b. 待水合系统达到真空要求,关闭真空泵,然后用天然气吹扫反应釜2次,排除系统残留的空气,完成后关闭所有阀门。
c. 开启低温恒温槽,将温度设定在274.2 K,启动恒温槽的制冷与循环开关,然后打开数据采集仪,记录温度和压力的数据变化。

图2 复配溶液体系中悬浮的CNP和SSFFig. 2 Image of the hybrid system with suspended CNP and SSF
d. 待数据采集仪显示的温度达到设定温度时,依次打开从天然气瓶到反应釜管线上的阀门,结合压力表和数据采集仪的压力读数,达到设定压力值且数值保持稳定时,关闭阀门。
e. 当温度开始上升、压力下降时,认为天然气水合物开始生成,待反应进行一段时间,温度和压力趋于平稳时,认为水合反应过程完成。
1.3 数据处理方法
水合物的储气量反映了水合体系的储气能力,而水合物的储气速率则直接反映了水合体系储气的快慢程度,实验中主要从水合物储气量、储气速率两个方面对天然气水合物的储气性能进行评价。
采用水合物生成时气体消耗量来计算水合物的储气量,依据气体状态方程,某时刻t天然气的累积消耗量Δn由在这一时刻釜内气体物质的量nt结合初始反应时刻反应釜内气体的物质的量n0计算得出,表示为

式中:P0,T0分别为反应开始时釜内的压力和温度;Pt,Tt分别为反应过程中体系的压力和温度;V0,Vt为反应釜内初始时刻和某时刻压缩天然气体积;R为气体常数;Z0,Zt分别为初始时刻和某时刻的压缩因子,采用Redlich-Kwong方程计算。
单位体积的水合物的储气量Ct由水合物中气体的物质的量Δn与水合物的体积VH求出,表示为
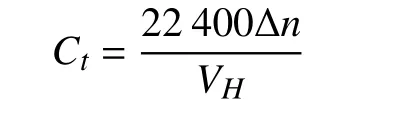
水合物的生成速率是单位时间内天然气消耗能力的表征,可以通过读取气体吸收曲线随时间的变化来确定,在本文中求出的水合速率v是采集时间间隔Δt为10 s内的平均储气速率,表示为

2 结果与分析
2.1 天然气水合物生成
利用纳米铜与不锈钢纤维这两种介质,不仅能在水合反应体系中构建亲水性表面的网络结构,也可以利用金属的热传导性将水合反应热向釜外传递。SDS溶液体系与复配溶液体系中生成天然气水合物的实验条件与结果如表1所示,将储气量累计达到储气终值的90%时所用时间记为t90。对比两种天然气水合物生成体系的实验结果发现,在复合悬浮溶液体系中,水合物形成不仅表现出更好的储气能力,而且表现出比SDS溶液体系更快的气体吸收速率。
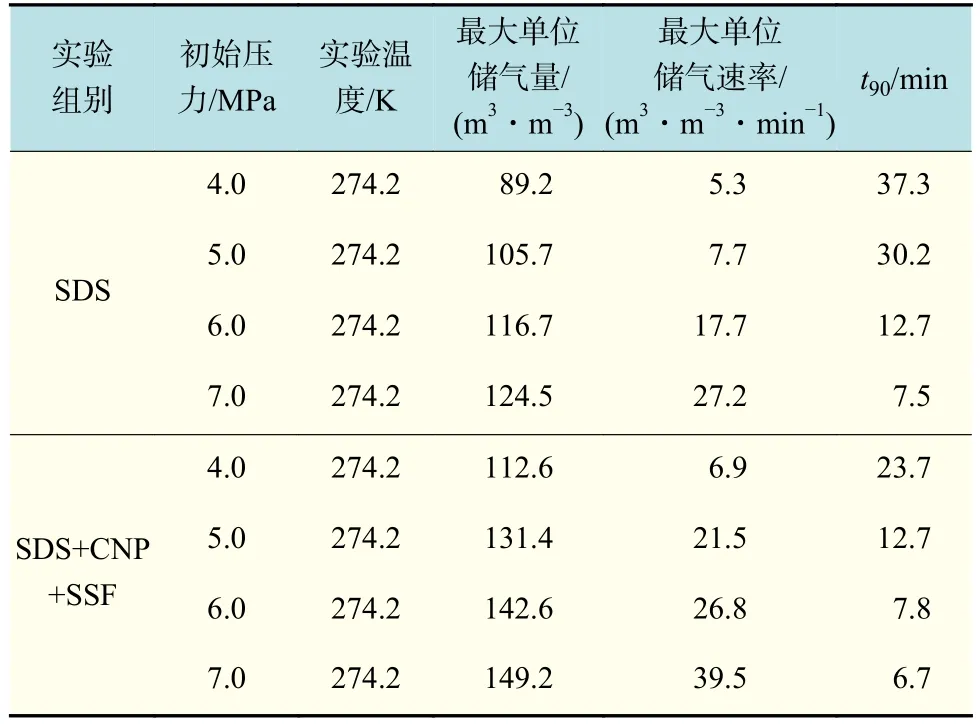
表 1 不同条件下天然气水合物生成结果Tab.1 Experimental conditions and results of natural gas hydrates formation
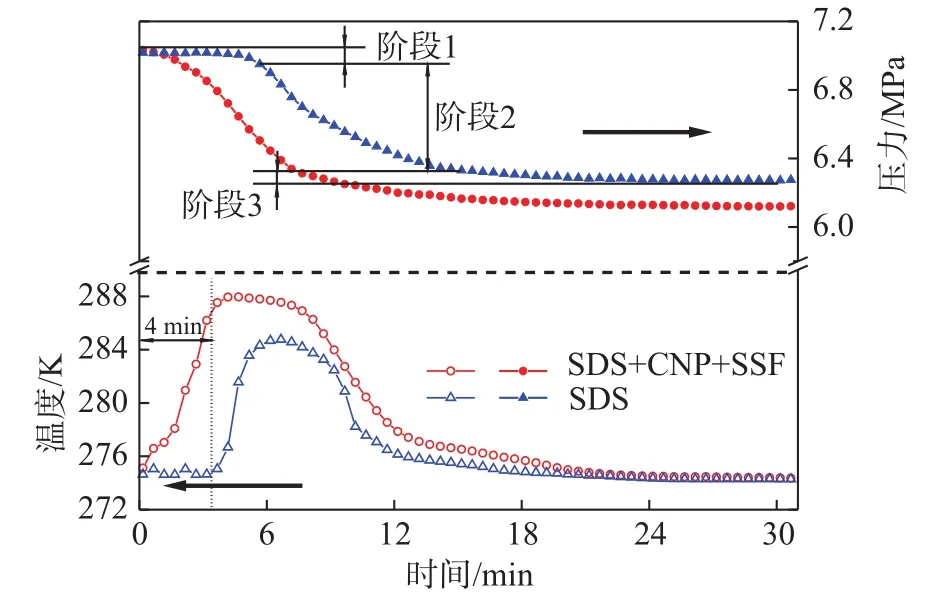
图3 两种体系水合生成物过程中的压力和温度变化(P=7.0 MPa)Fig. 3 Variation of pressure and temperature during hydrates fomation in SDS+CNP+SSF system and SDS system(P=7.0 MPa)
图3 是实验初始压力为7.0 MPa条件下纳米铜与不锈钢纤维复配溶液体系中水合储气过程压力P和温度T的变化曲线。整个实验过程的初始温度为274.2 K,水合物容易在低温高压的环境下生成,温度越低,气体消耗量越多,274.2 K是高于水结冰条件1 K的温度,可以维持反应溶液中不出现冰水混合物。整个实验过程持续5 h时,对比分析主要对实验前30.0 min内水合物生成过程进行论述。从图中可以看到,天然气水合物在不锈钢纤维与纳米铜复合悬浮溶液体系充气压力达到7.0 MPa后降压的过程中就已经开始形成,温度曲线此时从275.2 K始上升,压力开始下降,釜内的温度升高是由于水合物生成为放热反应。与复配溶液体系相比,SDS溶液体系的温度和压力在气体溶解过程中没有明显变化(阶段1)。在复配溶液体系中反应过程仅出现两个明显的阶段:快速水合阶段(阶段2)和缓慢水合阶段(阶段3),阶段2持续相对较短,在反应进行至8 min 42 s时,复配溶液体系中的压力已达到总压降的约90%,其原因可能是纳米铜金属颗粒在溶液中分布均匀可以提供较大的气液接触面积,气体进入液体内部的速度较快,同时不锈钢纤维的导热作用能够促进水合反应热向釜外传递。然而,相比于生成放热过程,反应釜内温度回降至初始温度274.2 K的过程需耗时较长。分析原因可能是在复配溶液体系中,气液接触面积较大,发生剧烈水合反应放出热量,单位时间放出的热量远远大于单位时间复配溶液体系向水浴导出的热量,因此,大量的水合热滞留在反应釜内,导致降温耗时较长。整个水合过程的压降为0.91 MPa,相比于SDS溶液体系的0.74 MPa要高出很多,复配溶液体系对水合过程的影响也更显著。纳米铜与不锈钢纤维复配溶液体系可以很好地促进水合反应的进行,在进行较低实验初始压力(4.0~6.0 MPa)的储气实验时也发现了温度和压力与之相似的变化。
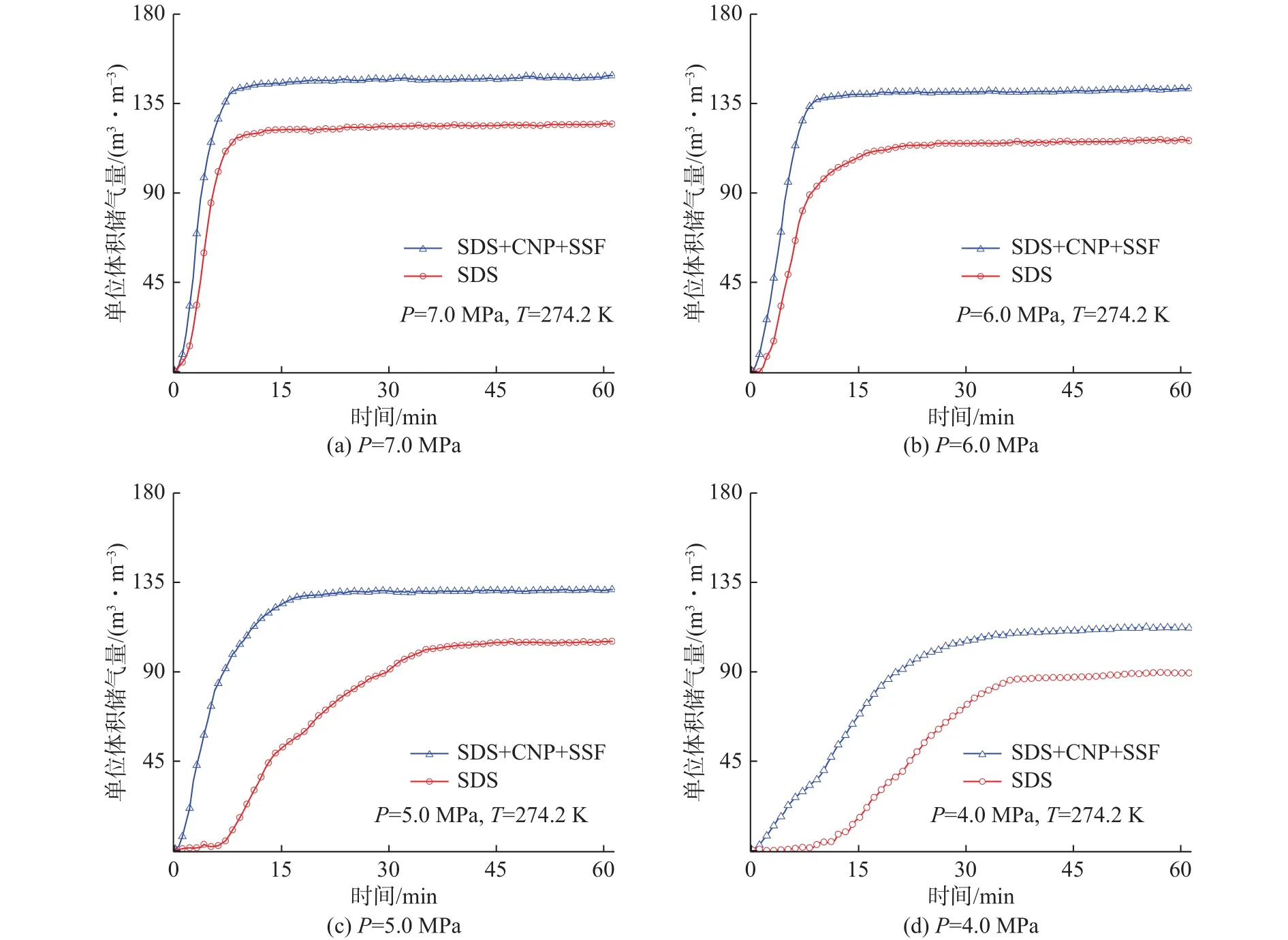
图4 两种体系在不同压力条件下天然气水合物储气量Fig.4 Storage capacities of natural gas hydrates in SDS+CNP+SSF system and SDS system under different pressures
在初始压力为7.0 MPa条件下纳米铜与不锈钢纤维复配溶液体系的单位体积储气量随时间的变化如图4(a)所示,在该过程开始时,水合物快速形成,天然气储气量急剧上升,在10.0 min后,储气量数值基本趋于稳定,表明水合物形成过程在快速水合阶段后较早地进入缓慢的水合阶段。与SDS溶液体系的气体吸收过程相比,该复配溶液体系在30.0 min内的储气量明显大很多,可以达到150 m3/m3。
在随后进行的较低初始压力下的储气实验中可以看到水合过程与在7.0 MPa时的相似。水合物的储气量和储气速率随着压力的变化有着很大的不同。在实验初始压力为5.0 MPa和6.0 MPa时,该体系的储气量依然很高,在30.0 min内的储气量也可以达到130 m3/m3或以上,但反应进行较缓慢,完成时间延迟。在初始压力为4.0 MPa时,复配溶液体系中水合物的储气过程相比于高初始压力下变得非常缓慢,在30 min时的单位体积储气量仅达到112.6 m3/m3,相比初始压力为7.0 MPa时的储气量降低36.6 m3/m3,但与同初始压力下SDS溶液体系的储气量相比高出23.4 m3/m3左右。这表明较高初始压力条件下的复配溶液体系中水合反应受到的影响较大,并且在相同实验初始压力下对比SDS溶液体系,复配溶液体系的水合储气能力大幅提升。
不同实验初始压力条件下两种体系的储气速率如图5所示。在初始压力为7.0 MPa时,复配溶液体系的水合反应速率的最大值为39.47 m3/(m3·min),并且在约14 min时停止水合反应。在初始压力分别为5.0 MPa和6.0 MPa时,该体系的储气速率分别为 21.57 m3/(m3·min)和 26.84 m3/(m3·min)。在初始压力为4.0 MPa时,该复合体系中水合物的储气过程相比于高压力下变得非常缓慢,最大储气速率仅为6.96 m3/(m3·min),比初始压力为7.0 MPa实验的最大储气速率低32.51 m3/(m3·min)。针对较高初始反应压力下复配溶液体系水合物生成分析表明,水合过程早期反应速度过快,导致短时间内产生大量水合热,其不利于水合过程的正向进行。然而,从实验结果分析发现,相比于短时间内热量积聚带来的负面影响,高初始压力条件对正向促进水合作用更强,使得储气速率得到提升。
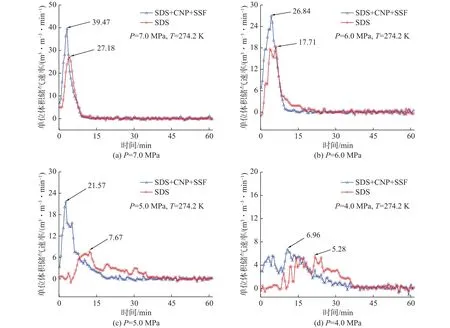
图5 两种体系在不同压力条件下的气体水合物储气速率Fig.5 Gas uptake capacities of gas hydrates in SDS+CNP+SSF system and SDS system under different pressures
比较初始压力在4.0~7.0 MPa条件下天然气水合物在各体系中的最大储气速率值,可以明显地看出,复合体系在各压力条件下的最大储气速率要比其他体系大很多。结果表明,实验初始压力越大,最大储气速率就越大,在5.0~7.0 MPa范围内,随着压力的升高,最大储气速率的提升量逐渐减小;在相同实验初始压力条件下,不同体系中最大储气速率的提升量不同。分析其原因是低压力下水合推动力小,水合反应过于温和,即使添加导热速率高、提供大比表面积的金属颗粒或纤维,对提升最大储气速率的程度也不明显,但对整个水合过程的平均导热速率具有一定的影响;在高压下,水合反应剧烈,复合体系的高导热速率就会凸显。
图6是纳米铜与不锈钢纤维复配溶液体系在不同实验初始压力条件下的最终储气量对比曲线,从图中可以看出,初始压力为4.0 MPa时天然气储气过程比较艰难,当气体存储能力达到其最大值时的90%所用时间t90比较长,约为23.7 min,明显高于其他初始压力下的t90(表1),储气量的最大值也明显低于其他压力下的最大值,比初始压力为7.0 MPa时减小36.6 m3/m3。当初始压力升高至7.0 MPa,t90降低到6.7 min,这主要是由于随着压力的增大,水合推动力也逐渐增大。实验初始压力为4.0 MPa时,表1中复配溶液体系的t90约为SDS溶液体系的t90的63.5%,这表明在低初始压力条件下,复配溶液体系中天然气存储在所需时间上更具优势。
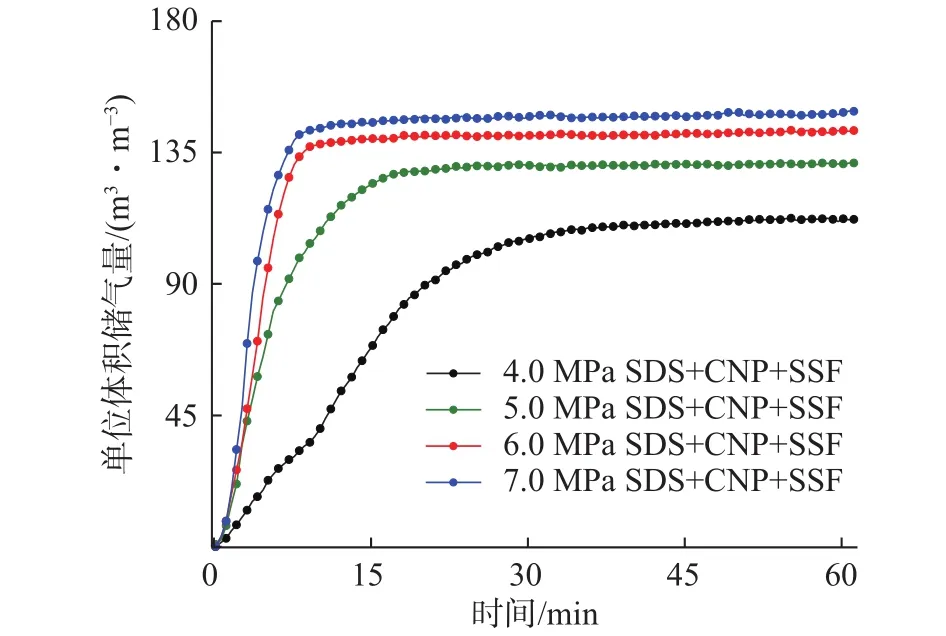
图6 不同压力条件下复配溶液体系的天然气水合物储气量Fig. 6 Storage capacities of natural gas hydrates in the hybrid system under different pressures
2.2 水合物生成强化机理分析
复合悬浮溶液体系中纳米铜可以提供较大的比表面积,粗糙的金属表面为天然气水合物提供结晶点,促进成核[20];纳米铜的高导热性也可以增强溶液的导热速率[21],加快移除表面活性剂溶液水合过程的水合热,相比于表面活性剂溶液的储气特性有了很大改善,但相邻纳米铜颗粒之间水合热的传递要通过水合物层,无法形成一个连续的金属导热体系。不锈钢纤维既可以提供粗糙的表面,为水合物成核提供结晶点,较大的比表面积又可以增加气液接触面积,金属的高导热特性与其具备的连续性可以帮助快速移除体系中的水合产热。综合两者的优点,天然气水合物在复配溶液体系中的形成机理如图7所示。
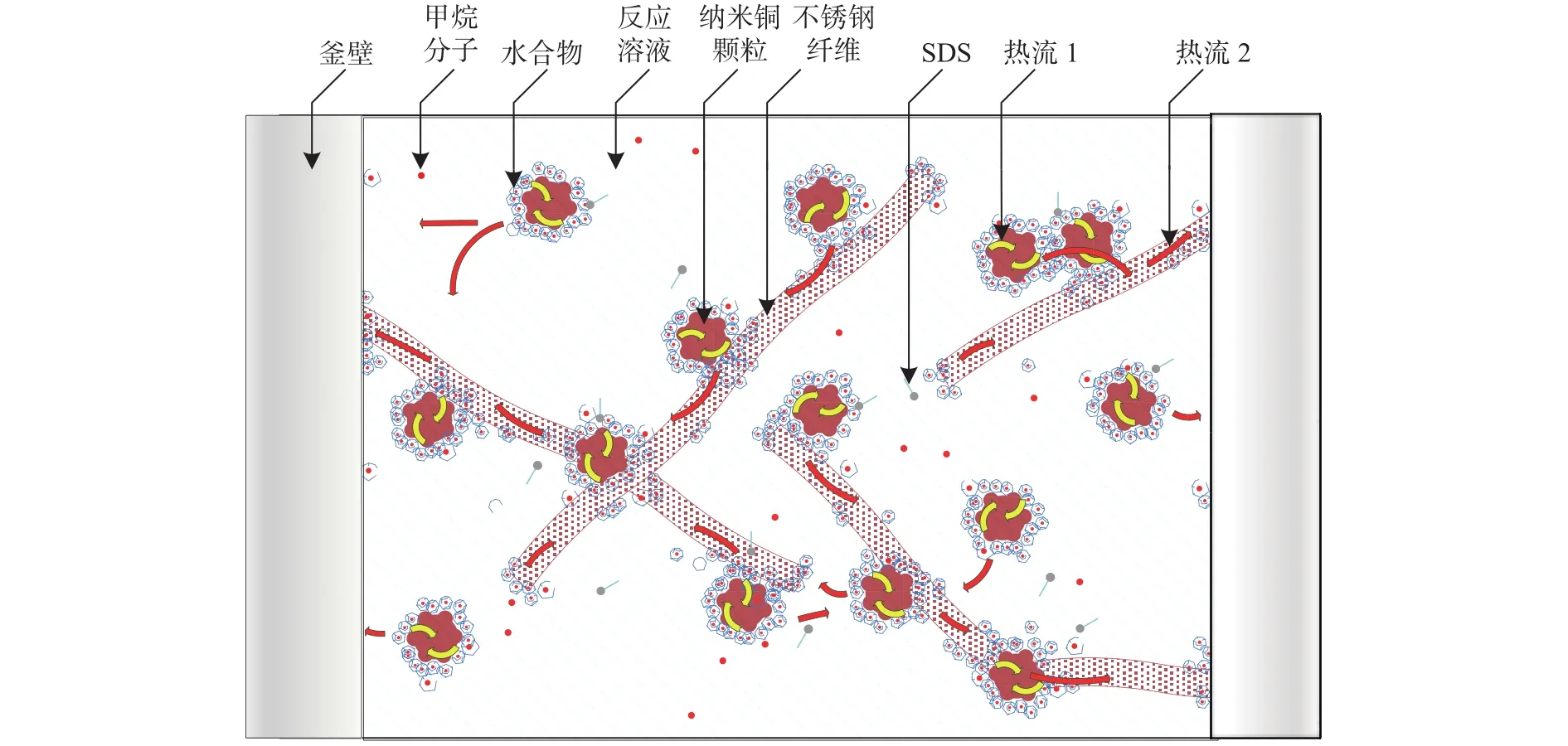
图7 SDS+CNP+SSF体系中水合物生成与热量传递示意图Fig.7 Schematic diagram of hydrate formation and heat transfer in the SDS+CNP+SSF system
分析纳米铜与不锈钢纤维在水合过程中的强化导热性能,假设水合物是从釜壁向釜内、从不锈钢纤维和纳米铜表面向四周生长,水合热从水合物反应区域向低温反应釜壁传递。水合物在纳米铜颗粒表面生成时,水合反应热可能进入颗粒内部积聚,其速度大于从反应体系中向釜外传递热量的速度,因而反应过程前期水合体系温度升高。热量可以通过溶液或附近的纳米铜粒子快速传递到较低温度的区域,相邻纳米铜颗粒之间的水合热借助溶液与悬浮金属的传导,最终通过选择小热阻的路径传递到反应釜壁。恒温水浴与反应釜壁换热至釜内温度开始下降,一段时间后釜内温度逐渐稳定。当水合物积聚在靠近釜壁的纳米铜颗粒或不锈钢纤维的表面上时,水合热量可以通过反应釜壁快速地传递到低温水浴恒温槽中。在反应釜内部,当纳米铜颗粒与不锈钢纤维距离较近时,其表面形成水合物放出的水合热可从其表面通过金属纤维快速向外传递。另外,不锈钢纤维可以将其自身表面形成水合物时放出的水合热通过自身纤维“通道”传递到低温区域。复合体系内多通道的传热特性也大大提高了整个复合体系中水合热的传递速率,缩短了水合热在体系内的滞留时间。因此,复配溶液体系不仅可以提供更大的气液接触面积,从传质上强化了水合过程,而且形成的多通道传热方式,从传热上也加速了水合速率。
3 结 论
将纳米铜颗粒和不锈钢纤维添加到表面活性剂溶液中,制备含有金属添加剂的复配溶液,在此溶液体系中进行了天然气水合物的生成实验。该体系中均匀的纳米铜颗粒的粗糙表面为水合物的生成提供了数多晶体成核点,同时溶液中纵横交错的不锈钢纤维形成加速移除体系中水合热的“高速公路”。结果表明,复配溶液体系中天然气水合物的储气效果良好,水合物形成所需的时间也显著缩短,在实验初始压力为7.0 MPa时该复配溶液体系最大储气速率和储气量分别可达39.47 m3/(m3·min)和149.2 m3/m3。此外,在实验初始压力为4.0~7.0 MPa范围内,复配溶液体系比单一表面活性剂溶液体系的最大储气速率提高了22.2%~180.0%,最大储气量提高了19.9%~26.1%。本研究结果为静态体系中天然气水合物快速生成提供了参考。

