细胞膜上信号转导蛋白的单分子成像与分析
梁钰昕, 赵 容, 梁馨月, 方晓红
(中国科学院化学研究所, 分子纳米结构与纳米技术重点实验室,北京分子科学国家研究中心, 北京 100190)
细胞作为生命的基本结构和功能单位, 需要时刻响应外界环境变化, 并正确做出存亡、 增殖、 分化和迁移等一系列决策[1]. 细胞决策依赖于复杂的信号转导机制[2]. 细胞信号转导起始于细胞膜上的信号转导蛋白, 这些膜蛋白在接收到细胞外的刺激信号后, 会发生构象、 聚集状态及动力学行为等的改变, 然后通过细胞内下游效应蛋白将信号传递并放大, 进而调节细胞核内基因的表达. 膜信号转导蛋白的基因突变和异常表达等变化会导致细胞信号转导异常, 这与许多疾病的发生、 发展密切相关[3,4], 研究这些膜蛋白的结构和功能不仅有助于揭示细胞信号转导的机制, 还能促进这些疾病相关药物的开发.
近年来, 荧光成像尤其是单分子荧光成像技术对生命化学的发展起到了重要的推动作用, 实现了无损、 原位、 高时空分辨地在活细胞中研究各种生理病理过程. 系综方法只能检测大量分子的平均行为, 而单分子荧光成像则可在生物体系中原位、 实时观测单个目标分子, 从而揭示掩盖在群体行为下生物分子的非均一性及动态变化. 对于细胞膜上的信号转导蛋白, 采用单分子成像方法实现了对单个膜蛋白激活、 内吞及胞内转运等过程的实时定量研究, 为深入研究其功能和调控机制提供了新工具[5,6].
本文结合课题组的研究工作, 介绍了活细胞单分子荧光成像分析方法, 并综述了近年来膜蛋白单分子成像在研究信号转导分子机制以及药物作用中的新进展.
1 单分子荧光成像方法
1.1 单分子荧光显微镜
19世纪后出现的荧光显微镜凭借其灵敏度高、 对活细胞干扰小等优势, 成为生命化学研究领域中的重要工具. 2000年, Yanagida等[7]和Schindler等[8]首次在活细胞的细胞膜上观察到单个表皮生长因子受体(EGFR)的二聚化和单个脂类分子的运动. 随后, 活细胞单分子荧光成像技术不断发展, 并广泛应用于多种生化过程的研究[9].
单个分子的荧光信号弱, 因此, 提升信噪比(S/N)是单分子成像技术的关键. 为了提高信噪比, 一方面需要尽可能多收集信号, 另一方面则要降低背景及噪音. 细胞的自发荧光是背景的主要来源之一, 减小激发/检测体积可以有效降低背景信号. 全内反射荧光显微镜(TIRFM)可以将激光的照明体积限制在细胞膜区, 而不会激发细胞内部的分子, 因此可以获得高信噪比的荧光图像, 从而使TIRFM成为细胞膜蛋白单分子成像中最常使用的显微镜. 全内反射荧光成像利用了全内反射原理, 一束入射光线经过光密介质照射至光疏介质, 当入射角大于临界角时, 入射光线在界面处会发生全内反射现象, 但此时仍有一部分光以隐逝波的形式穿过界面进入光疏介质, 隐逝波的强度会随着穿透深度以指数形式衰减. 相较于一般的宽场荧光显微镜, 全内反射荧光显微镜只激发靠近界面100~200 nm处的荧光分子[10], 信噪比显著提高(见图1). 细胞成像中常使用的是物镜式全内反射荧光显微镜, 这种光路结构可以通过物镜直接形成隐逝场, 致使只有处于界面即细胞膜附近的荧光分子才被激发, 其被广泛应用于细胞膜单分子研究中[11,12].
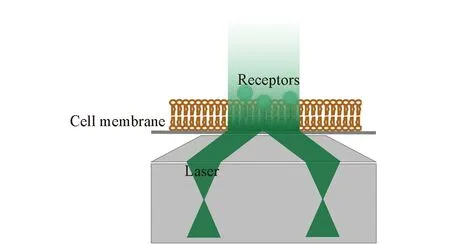
Fig.1 Principles of objective-type TIRFM
近年来, 研究人员又研发了基于TIRFM的新成像模式. 如果希望观察细胞膜内稍深处的分子, 可以调整激发光的入射角度, 使之稍小于临界角, 这种成像模式被称为半-全内反射荧光显微术(quasi-TIRFM)[13,14]. 虽然这种模式的照明体积与TIRFM相比有所提升, 但由于激发光倾斜着穿过细胞, 故细胞深处的荧光分子不会被激发, 仍能在保持较高信噪比的条件下实现单分子成像. 本课题组[15]发展了一种结合TIRFM和quasi-TIRFM的成像方法. 通过在2种模式之间切换激发光的照明深度, 可以观察到细胞内囊泡转运至细胞膜上的过程. 最近, Fu等[16]报道了一种多角度TIRFM. 该方法利用隐逝波深度与激发光角度相关的原理, 逐步改变隐逝波的穿透深度, 通过一系列成像-光漂白过程, 可以实现界面附近250 nm的三维纵向超分辨成像, 纵向分辨率达到20 nm.
TIRFM成像受到衍射极限的限制, 无法区分高密度成像时距离小于200 nm的点. 近年来出现的光活化定位显微术(PALM)、 随机光学重构显微术(STORM)及受激辐射损耗显微术(STED)等成像技术, 实现了突破衍射极限的超分辨荧光成像[17]. 目前, 已有越来越多的报道将超分辨荧光显微镜用于单分子成像分析[18~20]. 此外, 原子力显微镜(AFM)与单分子荧光成像联用可以同时获得光学和力学信息, 在活细胞单分子研究中也将发挥重要应用[21].
1.2 荧光探针与标记方法
荧光蛋白是生物成像中应用最广泛的一类荧光标记物. 荧光蛋白由基因编码, 可以通过基因工程方便地将荧光蛋白与目标蛋白融合表达, 实现对目标蛋白特异性的标记. 从最早发现的绿色荧光蛋白, 到目前已发展出的一系列具有不同发射波长的荧光蛋白[22], 均为实现多色荧光成像提供了重要工具[23]. 对细胞膜蛋白进行单分子研究要求荧光蛋白的亮度高且不倾向于形成寡聚体, 要实现对膜蛋白的长时间动态追踪, 还要求荧光蛋白具有良好的光稳定性. 目前, 已有商品化的mNeonGreen[24], mRuby3[25]和mScarlet[26]等高亮度单体荧光蛋白可供选择. 传统的荧光蛋白标记方法是在细胞中导入外源荧光蛋白-目标蛋白融合基因, 但是这类外源导入的方法存在难以反映细胞内蛋白真实表达水平的问题. 利用基因编辑方法可以直接将荧光蛋白基因连接在内源目标蛋白基因上, 从而分析细胞内源目标蛋白. 最近出现的CRISPR/Cas9系统利用碱基互补配对原则设计sgRNA靶向编辑目标基因[27,28], 大大简化了基因编辑方法, 已经被越来越多地用于单分子荧光成像标记[29].
有机荧光染料是另一类生物成像领域常用的荧光探针[30,31]. 相较于荧光蛋白, 有机小分子染料具有分子量小、 亮度高及光稳定性好等优点. 商业化的ATTO, Alexa Flour和CyDyes系列染料均已被应用于单分子成像[32]. 虽然有机小分子染料的光物理性质优异, 但存在难以透过细胞膜和非特异性吸附等问题[33]. 近期发展的硅-罗丹明和JF系列染料拥有良好的细胞膜穿透性, 且亮度高、 光稳定性强, 被越来越多地应用在单分子成像和追踪中[34,35]. 不同于可基因编码的荧光蛋白, 有机小分子染料需要通过一些特异性反应才能标记在目标蛋白质上, 常用的有Halo, SNAP和Clip自标记标签蛋白[36,37]. 先将这类基因编码的蛋白标签融合到目标蛋白上, 再加入可以与标签蛋白特异性反应的带有染料的标签配体即可完成标记. 然而, 这类蛋白标签的大小与荧光蛋白相当, 可能会对目标蛋白产生干扰. 另一个选择是使用非天然氨基酸标记[38,39]. 将标签的长度缩小至1个氨基酸, 通过对目标蛋白的某一个氨基酸位点进行点突变, 可在目标蛋白上插入带有叠氮基或炔基等生物正交反应官能团的非天然氨基酸, 结合点击化学反应, 将染料特异性标记在目标蛋白的特定位点[40,41]. 本课题组[40]首次报道在哺乳动物细胞中将非天然氨基酸用于单分子成像标记, 观察到细胞膜上受体更接近生理状态的单分子行为.
纳米技术的发展使各种荧光纳米颗粒逐渐应用到生物成像中, 如量子点(QDs)[42,43]、 碳点(CDs)[44]、 聚集诱导发光纳米颗粒(AIE NPs)[45]、 荧光纳米钻石(FNDs)[46]、 上转换纳米颗粒(UCNPs)[47]和半导体聚合物点(PDs)[48]等. 荧光纳米颗粒用于单分子成像的优势在于, 其高亮度可以使成像系统在很短时间内收集到足够多的光子, 从而提高单分子成像的空间和时间分辨率. 目前已有报道可以在数十毫秒的时间分辨率下达到小于5 nm的空间分辨率[49]. 荧光纳米颗粒的另一个优势是光稳定性好, 本课题组[48]研制了具有强抗光漂白性能的半导体聚合物点, 作为STED超分辨成像的新型纳米探针, 实现了连续2 h的活细胞成像. 虽然纳米颗粒的亮度和光稳定性优于有机小分子染料, 但粒径较大. 进一步减小荧光纳米颗粒的尺寸, 并通过优化表面修饰方法提高其活细胞标记能力, 荧光纳米颗粒有望更广泛应用于活细胞单分子成像.
1.3 数据分析
受到衍射极限的限制, 一个理想物点经过光学系统成像得到的是一个艾里斑. 通常使用的光学显微镜分辨率约为200 nm, 远大于单个生物分子. 因此, 需要通过一些算法识别图像中微弱的单分子荧光信号并对其进行精确定位. 单分子检测和定位算法可以将图像中的信号分子从背景中区分出来, 并通过对其荧光分布进行拟合来确定该分子的中心位置. 而单分子追踪算法可以将连续图像中相邻时刻相关性最高的点连结起来, 得到目标分子位置随时间的变化曲线, 即单分子轨迹. 目前, 已经发展了多种构建单分子轨迹的算法[50,51], 相较于简单关联最临近点的算法, 基于全局优化的追踪算法通常有更好的表现[52].
经上述算法处理后, 可得到目标分子在一段时间内的位置及荧光强度信息. 但是, 如何从大量单分子数据中提取目标分子的行为特征并与其生物学功能相联系, 还需要进一步发展分析方法. 近年来, 关于蛋白质化学计量比以及分子间相互作用动力学的单分子数据分析方法得到了快速发展.
膜蛋白的激活与其聚集计量比息息相关, 定量表征膜蛋白的聚集状态对了解信号转导起始阶段具有重要意义. 研究膜蛋白聚集状态最常用的单分子方法是荧光强度分布分析和光漂白步数分析. 荧光强度分布分析首先需要统计大量单分子点的荧光强度分布, 理论上蛋白复合物的聚集程度越高, 其对应的单分子点的荧光强度越大. 参照单个荧光分子的强度分布, 对聚集体的荧光强度分布进行多峰高斯函数拟合, 可以获得不同聚集程度的聚集体的比例[53]. 荧光漂白步数分析则是需要分析一段时间内单分子点荧光强度随时间的变化曲线[54]. 一个蛋白复合物内多个荧光分子被同时漂白的几率较小, 而是在不同的时间被分步漂白, 呈现出荧光强度台阶式下降, 理论上台阶数目就代表着蛋白复合物的聚集程度.
由于单分子荧光信号较弱, 荧光团自身的闪烁效应以及细胞成像体系的背景干扰均给单分子漂白曲线的台阶识别带来很大困难. 因此, 荧光漂白步数分析法需要准确、 客观且高效的自动数据处理算法[55]. 目前, 基于隐马尔可夫模型(HMM)的算法已被用于荧光漂白步数分析中, 但是单分子漂白曲线这类较短的时间序列很难训练HMM使其收敛到全局最优点. 本课题组[56]开发了一种结合最大似然估计和HMM的算法以解决这个问题. 同时, 上述方法均需要用户预设参数, 这些参数会极大程度地影响分析结果的准确性, 而且这类参数往往很难合理地预先设置. 本课题组[55]近期发展了一种无需预设参数、 基于深度学习框架的单分子光漂白步数分析算法(CLDNN), 与以往的算法相比, CLDNN不仅具有更高的准确度, 而且效率提高了2个数量级(见图2).
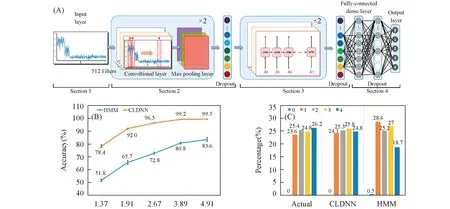
Fig.2 Architecture of CLDNN(A), the analysis accuracies of CLDNN and HMM to the synthesized data sets with different aSNRs(B) and the true distribution and outputted distributions of bleaching steps analyzed by different algorithms(C)[55] Copyright 2019, American Chemical Society.
通过对细胞上膜蛋白的单分子运动轨迹进行分析, 可以定量表征其动力学行为. 由于膜蛋白的扩散受其构象、 相互作用分子、 所处微环境以及跨膜区尺寸的影响, 在细胞内外刺激因素的作用下, 膜蛋白会响应刺激发生各种扩散行为的改变, 同时调节下游信号. 因此, 表征膜蛋白的扩散动力学行为对于了解其功能和调控机制均具有重要作用. 传统的方法是分析均方位移(MSD)[57], 由MSD-Δt曲线可以得到目标分子的扩散类型及扩散系数, 但是MSD分析丢失了单个分子扩散状态随时间变化的信息. 近年来, 基于HMM的方法被用于分析扩散位移随时间变化的曲线, 实现了从单个分子运动轨迹数据中提取其隐藏的多个扩散状态, 刻画出最可能的状态变化路径, 从而得到分子在某一扩散状态的停留时间和在不同扩散状态间的转化概率等信息[58,59]. 针对细胞膜蛋白, 本课题组[60]发展了基于瑞利混合分布的HMM方法, 克服了之前方法需要预先设定扩散状态数或者容易过度拟合的缺点, 可以得到膜蛋白在不同聚集状态下的扩散系数、 所占比例、 转化速率和蛋白间相互作用的结合/解离速率常数等动力学信息(见图3).

Fig.3 Principle of the RmHMM method(A, B) and dwell times on the dimeric state of the EGFR before(C) and after(D) the stimulation revealed by RmHMM[60] Copyright 2019, American Chemical Society.
2 单分子成像研究膜蛋白信号转导机制
在单分子水平定量研究膜蛋白响应外界刺激后其定位、 化学计量比和动力学行为的变化, 不仅有助于理解相关信号转导的分子机制, 还可以帮助阐释和预测不同生理病理条件下的膜信号转导过程, 对于相关药物的开发和优化也具有重要意义. 下面将介绍单分子成像在研究转化生长因子-β(TGF-β)受体、 表皮生长因子受体(EGFR)、 肿瘤坏死因子受体(TNFR)和G蛋白偶联受体(GPCR)几种重要的细胞膜信号受体上的应用.
2.1 转化生长因子-β受体研究
TGF-β/Smad信号通路控制着包括增殖、 分化、 迁移和凋亡等一系列重要的细胞生理过程[61]. 该信号通路起始于配体TGF-β与细胞膜上TGF-βⅡ型受体(TβRⅡ)的结合, 随后招募TGF-βⅠ型受体(TβRⅠ)形成异源多聚体复合物, 通过磷酸化下游Smad蛋白激活或抑制细胞核内特定基因的转录, TGF-βⅢ型受体(TβRⅢ)可以协助将配体递送给TβRⅡ, 从而增强细胞对配体的响应[62].
通过传统的生化方法得到的信号转导通路模型认为TβRⅠ, TβRⅡ和TβRⅢ在静息状态下均以二聚体或寡聚体形式存在, 在受到配体刺激后TβRⅠ二聚体与TβRⅡ二聚体结合形成激活的异源受体复合物. 本课题组[12]利用单分子荧光成像技术, 通过荧光强度及荧光漂白步数分析发现, 当受体低表达时, TβRⅠ, TβRⅡ和TβRⅢ 3种受体在静息状态均可以单体形式存在; 受TGF-β1刺激后, TβRⅡ发生二聚化(见图4), TβRⅠ在TβRⅡ存在下二聚体比例也会显著升高. 基于此提出了TGF-β受体激活的新模式, 即此类丝/苏氨酸激酶受体也可通过配体诱导下单体二聚化而激活. 而非激酶受体TβRⅢ在配体刺激后其仍主要为单体, 说明TβRⅢ在单体状态时即可增强配体与TβRⅡ的结合[63].
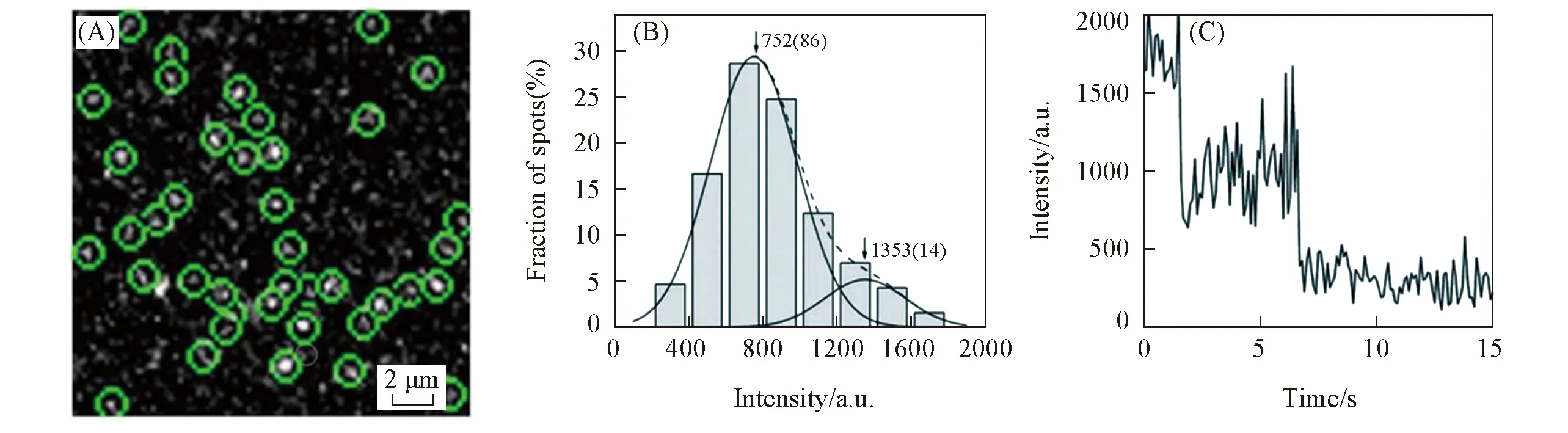
Fig.4 A typical single-molecule image of TβRⅡ-GFP(A), distribution of the fluorescence intensity of diffraction-limited TβRⅡ-GFP spots, the solid curves show the fitting of Gaussian function and the two peaks represented TβRⅡ-GFP monomers and dimers, respectively(B), time courses of GFP emission after background correction show two-step bleaching(C)[12]Copyright 2009, the National Academy of Sciences of the United States of America.
从受体的动力学行为上分析, 也可得到一致的结论. 通过追踪TβRⅠ-GFP的单分子轨迹, 发现在共表达TβRⅡ时, TGF-β1刺激会显著降低TβRⅠ的扩散系数. 由于受体在膜上的扩散系数与其跨膜区半径成反比, 这进一步验证了信号激活过程中TβRⅠ会与TβRⅡ结合形成异源寡聚体. 而在破坏脂筏的情况下, 配体刺激不会改变TβRⅠ的扩散行为, 这说明脂筏区域为TβRⅠ与TβRⅡ的结合提供了环境[64]. 此外, 通过定量表征TGF-β受体在单体和二聚体之间相互转换的动力学过程, 实现了对这一相互转化过程更准确的分析, 本课题组使用非天然氨基酸的方法对TβRⅡ进行标记, 得到了比之前荧光蛋白标记扰动更小、 信噪比更高的单分子图像. 通过分析受体分子二聚的共定位时间, 计算出TβRⅡ二聚体的寿命为253 ms, 解离速率常数为3.95 s-1, 而且配体刺激并不会显著改变这一过程的动力学参数. 以上实验[40]说明配体并不能稳定TβRⅡ二聚体, 受配体刺激后TβRⅡ二聚化程度增加是由受体密度增大所致.
对于受体在形成信号复合物之后, 其下游信号的传递过程. 之前的研究[65,66]对于受体激活Smad蛋白发生在细胞膜上还是细胞内一直存在争议. 本课题组[67]研究发现, 当有配体刺激时, 激活的受体复合物会在细胞膜上结合Smad3并将其磷酸化. 虽然细胞在有无配体刺激时Smad3均存在上膜的现象, 但是有配体刺激时Smad3和TβRⅠ的解离速率常数更小, 其结合更稳定(见图5). 通过单分子成像和追踪的方法, 在提高时间及空间分辨率的基础上可进一步明确TGF-β受体激活过程.

Fig.5 A typical single-molecule fluorescence images of EGFP-Smad3 molecules docking on the cell membrane in the presence of TGF-β1(A), diffusion coefficient of membrane-docked EGFP-Smad3 molecules with the marked D value in HeLa cells in the presence of TGF-β1(B), cumulative histograms(solid) indicated the docking time of EGFP-Smad3 molecules in stimulated cells, the histograms were fitted with a single exponential function, the dotted lines are the fitting curves with the time constants τ(0.60 s)(C)[67] Copyright 2016, Springer Nature.
膜蛋白的胞内转运是细胞信号转导重要的调控机制[68], TGF-β信号通路也与受体在细胞内的转运过程密切相关. 内吞的受体会在细胞内传递信号, 进一步被修饰、 降解或者重新回到细胞膜上. TGF-β受体有2种内吞途径, 其中网格蛋白(Clathrin)介导的内吞途径与TGF-β信号的上调有关, 而胞膜窖(Caveolae)介导的内吞途径与TGF-β信号的下调有关. 通过对TβRⅠ内吞过程的多色成像, 发现了一种新的TGF-β受体转运途径. 研究[69]表明, Clathrin介导的内吞和Caveolae介导的内吞会在细胞内发生融合(见图6), 形成Clathrin和窖蛋白(Caveolin-1)双阳性囊泡, 在Rab5的调控下, 融合囊泡会进一步融合至早期内涵体, 形成Caveolin-1阳性早期内涵体, TβRⅠ可能在此时被再次分选, 从而决定其信号传递、 降解和回收.

Fig.6 Triple-color live-cell confocal imaging of the cell co-expressing caveolin-1-EGFP, clathrin-DsRed and Myc-TβRⅠ, the boxed region was magnified(images to the right) to show the movement of a Myc-TβRⅠ, caveolin-1-EGFP and clathrin-DsRed triple-positive vesicle(arrows) from the lateral plasma membrane(white lines) to the cytoplasm[69]Copyright 2015, Springer Natare.
本课题组[15]还研究了TGF-β受体转移到细胞膜上的过程. 在细胞质内, 利用quasi-TIRFM观察到新合成的TβRⅡ由后高尔基体囊泡运输到细胞膜上的过程. 相较于静息状态的细胞, 受配体刺激后细胞膜附近包含TβRⅡ的后高尔基体囊泡数量增多, 这类囊泡可能作为新生成TβRⅡ的储存装置, 可以响应配体刺激将受体转运至细胞膜上, 补偿因内吞而减少的受体. 结合荧光漂白后恢复技术和单分子成像, 发现新转移到细胞膜上的TβRⅡ主要呈单体状态[70]. 先用较强的激光将成像范围内的受体漂白, 几分钟后细胞质内未被漂白的TβRⅡ-EGFP被转运到细胞膜上导致荧光恢复, 再用较弱的激光对新转运至细胞膜上的受体进行单分子追踪[图7(A)]. 结果表明, 受配体刺激后, 单位时间内上膜的TβRⅡ增多, 而且在细胞膜上的停留时间更长. 这导致细胞膜上TβRⅡ的密度增加, 从而促进了TβRⅡ的二聚化及信号激活[图7(B)和(C)].
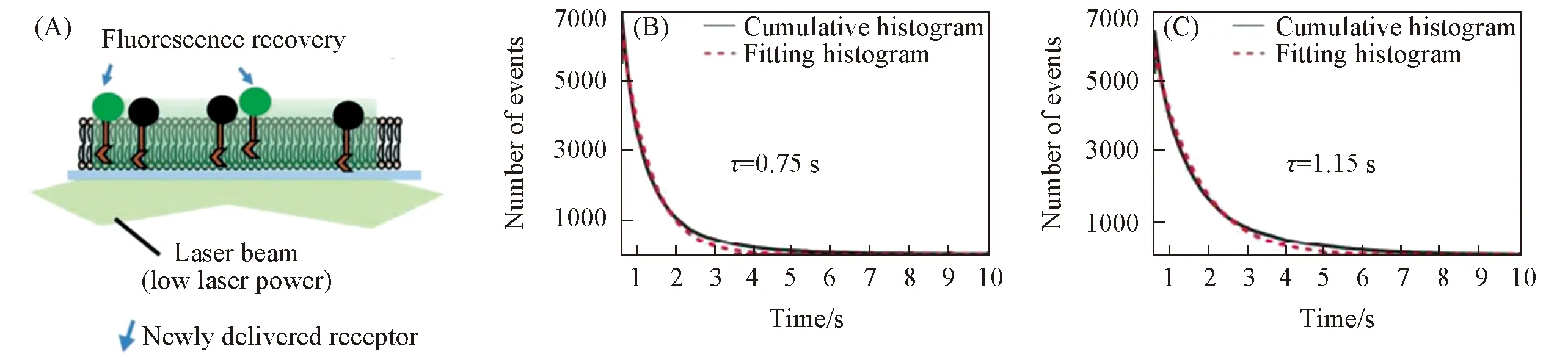
Fig.7 Principle of FRAP-SMI(A), cumulative histograms of the dwell times of newlydelivered TβRⅡ-EGFPs in unstimulated(B) and stimulated cells(C)[70] Copyright 2018, American Chemical Society.
2.2 表皮生长因子受体研究
EGFR信号通路调控着细胞发育、 增殖、 凋亡和分化等关键的生理过程. EGFR是单次跨膜蛋白, 包含胞外配体结合域、 跨膜区和胞内激酶结构域[4]. 长期以来人们认为EGFR受配体刺激后会发生二聚化, 胞内的激酶结构域相互靠近发生自磷酸化从而被激活. Chung等[71]通过追踪量子点标记的单个EGFR, 原位研究了其激活过程的细节, 发现EGFR在细胞膜上处于单体-二聚体的动态平衡. 在配体刺激前, EGFR会形成动力学上稳定的预二聚体, 为配体结合及信号传递做好准备. 结合配体后, EGFR会在激活下游信号的同时快速出现一个非常慢的扩散状态, 说明结合了配体的受体二聚体依然是信号传递中所必须的. 最近的研究[72]表明, 配体刺激后EGFR会形成四聚体或聚集程度更高的多聚体, 多聚体的形成更有利于受体的自磷酸化和激活. 本课题组[73]通过单分子荧光成像追踪了EGFR家族的HER2蛋白, 配体HRG会结合HER3蛋白与HER2形成异二聚体. 经HRG刺激后发现, 不同于TGF-β等受体二聚后扩散系数减小, HER2的扩散系数反而有所增大, 用药物抑制激酶活性或扰乱细胞骨架后, 扩散系数增大的现象消失. 这说明该反常的快速扩散与HER2的磷酸化和细胞骨架有关, 可能是HER2或EGFR的磷酸化导致了细胞骨架发生重排, 从而改变了HER2所处的膜微环境, 导致其扩散加快.
2.3 肿瘤坏死因子受体研究
TNFR属于TNF受体超家族, 是细胞膜上的模式感应受体, 在细胞存活和凋亡中均具有重要的信号调节作用, 与多种疾病的发生发展密切相关. 在受到配体TNFα刺激时, TNFR1会发生三聚化而激活, 诱导免疫细胞凋亡. 通过单分子成像研究发现, 在绿脓杆菌分泌的化学信号分子3oc刺激后, 通过嵌入细胞膜脂筏区域, 3oc可以使TNFR1的运动加快, 增加其相互碰撞几率, 引起其三聚体比例增加[74]. 这表明TNFR1在没有配体TNFα的情况下也可以被激活, 这种非经典的激活方式揭示了一种微生物扰乱宿主固有免疫的新机制, 即通过代谢物直接激活宿主的TNFR1信号来抑制宿主的免疫功能.
2.4 G蛋白偶联受体研究
GPCR是人类基因组中最大的跨膜信号蛋白家族, 其异常与许多疾病相关. 近年来, 单分子成像分析极大地推动了GPCR信号转导机制的研究[5,75]. GPCR会感应细胞外环境变化, 并以一种非线性、 动态的方式将信息传递到细胞内部. GPCR被配体激活后, 可结合下游的G蛋白, 导致G蛋白解聚为α和βγ亚基, 从而调控下游信号. Arrestin一直被认为会在GPCR磷酸化后与之结合, 使受体内吞, 进而对配体变得不敏感. 但是, 最近研究[76]发现某些配体可以直接激活Arrestin信号通路, 即存在偏向激活现象.
Calebiro等[53]通过单分子荧光成像研究了生理条件下β1AR,β2AR和GABAB3种典型的GPCR, 发现不同受体的聚集程度不同, 其中β1AR的聚集程度最低, 主要以单体/二聚体形式存在, GABAB的聚集程度最高, 普遍为二聚体/四聚体.β1AR和β2AR在细胞表面以自由扩散的形式运动, GABAB受体则倾向于与细胞微丝骨架结合而呈现有序的排列. 在激动剂刺激下, 受体的聚集状态没有改变, 但是GABAB受体复合物运动能力得到了显著提升. 以上结果表明, GPCR在细胞表面始终处于结合与解离的动态平衡中, 并且受体复合物可以在配体的调控下靶向不同的细胞微区. Sungkaworn等[77]通过单分子追踪也发现GPCR倾向于在细胞膜上的一些热点区域内结合G蛋白, 从而激活下游信号通路.
GPCR的偏向激活是指同一个受体分子接受不同配体刺激时可以与下游不同的效应蛋白结合, 启动不同的信号通路. 平衡型配体可以同时激活G蛋白和β-Arrestin通路, 偏向性配体会更倾向于激活其中一条通路[78]. 关于GPCR的偏向激活研究[79]发现, GPCR家族的β2肾上腺素受体(β2AR)在低表达条件下主要以单体形式存在于细胞膜上, 偏向激动剂卡维地洛激活β2AR时则会诱导细胞膜上的β2AR发生二聚化, 但在完全激动剂Isoproterenol和拮抗剂Propranolol作用下,β2AR仍为单体. 用siRNA敲降β-Arrestin1后, 卡维地洛刺激引起β2AR二聚体增多的比例降低, 敲降β-Arrestin2后, 卡维地洛刺激不再引起β2AR二聚体增多, 说明卡维地洛刺激造成的β2AR二聚化依赖于β-Arrestin, 而且主要依赖于β-Arrestin2. 利用多色单分子荧光成像, 也观察到卡维地洛刺激后有更高比例的β2AR二聚体与β-Arrestin共定位, 从而提出了β2AR通过受体二聚化实现偏向激活的可能机制(见图8).

Fig.8 Aggregation states of β2AR-GFP under different conditions(A—C), the distributions of the fluorescence intensity of individual β2AR-GFP spots after the stimulation with 10 mmol/L carvedilol(A), isoproterenol(B), and propranolol(C), the fractions of one and two-step bleaching events of β2AR-GFP in the resting and drug-stimulated cells(D), before(E) and after(F) ligand stimulation in the presence of the siRNA targeting β-arrestin1(βarr1), or the siRNA targeting β-arrestin2(βarr2)[79] Copyright 2016, Royal Society of Chemistry.
GPCR受体还存在转位激活的现象[78]. 转位激活是指一个受体与相应的配体结合后可促使另一个受体激活, 从而使信号进一步传递, 且期间没有转录和翻译中间产物. 研究人员发现β2AR可以转位激活EGFR, 但这一过程具体的分子机制之前并不清楚. 本课题组[80]首次用单分子荧光成像方法研究了β2AR转位激活EGFR. 当β2AR被异丙肾上腺素激活时, EGFR的二聚化程度上升, 扩散速率下降, 说明这一转位激活过程仍需要EGFR形成二聚体, 并且Src激酶介导了该过程. 进一步的共定位实验显示, 异丙肾上腺素刺激后,β2AR和EGFR的共定位程度没有显著上升, 说明该转位激活过程不依赖于直接的受体相互作用.
3 单分子成像研究药物作用机制
目前已发现的可成药蛋白中约有41%属于GPCR、 离子通道和激酶家族, 以这3个家族蛋白质为靶点的小分子药物更是占小分子药物总数的54%[81]. 由此可见, 膜蛋白是十分重要的药物开发靶点. 对于一个膜蛋白受体靶点通常有多种治疗药物, 而不同药物之间疗效存在差异, 它们与膜受体的作用机制或作用程度可能不同. 传统的生化方法难以衡量药物对细胞膜受体不同下游通路的作用程度, 一般通过检测下游信号分子的浓度来表征受体的激活程度, 但是这种方法需要事先知道详细的信号通路传导机制. 近年来, 利用单分子成像和追踪的方法, 已经可以直接通过检测药物作用后受体的聚集和扩散情况来判断药物对受体的激活或抑制程度[82]. 在单分子水平研究药物与膜受体的作用机制和作用程度, 对改良已有药物和开发副作用小的新药均具有很好的指导意义.
TGF-β信号的反常激活与许多疾病相关, 如在肥厚型心肌细胞中, TβRⅡ在配体刺激后的二聚化程度相较于正常心肌细胞更高[83]. 目前, 大部分TGF-β信号的抑制剂是抗体, 为了提升药物的组织穿透性和稳定性, 需要发展更多的小分子抑制剂. 已发展的小分子抑制剂通常靶向TβRⅠ激酶结构域的ATP结合位点. 小分子天然产物柚皮素也具有潜在的药物活性, 能降低Smad3的表达和磷酸化. 本课题组[84]结合单分子荧光成像和单分子力谱方法研究了柚皮素的抑制机制, 发现柚皮素会降低TGF-β1和TβRⅡ的结合概率, 抑制TβRⅡ的二聚化, 从而抑制下游信号传递.
二甲双胍是临床上常用的降血糖药物, 在心血管疾病、 多囊卵巢综合征、 糖尿病肾病和癌症中也显示出疗效. 研究[85]发现, 二甲双胍同样可通过阻断TGF-β1与受体的结合实现抑制功能. 单分子成像结果表明, TβRⅡ二聚化程度随二甲双胍浓度上升而下降, 这也解释了二甲双胍对一些与TGF-β1信号异常相关的疾病有治疗效果的原因.
大多数β2AR的激动剂属于儿茶酚胺, 会激活下游G蛋白信号, 然而长期的儿茶酚胺刺激导致G蛋白介导的腺苷酸环化酶激活是有心脏毒性的. 除了用拮抗剂抑制β2AR激活下游G蛋白介导的信号通路外, 还发现偏向性配体卡维地洛可以特异性激活β-Arrestin介导的下游信号, 该通路会阻止腺苷酸环化酶激活, 抵消儿茶酚胺的毒性[86]. 利用单分子荧光成像技术, 观察卡维地洛偏向激活β2AR时, 发现受体的二聚化程度会升高, 反之用完全激动剂异丙肾上腺素和反向激动剂普萘洛尔激活时,β2AR主要为单体[图8(A)~(D)][79], 这为开发偏向激活药物提供了新的依据.
4 总结与展望
单分子荧光成像为实时、 动态地研究生命化学过程提供了新技术, 是结合化学、 物理、 生命科学及计算机科学等多学科的交叉研究领域. 不同于传统的系综方法, 聚焦于单分子水平的动态过程为研究膜蛋白的结构和功能提供了崭新视角. 目前, 活细胞单分子荧光成像的应用还面临一些挑战. 首先, 在荧光探针方面, 仍然需要发展亮度更高、 光稳定性更好、 干扰更小的荧光探针, 在标记方法上将更多使用基因编辑的方法, 如CRISPR/Cas9系统, 原位研究内源表达的膜蛋白; 其次, 膜蛋白单分子成像最常用的全内反射荧光显微镜(TIRFM)显微成像分辨率仍然受限于衍射极限, 新发展的许多突破光学衍射极限的超分辨成像方法将更多地应用到单分子成像研究中; 最后, 需要在不干扰膜蛋白功能的条件下实现更高时间和空间分辨的单分子成像, 从而揭示细胞信号转导等重要生化过程的分子机制.

