超声造影及其引导穿刺在前列腺癌新分级分组中的应用
何杰灵 陈少敏 于倩 刘大伟 李文辉 何金花 梁展鹏 杨锐林
[摘要] 目的 探討经直肠超声造影(CETRUS)及其引导穿刺在前列腺癌(PCa)Gleason分级分组中的应用价值。方法 前瞻性选取2016年1月~2020年1月广州市番禺区中心医院收治的疑似PCa患者并行前列腺超声造影及其引导穿刺患者118例,根据病例结果将其分为PCa组(46例)和良性组(72例);根据Gleason分级分组将其分为Gleason≤3+4组(13例)和Gleason≥4+3组(33例)。分析超声造影诊断PCa敏感度、特异性和诊断率;通过时间-强度曲线获取造影参数并进行比较,根据病理结果对良恶性组织的造影参数和PCa的新分级分组进行分析。 结果 46例确诊为PCa患者。超声造影诊断PCa的敏感度、特异度和诊断率分别为74%、83%和80%。PCa分级分组结果为1组5例(11%),2组8例(17%),3组9例(20%),4组12例(26%),5组12例(26%)。PCa组与良性组初始强度(B)、曲线下面积(AUC)比较,差异无统计学意义(P > 0.05);PCa组达峰时间(TIP)、峰值减半时间(IHT)短于良性组,峰值强度(PI)高于良性组,差异均有统计学意义(均P < 0.05)。PCa患者癌区B、PI和AUC高于周围组织,TIP和IHT低于周围组织,差异均有统计学差异(均P < 0.05)。Gleason≥4+3组(3~5组)B、PI和AUC高于Gleason≤3+4组(1~2组),差异均有统计学意义(均P < 0.05);两组TIP、IHT比较,差异无统计学意义(P > 0.05)。结论 超声造影及引导下穿刺有较高的诊断率,能够很好地反映PCa新分级分组的差异性,二者可协同评价PCa的预后,也有助于靶向引导前列腺穿刺确诊。
[关键词] 经直肠超声造影;穿刺活检;前列腺癌;Gleason分级分组
[中图分类号] R445.1 [文献标识码] A [文章编号] 1673-7210(2020)05(a)-0152-05
Application of contrast enhanced transrectal ultrasound and its guided prostate biopsy in new Gleason grading groups of prostate cancer
HE Jieling1 CHEN Shaomin2 YU Qian3 LIU Dawei4 LI Wenhui3 HE Jinhua5 LIANG Zhanpeng1▲ YANG Ruilin6▲
1.Department of Ultrasound, Guangzhou Panyu Central Hospital, Guangdong Province, Guangzhou 511400, China;2.Department of Finance, the Third People′s Hospital of Panyu District, Guangdong Province, Guangzhou 511403, China; 3.Department of Pathology, Guangdong Panyu Central Hospital, Guangdong Province, Guangzhou 511400, China; 4.Department of Pathology, the First Affiliated Hospital, Sun Yat-sen University, Guangdong Province, Guangzhou 510150, China; 5.Department of Laboratory, Guangzhou Panyu Central Hospital, Guangdong Province, Guangzhou 511400, China; 6.Department of Urology, Guangzhou Panyu Central Hospital, Guangdong Province, Guangzhou 511400, China
[Abstract] Objective To investigate the application value of contrast enhanced transrectal ultrasound (CETRUS) and its guided prostate biopsy in the new Gleason grading groups of prostate cancer (PCa). Methods From January 2016 to January 2020, 118 cases with suspected PCa who underwent prostate biopsy in Guangzhou Panyu Central Hospital were selected. The patients were divided into the PCa group (46 cases) and the benign group (72 cases), according to the pathological result. According to Gleason Grading groups, PCa patients were divided into Gleason ≤ 3+4 group (13 cases) and Gleason ≥ 4+3 group (33 cases). The sensitivity, specificity and diagnosis rate of CETRUS in diagnosis of PCa were analyzed. The contrast parameters were obtained and compared by time-intensity curve, and the parameters of benign and malignant tissues and the gleason grading groups of PCa were analyzed according to the pathological results. Results Forty-six cases were diagnosed with PCa. The sensitivity, specificity and diagnostic rate of CETRUS in diagnosis of PCa were 74%, 83% and 80%, respectively. The PCa classification grouping result showed that 5 cases (11%) in Group 1, 8 cases (17%) in Group 2, 9 cases (20%) in Group 3, 12 cases (26%) in Group 4 and 12 cases (26%) in Group 5, respectively. There were no significant differences in base intensity (B) and area under curve (AUC) between the PCa group and the benign group (P > 0.05). Time to peak (TIP) and peak in half time (IHT) of the PCa Group were shorter than those of the benign group, peak intensity (PI) of the PCa Group was higher than that of the benign Group, and the differences were statistically significant (all P < 0.05). B, PI and AUC of cancer tissues in PCa patients were higher than those of surrounding tissues, TIP and IHT of cancer tissues were shorter than those of surrounding tissues, and the differences were statistically significant (all P < 0.05). B, PI and AUC in Gleason ≥ 4+3 group (Group 3-5) were higher than Gleason ≤ 3+4 group (Group 1-2), and the differences were statistically significant (all P < 0.05); there were no significant differences in TIP, IHT between two Groups (P > 0.05). Conclusion CETRUS with its guided prostate biopsy has a high diagnostic rate, and can reflect the difference of new Gleason grading groups of PCa. The combination of both can evaluate the prognosis of PCa and also help to targeted biopsy for PCa.
[Key words] Contrast enhanced transrectal ultrasound; Prostate biopsy; Prostate cancer; Gleason grading groups
前列腺癌(prostate cancer,PCa)的发病率逐年升高,已成为男性泌尿生殖系中最高发的恶性肿瘤[1]。病理诊断是确诊PCa的金标准[2],经直肠前列腺超声引导下的穿刺活检是实现病理诊断PCa的重要步骤,作为一种高效、安全、应用广泛的超声介入操作,在PCa的诊断中具有重要的作用[3]。伴随着前列腺特异性抗原(PSA)筛查带来可疑PCa病例的增加,对超声诊断和穿刺技术的要求也增加。近几年来,超声造影、多参数核磁共振等影像学技术的发展[4-5],国际PCa病理诊断标准的更新,Gleason分级分组(GGG)系统[6]的提出,为加深对PCa的认识提供契机。前列腺超声造影通过造影剂的微泡作用,增强不同微血管密度组织灌注的对比,不仅能动态观察,还能通过软件系统实现定量分析,有助于实现PCa更精准的肿瘤定位和诊断。目前,前列腺超声检查、引导穿刺及其参数与新Gleason分级分组系统的关系研究较少。本研究为前瞻性研究,探讨超声造影检查及其引导穿刺在PCa新分级分组中的应用,为临床诊治提供参考。
1 资料与方法
1.1 一般资料
选取2016年1月~2020年1月广州市番禺区中心医院(以下简称“我院”)泌尿外科住院的疑似PCa患者118例,平均年龄(71.00±7.60)岁,所有患者行超声造影检查及其引导前列腺穿刺活检,术前病情告知并获取患者的知情同意书,本研究经我院医学伦理委员会批准。根据穿刺病理结果将其分为PCa组(46例),和良性组(72例)。PCa组,平均年龄(70.86±8.51)岁;良性组,平均年龄(70.81±7.89)岁。两组年龄比较,差异无统计学意义(P > 0.05),具有可比性。
纳入标准:①总PSA>4 ng/mL;②直肠指检及影像学检查怀疑PCa者。排除标准:①存在严重心、肺功能不全等疾病者;②局部感染、凝血功能障碍或直肠病变者。
1.2 方法
1.2.1 经直肠前列腺超声和超声造影检查 GE LOGIQ E9彩色多普勒超声诊断仪(美国GE公司),扫描探头频率为4.0~8.0 MHz。患者常规肠道及术前抗生素准备,采取左侧卧位,常规消毒铺巾。先行经直肠前列腺超声检查,观察并记录前列腺形态、体积、前列腺各异常回声或结节及血运情况;然后选取2个平面为观察面行超声造影,造影观察的常规切面为前列腺横断最大直径平面,稳定探头,切换到造影模式,优化图像显示。使用2.4 mL造影剂SonoVue(意大利Bracco公司,批号:6A012)由肘浅静脉注射后行造影检查,同步计时并动态观察整体异常增强区域,保存信息。
1.2.2 前列腺穿刺活检方法及病理检查 采用美国BARD枪12点前列腺穿刺法,即取前列腺底、中和尖部的内外侧各6点,对于超声造影异常增强患者,需保证至少有1针穿过可疑区域或增加1~2针。标本用10%甲醛液固定,石蜡包埋后连续切片,常规苏木精-伊红(HE)染色,根据肿瘤的组织学形态进行诊断,按Gleason分级分组将其分为1组(Gleason评分≤6分)、2组(Gleason评分7分,Gleason 3+4)、3组(Gleason评分7分,Gleason 4+3)、4组(Gleason评分8分,包括Gleason 3+5、Gleason 5+3、Gleason 4+4)和5组(Gleason评分9~10分,包括Gleason 4+5,Gleason 5+4以及Gleason 5+5)。其中Gleason≤3+4组包括1、2组,Gleason≥4+3组包括3、4和5组。
1.3 观察指标
观察病理结果及Gleason分级分组情况;超声造影诊断PCa的敏感度、特异度和诊断率;超声造影参数比较,通过自带软件分析出时间-强度曲线(TIC曲线),取前列腺正中或结节最大切面内外腺左右两侧共4点,记录初始强度(B)、峰值强度(PI)、达峰时间(TIP,以TIC曲线开始上升点计时)、峰值减半时间(IHT)和曲线下面积(AUC)。
1.4 統计学方法
采用SPSS 22.0统计学软件进行数据分析,符合正态分布的计量资料用均数±标准差(x±s)表示,两组间比较采用t检验或非参数检验(秩和检验)。以P < 0.05为差异有统计学意义。
2 结果
2.1 病理结果及超声造影的敏感度、特异性和诊断率
穿刺病理结果显示,118例患者中,PCa组46例,良性组72例;超声造影结果显示,异常增强46例,诊断为PCa 34例;无异常增强72例,诊断为PCa 12例;经直肠超声造影诊断PCa的敏感度、特异度和诊断率分别为74%(34/46)、83%(60/72)和80%(94/118)。
2.2 Gleason分级分组结果
46例PCa患者中,1组5例(11%),2组8例(17%),3组9例(20%),4组12例(26%)和5组12例(26%)。
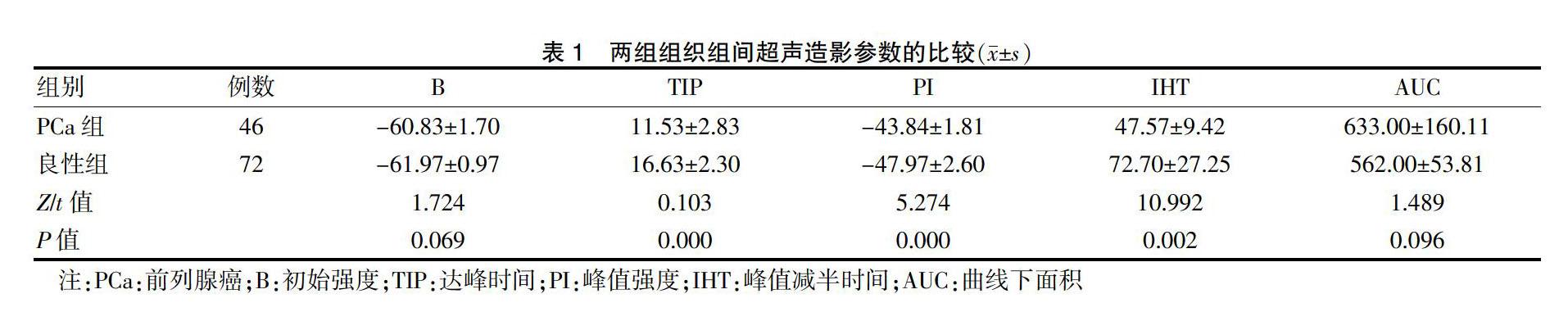
2.3 两组组织超声造影参数比较
两组B和AUC比较,差异无统计学意义(P > 0.05);PCa组TIP和IHT短于良性组,PI高于良性组,差异均有统计学意义(均P < 0.05)。见表1。
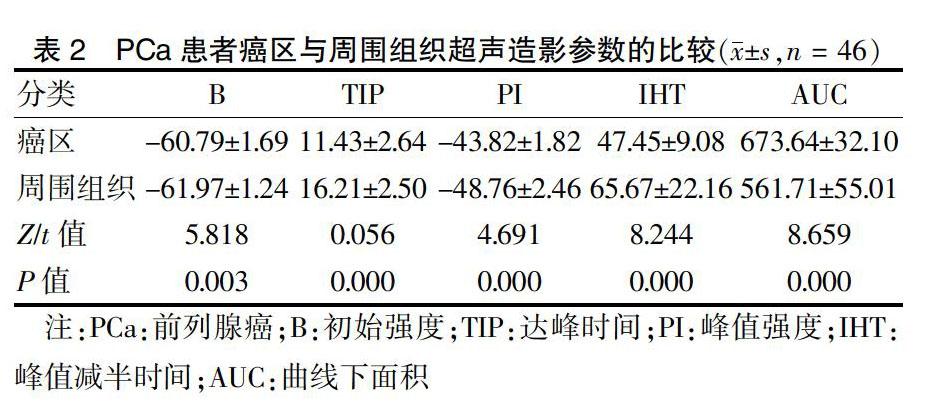
2.4 PCa患者癌区与周围组织超声造影参数比较
PCa患者癌区B、PI和AUC高于周围组织,TIP和IHT低于周围组织,差异均有统计学意义(均P < 0.05)。见表2。
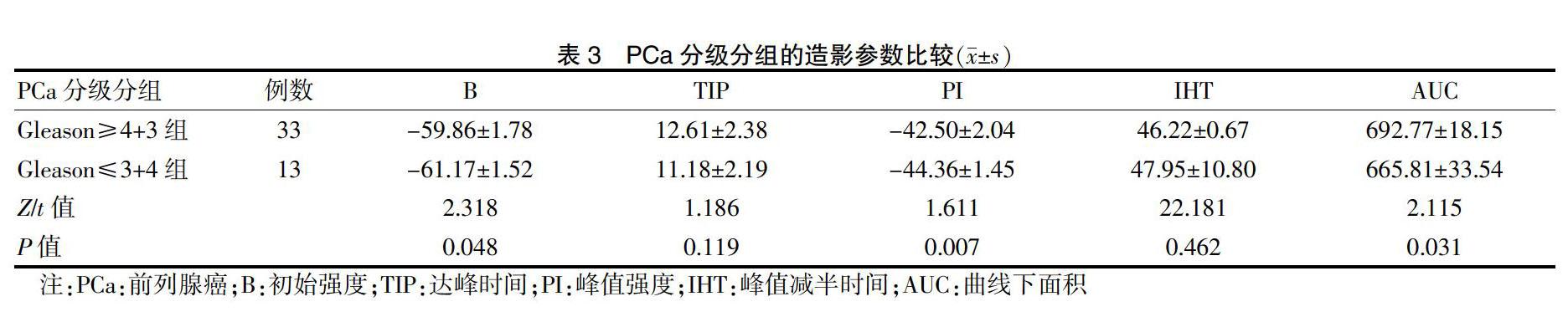
2.5 PCa分级分组的造影参数比较
Gleason≥4+3组B、PI和AUC高于Gleason≤3+4组,差异均有统计学意义(均P < 0.05);两组TIP和IHT比较,差异无统计学意义(P > 0.05)。见表3。
3 讨论
目前常规超声引导下穿刺活检,是在二维超声技术上增加一个彩色多普勒超声,无法提供组织血流灌注的对比[7],使其在诊断上存在局限性。张敏等[8]、Shafiq等[9]研究显示,常规经直肠超声对PCa诊断的敏感度和特异性较低,分别为50%~73.6%、42%~63%。同时,常规超声在实际的前列腺穿刺活检操作中无法提供针对性穿刺的诊断价值。这就更需要一种既能有效识别异常回声区域,又能有效识别良恶性的技术。超声造影剂通过微泡作用,增强肿瘤血流管灌注的对比[10],较常规超声更准确,能够定位肿瘤病灶,有较高的敏感度和特异性[11],为PCa的诊断提供另一种手段。本研究结果显示,前列腺超声造影诊断PCa有较高的敏感度和特异性,通过对此区域的定位和引导下穿刺,更有利于肿瘤的检出。与国外较高的PCa发病率比较[1],本研究在本地区的人群内也有较高的诊断率。造影剂在相同时间增加了病种血流与周围组织的对比,使得PCa患者组织和良性组织间的超声造影参数(除B外)形成明显差异,特别是同一患者PCa组织与周围组织参数差异的特性,有助于肿瘤特性的组织定位,以实现更准确的穿刺定位。王学民等[12]研究进一步指出,PCa诱导新生血管,其组织微血管密度及分布较广,是PCa细胞生长、扩散的血运基础。超声造影通过反映组织微血管灌注,使得PCa的局部血运速度、快速到达峰值并且消退时间段的效应较良性前列腺组织明显,通过差值,动态提示肿瘤的病灶范围。PCa组与良性组B比较,差异无统计学意义(P > 0.05),提示在造影剂的启动阶段,增强对比不明显,不足以判断组织的良恶性,当然还需考虑患者年龄、PSA等方面的个性差异可能[13]。通过分析PCa患者癌区与周围组织超声造影参数发现,癌区与周围组织超声造影参数差异更明显,故利用此可以对超声造影下怀疑PCa患者进行穿刺活检,将可能实现靶向穿刺。
目前PSA筛查和常规经直肠前列腺穿刺活检的普及,在一定程度上造成了PCa的过度诊断和治疗[14],甚至引出增加针数的方法(如饱和穿刺)以提高PCa的诊断率[15]。常规前列腺穿刺方法给患者带来负面影响的同时,其穿刺组织的病理评分能否真实反映患者术后的病理评分,以及能否找出临床上有意义的PCa,还存在许多争议。《泌尿系统和男性生殖器官肿瘤WHO分类》[6]更新了Gleason评分系统,其不单是病理学的重要指标,也是临床医师制订治疗方案的重要参考指标[16],例如Gleason≤3+4组患者的生存预后优于Gleason≥4+3组[17]。超声造影引导下的穿刺能够将肿瘤病灶的汇集区域更集中捕获,通过对应新的分级分组,可能结果更加接近术后或患者的真实病理分级,有助于判断更贴近的临床分期。且Gleason≥4+3组和Gleason≤3+4组患者的情况,也有助于指导肿瘤的分级和判断临床分期。Gleason评分及分级分组能够指导PCa预后判断[18],目前超声造影引导前列腺穿刺癌组织的新分级分组特点及其与超声造影参数的关系仍不多见,同时该系统的应用如何适应临床工作仍有待在进一步的实践中验证和完善。本研究结果显示,Gleason≥4+3组B、PI和AUC高于Gleason≤3+4组,差异均有统计学意义(均P < 0.05);两组TIP和IHT比较,差异无统计学意义(P > 0.05)。提示B、PI和AUC与造影剂在组织微血管灌注后表现的累积效应有关,Gleason≥4+3组患者的肿瘤细胞分化更差,对应的临床分期更高,潜在的组织浸润更广、更深,因此在造影参数的累积效应表现性更加明显,对比分化好的肿瘤或局限性的肿瘤或者其周围正常组织,该差异则更加明显。这种动态和对比的定量分析能力正是常规超声所不具备的。Gleason≥4+3组与Gleason≤3+4组的病理基础、血管生成密度不同和预后均不同[19-20]。TIP和IHT两个参数与造影剂在前列腺组织灌注的速度相关,结合本研究结果,提示通过识别局部血流速度的造影参数对不同Gleason分级分组高低的评估价值并不明显,因而无助于PCa预后的判斷。而B、PI和AUC不受血流速度的影响,存在累积效应,三者在两个分级分组间有差异性,并且与分级分组的高低较为一致,提示其能够通过患者的B、PI和AUC来协助评估临床的预后。
本文不足之处在于:①样本量较小;②没有做PSA的细分类,亦未纳入tPSA对Gleason分级分组结果的影响;③另外由于个体治疗方案不同,无法一一关联术后病理情况进行分级分组结果的反馈,这些都将在下一步的研究中改善。
综上所述,经直肠前列腺超声造影及其引导下穿刺能够实现对PCa的诊断,超声造影参数能够很好的反映良恶性肿瘤新分级分组间的差异性,其差异性与PCa的分级分组高低有较好的一致性,二者可协同评价PCa的预后。
[参考文献]
[1] Siegel RL,Miller KD,Jemal A. Cancer statistics,2019 [J]. CA Cancer J Clin,2019,69(1):7-34.
[2] Choi MH,Lee YJ,Jung SE. The Role of Transrectal Ultrasound for Finding Focal Lesions in Prostate Cancer Detection Compared to Systematic Sextant Biopsy [J]. Acad Radiol,2019,26(8):1023-1029.
[3] Oliyide AE,Tijani KH,Jeje EA,et al. The role of transrectal ultrasound-guided fine-needle aspiration biopsy in the diagnosis of prostate cancer:Sextant versus extended protocol [J]. Niger Postgrad Med J,2017,24(4):236-239.
[4] Kasivisvanathan V,Jichi F,Klotz L,et al. A multicentre randomised controlled trial assessing whether MRI-targeted biopsy is non-inferior to standard transrectal ultrasound guided biopsy for the diagnosis of clinically significant prostate cancer in men without prior biopsy:a study protocol [J]. BMJ Open,2017,7(10):e017863.
[5] Penzkofer T,Tempany-Afdhal CM. Prostate cancer detection and diagnosis:the role of MR and its comparison with other diagnostic modalities—a radiologist′s perspective [J]. NMR Biomed,2014,27(1):3-15.
[6] Magi-Galluzzi C,Montironi R,Epstein JI. Contemporary Gleason grading and novel grade groups in clinical practice [J]. Curr Opin Urol,2016,26(5):488-492.
[7] 周凌,朱江.超聲引导下前列腺穿刺活检方法学研究进展[J].中华超声影像学杂志,2019,28(5):458-461.
[8] 张敏,刘明辉.经直肠超声造影诊断前列腺癌的临床价值[J].中南大学学报:医学版,2018,43(8):882-885.
[9] Shafiq A,Ali RD. Sensitivity and Specificty of Transrectal Ultrasonography (TRUS) in Diagnosing Prostate Cancer [J]. PakJ Med Sci,2011,5(4):741-744.
[10] 张明博,罗渝昆,张艳,等.经直肠多模态超声影像评分系统诊断前列腺癌的临床研究[J].中华医学超声杂志:电子版,2019,16(1):66-71.
[11] 梁丹艳,刘倩,吴国柱,等.超声造影诊断前列腺癌的Meta分析[J].临床超声医学杂志,2019,21(9):651-655.
[12] 王学民,于飞,穆婷婷.肿瘤高频彩超以及超声造影和微血管密度的关联性[J].影像研究与医学应用,2019,3(8):46-47.
[13] Sano F,Uemura H. The utility and limitations of contrast-enhanced ultrasound for the diagnosis and treatment of prostate cancer [J]. Sensors (Basel),2015,15(3):4947-4957.
[14] Wilt TJ,Jones KM,Barry MJ,et al. Follow-up of Prostatectomy versus Observation for Early Prostate Cancer [J]. N Engl J Med,2017,377(2):132-142.
[15] 叶修彬,王豪,邓雅琴,等.经直肠超声造影靶向引导前列腺癌穿刺活检的临床应用[J].中国男科学杂志,2018, 32(6):46-49.
[16] Gasparrini S,Cimadamore A,Scarpelli M,et al. Contemporary grading of prostate cancer:2017 update for pathologists and clinicians [J]. Asian J Androl,2017,21(1):19-23.
[17] 化宏金,张智弘.基于前列腺癌Gleason 评分系统的新分级系统[J].中华病理学杂志,2016,45(7):495-497.
[18] Baras AS,Nelson JB,Han M,et al. The effect of limited (tertiary) Gleason pattern 5 on the new prostate cancer grade groups [J]. Hum Pathol,2017,63:27-32.
[19] 红华,吴国柱,郭瑞强.经直肠超声造影参数及临床资料预测前列腺癌的多因素分析[J].中华超声影像学杂志,2018,27(2):155-159.
[20] 张鸿毅,赵刚刚,李华锋,等.改良Gleason评分系统在7分转移性前列腺癌预后评估中的意义及与VEGF-C表达的关系[J].东南大学学报:医学版,2019,38(3):451-455.
(收稿日期:2020-01-25 本文编辑:刘明玉)

