POLE2对非小细胞肺癌细胞侵袭迁移能力的影响
姬路鹏,彭安萍,张毅,梁庭都
肺癌仍然是导致癌症发病率和死亡率的主要原因之一,预计2018年全球将有180万人死于肺癌[1,2]。肺癌按照组织学类型主要分为腺癌、鳞状细胞癌、大细胞肺癌和小细胞肺癌,其中约85%为非小细胞肺癌(non⁃mall cell lung cancer,NSCLC)[3]。NSCLC恶性程度高、预后差,尽管针对NSCLC的靶向治疗取得了长足的进步,但其五年生存率仍然较低[4,5]。如何进一步揭示NSCLC发生发展的关键驱动基因,明确有效的干预靶点,具有重要的意义。POLE(catalytic subunit of DNA polymerase epsilon)是由POLE基因编码的DNA聚合酶(DNA polymerase epsilon)的催化亚基。POLE能够及时识别并去除复制过程中产生的错误碱基。编码POLE核酸外切酶的基因突变将导致校正功能缺失,而这种缺失与肿瘤的发生、发展有密切关系[6]。研究发现,POLE2与多种疾病相关[7],然而目前关于POLE2在NSCLC中的作用尚不明确。本研究拟在NSCLC细胞中过表达POLE2,检测其对NSCLC细胞侵袭转移能力的影响,并初步探讨可能的分子机制,以期为NSCLC的治疗提供新的靶点。
1 材料与方法
1.1 细胞培养与细胞转染
人NSCLC细胞系SPC⁃A1、A549细胞以及正常人支气管上皮样细胞系BEAS⁃2B细胞均采用含10%的胎牛血清(FBS)的DMEM培养基培养,所有的培养基中均添加100μg/mL的青霉素和链霉素。取对数生长期的细胞用于后续的实验。pcD⁃NA3.1⁃POLE2重组质粒由和元生物技术(上海)股份有限公司构建。转染前一天取对数生长期的细胞,均匀铺板,细胞贴壁后进行转染,转染试剂选择Lipofectamine 2000(Thermo Scientific,美国)。
1.2 Cell Counting Kit⁃8(CCK⁃8)
取对数生长期的细胞,计数后调整细胞密度为5000个细胞100μL,铺板96孔板,分别于转染后24 h、48 h、72 h、96 h向96孔板中加入10 μL CCK⁃8溶液(碧云天),细胞培养箱中继续孵育2 h后测量450 nm波长处的吸光度(OD)值。
1.3 Transwell迁移实验
取对数生长期的细胞,计数后调整细胞密度为5×104个细胞/200μL接种于Transwell小室的上室;在下室中加入600μL含有10%FBS的完全培养基作为趋化因子;置于细胞培养箱中进行培养;24~36 h后用棉签轻轻擦去上室中的细胞;4%多聚甲醛中固定10 min;然后用0.01%的结晶紫溶液(碧云天)染色10 min;随机选取3个视野在倒置显微镜下拍照并进行计数。
1.4 Transwell侵袭实验
侵袭实验开始的前一天,在Transwell小室内加入含有基质胶(BD,美国)的DMEM培养基(基质胶:DMEM培养基=1∶8)30μL于培养箱中过夜待用。取对数生长期的细胞,计数后调整细胞密度为1×105个细胞/200μL接种于Transwell小室的上室;在下室中加入600μL含有10%FBS的完全培养基作为趋化因子;置于细胞培养箱中进行培养;36~48 h后用棉签轻轻擦去上室中的细胞;4%多聚甲醛中固定10 min;然后用0.01%的结晶紫溶液(碧云天)染色10 min;随机选取3个视野在倒置显微镜下拍照并进行计数。
1.5 RNA提取和实时荧光定量PCR(qRT⁃PCR)
应用RNAiso Plus试剂(Takara,大连,中国)从细胞中提取RNA;然后应用PrimeScriptTMRT Mas⁃ter Mix反转录试剂盒(Takara)将RNA反转录为cDNA;再以cDNA为模板,用TB Green®Fast qPCR Mix实时荧光定量PCR试剂盒(Takara)进行qRT⁃PCR扩增反应。POLE2正向引物:5′⁃TGAGAAGC⁃AACCCTTGTCATC⁃3′,反向引物:5′⁃TCATCAACA⁃GACTGACTGCATTC⁃3′;MMP9 正向引物:5′⁃TG⁃TACCGCTATGGTTACACTCG⁃3′,反向引物:5′⁃GG⁃CAGGGACAGTTGCTTCT⁃3′;β⁃actin正向引物:5′⁃GAAATCGTGCGTGACATTAA⁃3′,反向引物:5′⁃AA⁃GGAAGGCTGGAAGAGTG⁃3′。以 2⁃ΔΔCt法计算目的基因的相对表达量。
1.6 Western blot检测蛋白的表达水平
收集细胞提取总蛋白;BCA试剂盒(碧云天)测定蛋白浓度。SDS⁃PAGE凝胶电泳分离蛋白质后转膜;5%脱脂奶粉室温封闭1 h;加入相应的抗体(POLE2,Sigma⁃Aldrich,WH0005427M1;β⁃actin,Cell Signaling,#3700)4°C孵育过夜;TBST洗涤后加入辣根过氧化物酶标记的II抗室温下孵育1 h;ECL发光液(碧云天)曝光,ImageJ测量条带的灰度值。
1.7 统计学方法
采用SPSS19.0统计软件进行数据分析。数据采用均数±标准差(mean±SD)表示,组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 POLE2在人NSCLC细胞中表达上调
为了检测POLE2在NSCLC中的表达水平,我们首先通过qRT⁃PCR的方法检测了NSCLC细胞系SPC⁃A1、A549细胞和人支气管上皮样细胞系BE⁃AS⁃2B细胞中POLE2的表达水平。研究发现,对比正常人支气管上皮样细胞BEAS⁃2B,人NSCLC细胞SPC⁃A1、A549的POLE2的表达水平较高(P<0.05,见图1)。
2.2 POLE2过表达促进了NSCLC细胞A549的增值
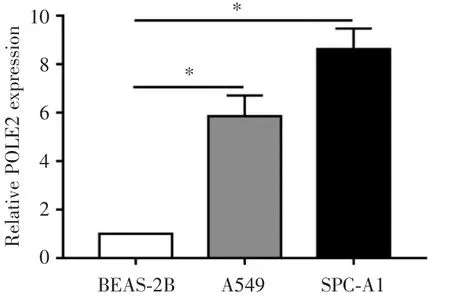
图1 人支气管上皮样细胞系和NSCLC细胞系中POLE2的表达水平
为了探讨POLE2在NSCLC中的作用,POLE2重组过表达质粒(pcDNA3.1⁃POLE2)用于构建A549⁃POLE2过表达细胞模型,过表达效率通过qRT⁃PCR和Western blot进行验证。结果发现,与对照组(pcDNA⁃vector)相比,A549细胞的POLE2的mRNA和蛋白水平明显上调(P<0.05,见图2)。
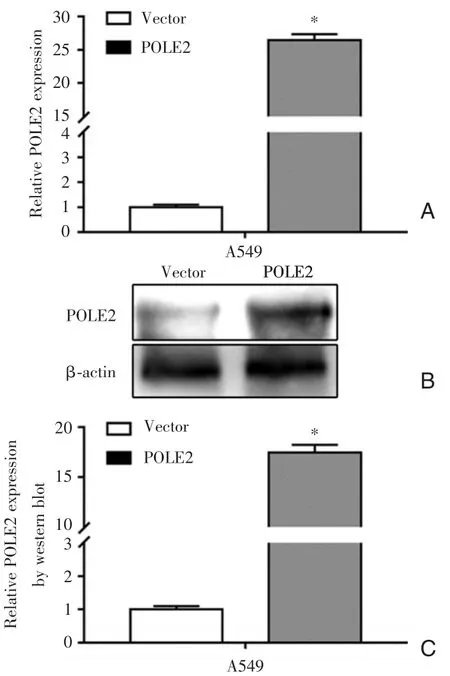
图2 POLE2过表达效率验证
接下来,我们通过CCK⁃8实验检测过表达POLE2对于A549细胞增值能力的影响,结果发现,过表达POLE2明显促进了A549细胞的增值(P<0.05,见图3)。
2.3 POLE2过表达促进了A549细胞的侵袭迁移
为了探讨POLE2对于A549细胞侵袭迁移能力的影响,我们通过Transwell实验探讨A549细胞在过表达POLE2前后侵袭迁移能力的变化。Tran⁃swell迁移实验结果显示,过表达POLE2明显促进了A549细胞的侵袭迁移(P<0.05,见图4)。
2.4 POLE2过表达上调了MMP9的表达
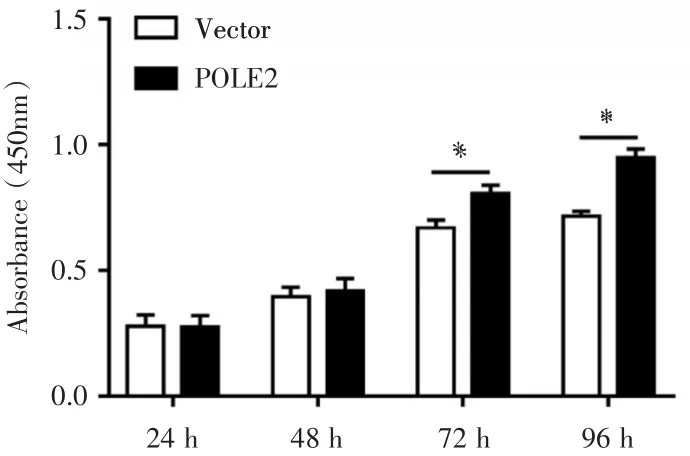
图3 CCK⁃8检测过表达POLE2对A549增殖能力的影响
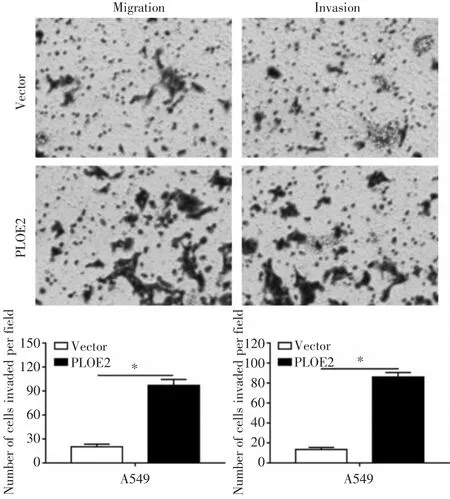
图4 Transwell检测POLE2过表达对A549细胞的侵袭迁移能力的影响
通过qRT⁃PCR法检测过表达POLE2后A549细胞MMP9的表达情况。结果显示,相比对照组pcDNA⁃vector),转染pcDNA⁃POLE2过表达质粒,MMP9表达水平上调(P<0.05,见图5)。
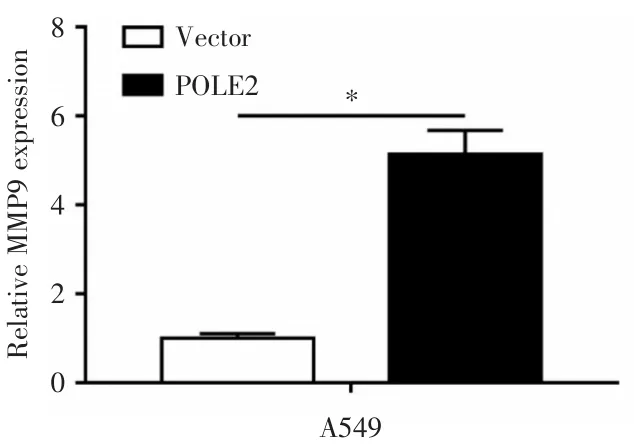
图5 qRT⁃PCR法检测POLE2过表达后A549细胞MMP9的表达水平
3 讨论
尽管针对NSCLC的治疗已经有了巨大的进步,但其五年生存率仍然较低[4,5],主要原因是临床上确诊的NSCLC病例往往已经处于中晚期[5]。因此,急待开发新的针对NSCLC的治疗靶点。人类基因组至少有15种DNA聚合酶,共同调控基因的复制与修复[8]。其中DNA聚合酶B家族的结构和功能具有高度的保守性[8,9],保守区域的碱基发生突变常引起DNA保真性的下降[10]。POLE2属于DNA聚合酶B家族中的成员,是由POLE基因编码的DNA聚合酶ξ的亚基。POLE是DNA聚合酶核心结构,大致分为两个部分,N端包含催化亚基中最重要的两个区:聚合酶区和核酸外切酶区,C端无催化功能,但起到与DNA聚合酶ξ另外三个亚基相互联系的作用。POLE突变与肿瘤的发生、发展密切相关。
为了研究POLE2对NSCLC细胞侵袭转移能力的影响,我们首先通过qRT⁃PCR的方法检测了NSCLC细胞系和人支气管上皮样细胞中POLE2的表达水平。结果显示,POLE2在人NSCLC细胞SPC⁃A1、A549中的表达较人支气管上皮样细胞BEAS⁃2B高,提示POLE2在NSCLC的发生发展中可能发挥重要的作用;继而,我们以POLE2表达相对较低的A549细胞为研究对象,探讨POLE2对于NSCLC细胞侵袭迁移能力的影响。本研究将重组质粒pcDNA3.1⁃POLE2转染至A549细胞中,上调A549细胞POLE2的表达,结果显示过表达POLE2能够促进A549细胞的增殖和侵袭迁移。POLE2属于DNA聚合酶超家族的一员。近年来研究发现,POLE2作为关键的癌基因,参与多种恶性肿瘤的发生发展。新进研究表明,POLE在子宫内膜癌、结直肠癌中发挥重要作用[11,12]。本研究结果显示过表达POLE2同样促进了NSCLC细胞的侵袭迁移。肿瘤的转移是一个复杂过程,与细胞内信号转导有关。基质金属蛋白酶(MMP)家族参与调控肿瘤细胞的侵袭迁移过程[13,14]。肿瘤细胞合成和分泌MMP降解细胞外基质,促进肿瘤细胞的侵袭转移[15]。MMP9是MMPs家族重要成员,与肿瘤的侵袭迁移密切相关[16]。本研究发现POLE2可能通过上调MMP9从而促进NSCLC细胞的侵袭迁移。
综上所述,本研究证实POLE2在NSCLC细胞中呈高表达,过表达POLE2可能通过上调MMP9的表达促进NSCLC细胞的侵袭迁移,这为NSCLC的进一步治疗提供了可能的靶点。

