短时程脊髓电刺激对带状疱疹后神经痛的临床疗效观察
罗 奇 李 鹏 王 宇 沈玉杰 王家双 肖礼祖
(1 武汉市普仁医院疼痛科,武汉 430000;2 广州中医药大学附属金沙洲医院疼痛科,广州 510000;3 深圳市南山区人民医院疼痛科,深圳 518000)
带状疱疹后神经痛 (postherpetic neuralgia, PHN) 是带状疱疹最严重的并发症,属于神经病理性疼痛范畴,水痘-带状疱疹病毒在某种原因侵袭人体后潜伏在神经节内,当人体免疫力低下的时候病毒沿着同阶段周围神经快速复制破坏神经并侵袭相应皮节,部分病人在皮损消退后,疼痛不缓解,称之为带状疱疹后神经痛[1]。通常表现为持续性烧灼痛、电击痛、刀割样痛等,同时可伴有感觉异常及迟钝,出现蚁行感、瘙痒,严重者还可伴有相应运动神经功能障碍。美国多项回顾性研究中,PHN 发病率占带状疱疹病人6.5%~18%;前瞻性研究中,发病率更是高达 30%[2]。PHN 发病率与年龄成增长趋势,且主要见于年龄> 50 岁人群,同时与风湿免疫疾病等慢性疾病有密切关系[3]。
目前国内针对PHN 的治疗方法很多,如皮损区皮下阻滞、背根神经节脉冲、硬膜外阻滞、椎旁阻滞、交感神经阻滞等[4],这些治疗可不同程度缓解病人症状,但部分病人症状反复,远期疗效较差,严重影响病人生活质量。近年来,脊髓电刺激治疗疼痛得到广泛推广,国内有学者发表带状疱疹急性期及亚急性期脊髓电刺激治疗的报道,但关于PHN的报道较少[5~7]。因此,我科针对脊髓电刺激治疗PHN 进行了一项前瞻性研究,旨在观察短时程脊髓电刺激治疗PHN 的临床疗效,以期找到有效缓解PHN 的方法。
方 法
1.一般资料
本研究已获武汉市普仁医院伦理委员会批准,并与病人及家属进行知情告知并签订知情同意书。选择武汉市普仁医院2016 年1 月至2017 年12 月间,符合纳入标准连续入组47 例病人,其中男25 例,女22 例。所有病人均经过详细询问病史、体格检查及相关辅助检查。病人年龄分布40~90 岁,平均年龄68.3 岁,平均病程51.4 天,疼痛视觉模拟评分法(visual analogue scale, VAS)平均评分7.3 分。疱疹分布于颈部、胸背部、腰部及下肢,且均为单侧神经。
纳入标准:①既往诊断为带状疱疹;②疱疹愈合后,持续疼痛大于3 个月;③经过规范治疗后,疼痛控制不佳,VAS > 4 分。
排除标准:①脊髓电刺激穿刺区域感染;②凝血功能障碍;③严重心肺肾功能障碍;④存在脊柱结核及肿瘤等;⑤存在心理疾患,无法沟通及无法耐受手术。
2.治疗方法
术前给予病人完善的宣教,使术中病人能准确描述异感及分布区域。病人取俯卧位,在介入治疗室 (digital subtractive angiograpy, DSA) 下定位合适的穿刺椎间隙作为穿刺点,开放静脉、进行循环呼吸检测,常规消毒铺巾,用22G 硬膜外穿刺针穿刺,直到出现突破感,在X 线透视下证实穿刺针进入硬膜外腔,植入8 触点神经刺激测试电极(Medtronic 3873 型),将第3、4 触点放置于脊髓节段背侧脊髓后中线旁开2~4 mm 的理想位置,连接电极延长线及脉冲发生器,给予刺激测试,测试参数为脉宽60~80 μs、频率60~80 Hz、刺激强度 0.8~3.2 V,逐步加大刺激强度,直到病人患区出现麻刺感,且患区全部覆盖,皮肤穿刺点处给予缝合线锚定,拔出硬膜外穿刺针,穿刺部位局部敷贴。植入电极影像图见图1。
3.术后护理及并发症
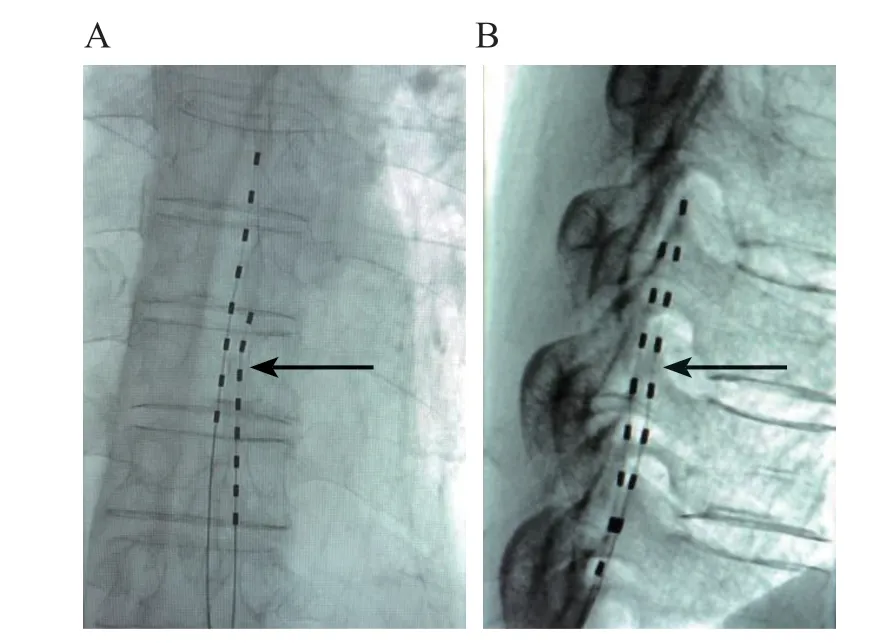
图1 图中黑色箭头所示连续黑色虚线为电极,X 线示电极正位(A)位于脊髓后中线旁开2 ~4 mm,侧位(B)位于脊髓背侧
术后给予2 周以内的连续体外测试程控。术后24 h 限制病人起床及剧烈的弯腰活动,避免电极移位,如出现电极移位,应通过改变体位及调整程控参数给予处理;加强切口换药护理,避免出现感染;定期复查X 线,确定电极是否移位;术中及术后无明显并发症发生。
4.评价指标
(1)采用VAS 评定术前、术后1 天、3 天、1 周、1 个月、3 个月疼痛改善情况。
(2)采用匹兹堡睡眠质量指数(pittsburgh sleep quality index, PSQI)评定睡眠质量,由19 个自评条目及5 个他评条目构成,PSQI 总分0~21 分,得分越高,睡眠质量越差,测试者须在5~10 分钟内完成测试。测试包括术前、术后1 天、3 天、1 周、1 个月、3 个月睡眠质量改善情况。
(3)术后1 天、3 天、1 周、1 个月、3 个月治疗疗效评价,疗效显著:VAS 下降大于75%;良好:50%~75%;中等:30%~50%;无效:< 30%。若VAS 下降大于50%,视为有效治疗。
5.统计学分析
统计分析采用SPSS 19.0 软件包进行统计学处理,计量资料数据用均数±标准差(±s)表示,以One-way ANOVA 方差分析进行统计学处理。P < 0.05 表示差异有统计学意义。
结 果
1.术前术后各时间节点VAS 和PSQI 评分
术后1 天、3 天、1 周、1 个月、3 个月VAS评分较术前比较有显著性差异(P < 0.001,见表1),整体疼痛评分走向呈快速持续下降趋势;术后1 天、3 天、1 周、1 个月、3 个月PSQI 评分较术前比较有显著性差异(P < 0.001,见表2),整体睡眠质量呈逐渐变好的趋势。
2.术后各时间节点治疗有效率
术后1 天有效21 例,有效率为44.68%;术后3 天有效25 例,有效率为53.19%;术后1 周有效29 例,有效率为61.70%;术后1 个月有效39 例,有效率为82.97%;术后3 个月有效41 例,有效率为87.23%(见表2)。
3.并发症及不良反应
所有病例未出现脑脊液渗漏、感染、较大程度的电极移位、电极线折断、明显的神经根刺激痛、过敏反应等。
讨 论
1965 年,Ron Melzack 和Patrick Wall 首次提出了闸门学说,为SCS 神经调控镇痛提供了理论基础。该假设提出痛觉信号通过脊髓后角细胞向中枢传导是经过周围神经系统中粗、细神经纤维平衡调控的,细纤维兴奋时,痛觉上传信号的闸门被打开,粗纤维兴奋时,闸门被关闭,疼痛及得到抑制。粗纤维的兴奋阈值低于细纤维,当脊髓电刺激选择性兴奋粗纤维时,闸门关闭,阻滞了痛觉信息的传递通路,达到了缓解疼痛的效果[7]。还有学者研究提出了脊髓电刺激治疗疼痛的神经递质机制:SCS 刺激脊髓后柱增加γ-氨基丁酸 (aminobutyric acid, GABA) 的释放,进而明显抑制触觉性痛觉过敏,同时使兴奋性氨基酸(谷氨酸、天冬氨酸等)在脊髓后角的释放减少,并在不同程度上促进内源性镇痛物质的释放[8]。此外,对于缺血性疼痛,SCS 通过两种途径:①刺激脊髓后根和周围神经纤维,促进血管舒张因子释放;②通过神经节烟碱受体和肾上腺素受体,间接调节自主神经系统功能;抑制血管收缩,改善疼痛[9]。
表1 治疗前后不同时间点VAS、PSQI 评分(±s)
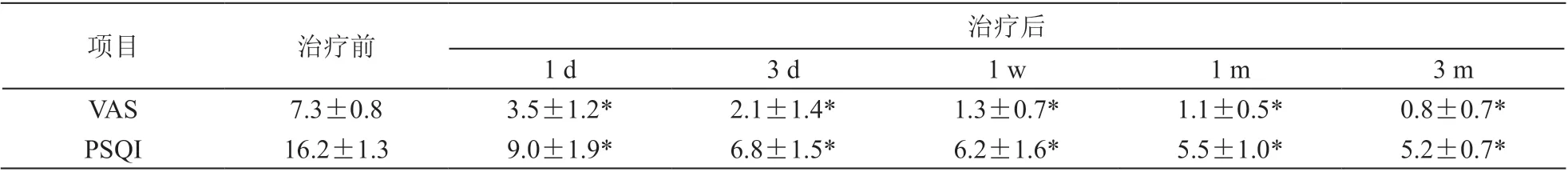
表1 治疗前后不同时间点VAS、PSQI 评分(±s)
*P < 0.001,与治疗前相比
项目治疗前治疗后 1 d3 d1 w1 m3 m VAS7.3±0.83.5±1.2*2.1±1.4*1.3±0.7*1.1±0.5*0.8±0.7*PSQI16.2±1.39.0±1.9*6.8±1.5*6.2±1.6*5.5±1.0*5.2±0.7*
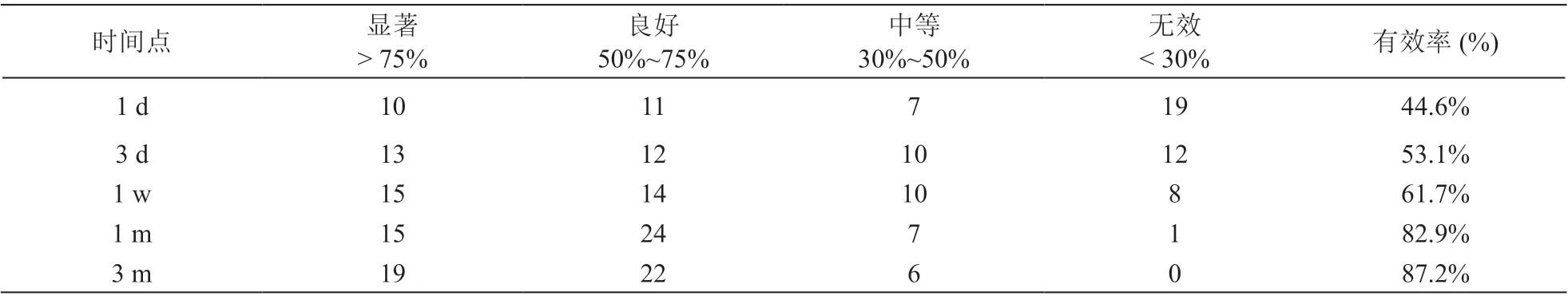
表2 治疗后不同时间点有效率
目前关于PHN 的发病机制尚未明确。当人体免疫平衡失衡时,原本潜伏在背根神经节内的带状疱疹病毒因其噬神经性,开始大量破坏周围神经纤维,破坏了脊髓上行抑制性传导,导致过量兴奋性信号传入中枢,引起交感传出纤维激活了外周感受器,使初级感受器的兴奋性增高[10]。有学者提出带状疱疹病毒对周围神经纤维破坏;神经纤维的再生、修复;以及中枢投射纤维的病变引起的中枢敏化是产生疼痛的主要原因[11]。还有人提出在PHN 发生发展的过程中,其周围敏化和中枢敏化机制是产生疼痛的直接原因[12]。
虽然国外使用SCS 治疗PHN 已经多年,且大部分为永久性植入,但由于各种原因国内开展较少。有研究针对101 例PHN 病人给予SCS,术后回访3个月,病人症状缓解明显,且不同年龄段治疗周期随年龄增长而上升[13]。有学者针对PHN 病人给予脊髓电刺激治疗和背根节脉冲射频治疗各20 例,观察术后不同时间段疼痛程度及睡眠质量,结果显示两组治疗后各时间段简化 McGill 评分 (short-form of McGill pain questionnaire, SF-MPQ) 均较术前显著降低,睡眠治疗评分较治疗前显著增加,脊髓电刺激治疗组疗效优于背根神经节脉冲射频治疗组[14]。本研究通过对47 例PHN 病人术前、术后1 天、3 天、1 周、1 个月、3 个月不同时间节点的疼痛评分及睡眠质量评分,做了系统的统计分析,统计结果表明术后不同时间节点疼痛及睡眠质量均得到明显改善,说明SCS 对于带状疱疹后神经痛有显著疗效。
同时术后不同时间节点治疗疗效的统计显示,术后第1 天治疗有效率就达44.68%,说明SCS 有着良好的即时镇痛疗效,这可能与SCS 的神经电生理机制有关,选择性兴奋粗纤维,关闭了神经传导闸门,阻滞了痛觉信息向中枢传导,从而快速缓解了病人疼痛症状。术后1 周,治疗有效率上升到61.70%,术后1 个月治疗有效率更是上升到了82.97%,考虑到硬膜外植入物放置过久容易引起感染问题,本研究给予所有病人SCS 治疗周期均不超过2 周,但病人的症状缓解在2 周以后持续存在,这说明SCS 的镇痛效果存在延时效应,这可能与SCS 的神经递质机制有关,一些抑制性神经递质的释放,抑制了感受伤害性刺激的神经元活性,激活了疼痛的中枢下行抑制通路,并促进一些内源性镇痛物质的持续释放,达到持续镇痛的效果。有学者提出SCS 镇痛效应常常会滞后,会在术后2~3 周出现,其镇痛持久性要优于背根神经节脉冲射频[14],与本研究结果是一致的。
年龄大于60 岁为带状疱疹高发年龄,PHN 的发生也与高龄因素存在正向关系,且治疗难度更大[15]。本研究中,大于60 岁病人共35 例,平均治疗周期为12.3 天,小于60 岁病人共12 例,平均治疗周期为10.7 天,明显低于年龄大于60 岁病人,说明高龄可能是治疗PHN疗效的重要相关因素。本研究中,病程大于6 个月的病人共6 例,属于顽固性PHN,经过SCS 治疗后,VAS 和PSQI 评分均下降大于50%,说明SCS 对于病程较长的顽固性PHN 也有不错的疗效。
综上所述,脊髓电刺激疗法能有效缓解PHN,改善病人睡眠质量。对于一些年龄较大、病程较长的病人也有显著疗效,且其安全性高。本研究也有其局限性,仅观察了SCS 术后3 个月内疗效,须进一步进行后期回访;不同术者操作水平不同,不同工程师术后电刺激程控能力不同,均会导致研究结果的偏差,另外,由于SCS 临床费用较高,各地医保存在差异,临床样本较少,其有效率、复发率及远期疗效有待进一步观察和研究。

