益气活血通络方对急性脑梗死大鼠炎症因子、氧化应激指标及神经细胞凋亡的影响∗
闫振文 郑眉光 李 梅
(中山大学孙逸仙纪念医院,广东 广州 510120)
急性脑梗死(ACI)系指脑缺血发生在6~12 h之内,缺血区脑组织会产生病理改变,细胞出现明显的缺血变化。脑细胞缺血缺氧后,脑组织将会发生氧化应激反应和炎性反应等一系列病理反应,诱导产生大量氧自由基和炎性因子,使蛋白质、氨基酸、脂质等过氧化,产生细胞毒性并破坏血脑屏障,进一步加重脑损伤,导致大脑水肿和神经细胞凋亡[1]。研究发现,脑组织缺血后,自由基可通过激活丝裂原活化蛋白激酶(MAPK)信号转导通路协同诱导神经细胞凋亡[2]。目前,临床对ACI的治疗主要以恢复血供、增加氧再灌注水平为原则,以减轻甚至避免因缺血缺氧导致的脑组织损伤,最大限度地保护脑组织。常规治疗以溶栓、抗凝、抗血小板聚集等方法为主,尤其是静脉溶栓,被医学界公认为挽救缺血脑组织的重要方法,但均无法及时清除氧自由基等物质[3]。
急性脑梗死在中医学上属“内风”范畴,为内伤病证。中医认为诱发中风的病因主要有机体腑脏失调、情志郁怒、饮食不节、劳累过度、气候改变等,其病机多以气血运行不畅、瘀血阻脉、久瘀化热最常见,故治疗时应以活血化瘀、行气通络为主[4]。益气活血通络方以黄芪、党参为君药,以当归、丹参、川芎为臣药,具有益气固表、活血化瘀、行气解毒通络的功效,适用于中风。本研究通过复制SD大鼠急性脑梗死模型,旨在探讨益气活血通络方对急性脑梗死模型大鼠相关炎症因子、氧化应激指标及神经细胞凋亡的影响。
1 材料与方法
1.1 实验动物 50只清洁级雄性SD大鼠,7~8周龄,平均体质量(250±20)g,购自北京维通利华实验动物技术有限公司,动物许可证号:SCXK-(京)2010-0015,合格证号:110011191100312。所有动物室温饲养,自由饮水进食,符合《实验动物管理条例》要求。
1.2 药物与试剂 益气活血通络方,组成:黄芪30 g,党参30 g,川芎10 g,当归10 g,丹参10 g,赤芍10 g,红花10 g,桃仁15 g,地龙10 g,甘草6 g。上述中药饮片均由本院中药房提供,药材加水煎煮2次,合并药液共200 mL,生药含量0.7 g/mL。注射用尿激酶(广东天普生化医药股份有限公司,批号20190521,规格25万单位);阿司匹林肠溶片(拜阿司匹林,沈阳奥吉娜药业有限公司,批号20190323,规格100 mg);硫酸氢氯吡格雷片(帅信乐普药业股份有限公司,批号20180715,规格75 mg);依达拉奉注射液(国药集团国瑞药业有限公司,批号91130117,规格30 mg/20 mL);水合氯醛(分析纯,天津市瑞金特化学品有限公司);苏木精-伊红染色液(武汉华美生物工程有限公司);白细胞介素-8(IL-8)和肿瘤坏死因子-α(TNF-α)试剂盒、S100B蛋白试剂盒购于武汉博士德生物技术有限公司;丙二醛(MDA)、超氧化物歧化酶(SOD)、脑源性神经营养因子(BDNF)由南京建成生物工程研究所提供。
1.3 实验仪器 RM2235型病理切片机,德国莱卡公司;BX60显微镜,日本Olympus Optical公司;LDZ-2型低速离心机(北京京立离心机有限公司);AU5400全自动生化分析仪,日本奥林巴斯有限公司;ELx800酶标仪,美国伯腾仪器有限公司。
1.4 模型制备 大鼠随机分为对照组10只、假手术组10只、手术组30只。参照Zealand-Longa线栓法[5]复制大脑中动脉缺血模型(MCAO)。将手术组30只大鼠用5%水合氯醛(400 mg/kg)行腹腔麻醉,将实验大鼠侧卧固定于手术台上,颈正中线切口,分离右侧颈总动脉、颈外动脉和颈内动脉,分别结扎颈外动脉与颈总动脉。在颈总动脉分叉下方开一切口,将线栓从切口处插入颈内动脉,有明显阻力感时停止插入,剪去线栓尾端部分,并在颈内动脉根部固定,逐层缝合皮下组织及皮肤。术后腹腔注射2万单位青霉素,大鼠保持侧卧位,体温维持在37℃左右,注意吸痰保持呼吸道通畅。动物清醒后明显有对侧Horner征及偏瘫体征,包括:1)身体向左倾倒或转圈;2)左侧躯体对疼痛刺激无反应;3)提尾悬空时左前肢前伸现象消失;显示造模成功。神经功能缺损评分1~3分为合格,不合格者剔除。假手术组10只大鼠将栓线由ECA断端插入ICA,保留约1 min后将栓线拔出,结扎ECA断端,其余步骤同模型组。
1.5 分组及给药 成模大鼠分为模型组、西药组、联合组(西药组+益气活血通络方),于建模后第10日开始给药。对照组、假手术组和模型组给予生理盐水灌胃,剂量为5 mL/kg。西药组给予注射用尿激酶静滴,剂量5万U/kg;阿司匹林肠溶片和氯吡格雷灌胃,剂量各1 mg/kg;依达拉奉静滴,剂量0.15 mg/kg。联合组在西药组基础上给予益气活血通络方灌胃,剂量5 mL/kg。各组均每天灌胃1次,连续治疗10 d。
1.6 标本采集与检测 1)炎症因子测定:于末次给药后,心脏取血,离心,取上层血清,采用酶联免疫吸附法(ELISA)测定各组大鼠血清IL-8和TNF-α水平,严格按说明书操作。2)氧化应激指标测定:心脏取血,离心,取上层血清,采用黄嘌呤氧化酶法测定各组大鼠SOD水平,采用ELISA测定MDA水平,严格按说明书操作。3)神经功能指标测定:心脏取血,离心,取上层血清,采用放射免疫法检测血清S100B蛋白、BDNF水平,严格按说明书操作。4)脑组织病理切片:末次给药后处死各组大鼠,4℃下快速断头取脑,0.9%氯化钠注射液清洗后,置于4%多聚甲醛中固定48 h,二甲苯脱脂,酒精梯度脱水,石蜡包埋,切片,每片厚约5 μm,苏木精-伊红染色,观察各组大鼠的脑组织病理变化。
1.7 统计学处理 应用SPSS22.0统计软件。计量资料以(±s)表表示,组间或组内数据比较采用t检验;采用χ2检验进行计数资料的比较,以n(%)表示计数资料。P<0.05为差异有统计学意义。
2 结果
2.1 各组脑组织病理学比较 见图1。各组大鼠脑组织病理学切片显示:联合组少数神经细胞死亡,细胞质疏松及肿胀明显减轻;西药组细胞核少见固缩,脑组织水肿有减轻;模型组脑组织周围神经元肿胀并出现皱缩,细胞核固缩,梗死灶内细胞和血管坏死,正常组织消失,结构模糊、间质水肿;对照组及假手术组细胞形态正常,分布均匀,未见皮质部苍白梗死。

图1 各组大鼠脑组织病理学切片(HE染色,400倍)
2.2 各组炎症因子水平比较 见表1。对照组和假手术组大鼠的IL-8、TNF-α水平相比无明显差异(P>0.05)。与对照组比较,模型组IL-8、TNF-α水平显著升高(P<0.05);与模型组比较,西药组和联合组IL-8、TNF-α水平均显著降低(P<0.05);与西药组比较,联合组IL-8、TNF-α水平显著降低(P<0.05)。
表1 各组大鼠IL-8、TNF-α水平比较(ng/L,±s)

表1 各组大鼠IL-8、TNF-α水平比较(ng/L,±s)
与对照组比较,∗P<0.05;与模型组比较,#P<0.05;与西药组比较,△P<0.05。下同
TNF-α组别n IL-8 6.14±0.86 6.82±1.04 22.31±1.58*11.59±1.25*#8.37±1.12#△对照组假手术组模型组西药组联合组10 10 10 10 10 18.40±3.91 19.12±4.03 43.52±15.48*30.36±12.35*#22.27±9.56#△?
2.3 各组氧化应激指标比较 见表2。对照组和假手术组大鼠的SOD、MDA水平比较无明显差异(P>0.05)。与对照组比较,模型组SOD水平显著降低、MDA水平显著升高(P<0.05);与模型组比较,西药组和联合组SOD水平均显著升高、MDA水平均显著降低(P<0.05);与西药组比较,联合组SOD水平显著升高、MDA水平明显降低(P<0.05)。
表2 各组大鼠SOD、MDA水平比较(±s)
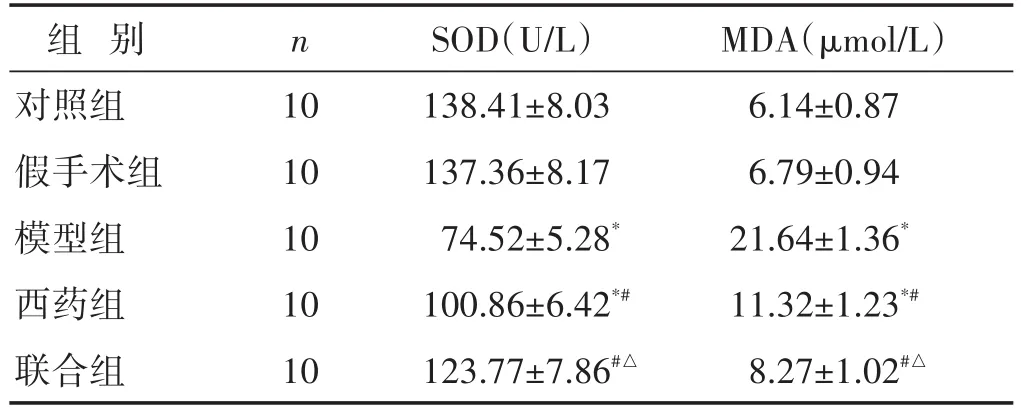
表2 各组大鼠SOD、MDA水平比较(±s)
组别对照组假手术组模型组西药组联合组n 10 10 10 10 10 SOD(U/L)138.41±8.03 137.36±8.17 74.52±5.28*100.86±6.42*#123.77±7.86#△MDA(μmol/L)6.14±0.87 6.79±0.94 21.64±1.36*11.32±1.23*#8.27±1.02#△
2.4 各组神经功能指标比较 见表3。对照组和假手术组大鼠的S100B、BDNF水平比较无明显差异(P<0.05)。与对照组比较,模型组BDNF水平显著降低、S100B水平显著升高(P<0.05);与模型组比较,西药组和联合组BDNF水平均显著升高、S100B水平均明显降低(P<0.05);与西药组比较,联合组血清BDNF水平明显升高、S100B水平显著降低(P<0.05)。
表3 各组大鼠S100B、BDNF水平比较(ng/mL,±s)
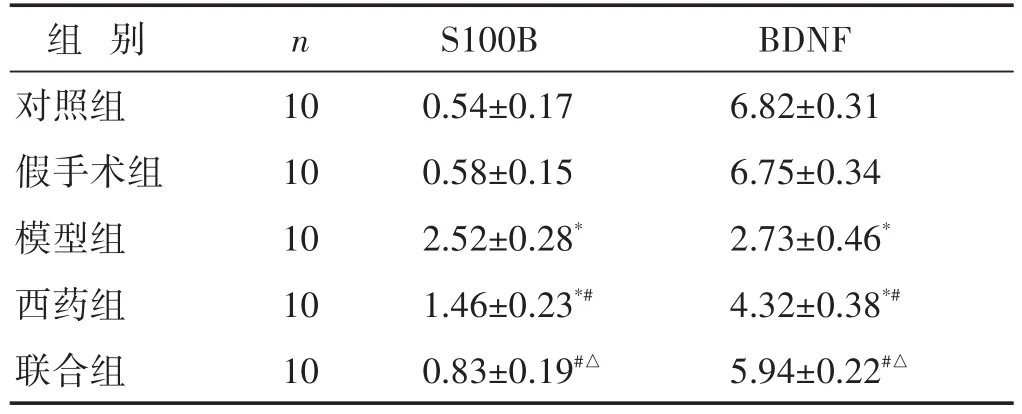
表3 各组大鼠S100B、BDNF水平比较(ng/mL,±s)
组别对照组假手术组模型组西药组联合组n 10 10 10 10 10 S100B 0.54±0.17 0.58±0.15 2.52±0.28*1.46±0.23*#0.83±0.19#△BDNF 6.82±0.31 6.75±0.34 2.73±0.46*4.32±0.38*#5.94±0.22#△
3 讨 论
急性脑梗死具有发病急、致残率和死亡率均较高而治愈率低等特点[6],严重威胁人类的生命健康。ACI发病后脑组织会发生不可逆损伤,严重者还可能出现脑组织缺血性坏死,易引发神经系统功能性异常[7]。
研究发现,脑缺血性损伤的发生发展与氧化应激、炎性反应均密切相关[8]。氧化应激系指机体受到刺激后,氧化和抗氧化能力失衡,倾向于氧化,导致中性粒细胞炎性浸润,蛋白酶分泌增加,进而产生大量氧化中间产物,是自由基大量堆积所致的负作用,其和炎症通常紧密相连、相伴而生[9]。研究证明,氧自由基的大量堆积是引发急性缺血性神经细胞死亡的重要原因之一[10],所以有效减少氧自由基,减轻氧化应激反应并抑制炎性反应是治疗急性脑梗死的重要手段。SOD作为体内重要的抗氧化酶,是氧自由基的自然天敌,是清除氧自由基的头号物质,可对抗甚至逆转氧自由基对细胞的损害,修复自由基引起的细胞损伤。有研究表明,SOD能通过磷酸化AKT减弱缺血损伤导致的细胞凋亡[11]。
当生物体内产生大量的氧自由基时,会大量消耗SOD,使SOD水平降低;而MDA是由细胞膜中脂质氧化后形成的,是氧化应激反应与氧自由基升高的重要标志物,因此MDA水平的高低直接反映了生物体内氧自由基的水平以及氧化应激反应的程度,是评估氧自由基水平及氧化应激的重要指标[12]。目前临床已逐渐重视脑缺血早期对脑组织的炎性损伤,意识到IL-8和TNF-α等炎症因子在诱发炎性反应的过程中起着重要作用[13]。其中IL-8属于趋化因子家族的一种细胞因子,利于趋化免疫效应细胞,通过对中性粒细胞的细胞趋化作用而实现对炎症反应的调节,并能促使多种生物活性物质释放[14]。TNF-α是一种单核因子,属前炎细胞因子,主要由活化的单核细胞和巨噬细胞产生,促进中性粒细胞吞噬,诱导肝细胞急性期蛋白合成,是重要的炎症因子,且IFN-γ对TNF-α的生成有刺激作用。当脑组织缺氧缺血时,TNF-α水平将会升高,并能诱导中性粒细胞和单核细胞产生IL-8,引发炎性反应,进而相互影响,共同作用造成细胞损害[15]。因此,有效降低IL-8和TNF-α等炎症因子水平对减轻炎性反应、控制炎性损伤有重要意义。
S100B蛋白是一种脑特异蛋白,主要分布于神经系统星形胶质细胞、垂体前叶细胞。当星形胶质细胞发生损伤时,S100B蛋白的释放量会明显增加,并进一步刺激星形胶质细胞、小胶质细胞产生大量炎性因子及NO,诱导神经细胞凋亡而损伤神经功能,因而S100B蛋白水平的高低与急性脑缺血损伤的程度密切相关[16]。BDNF是在脑内合成的一种内源性脑神经营养因子,主要在中枢神经系统内表达,对神经元的分化和生长再生具有维持和促进作用。ACI发病后,在神经元损伤的早期,BDNF释放量会显著增加,以保护神经功能[17];但后期,当神经元损伤因素持续大量存在时,会过度消耗BDNF,同时还能使BDNF合成减少,导致生物体内BDNF水平降低。故提高BDNF水平对减轻脑缺血损伤后期神经元损伤,降低神经细胞凋亡有着重要作用。
中医学认为ACI属于“中风病”范畴,其病机主要为气血不足、血瘀阻络,多因气滞血行不畅或气虚运血无力,导致脑络痹阻而引发该病,因此益气活血、行气祛瘀通络是治疗该病的基本原则[18]。益气活血通络方以黄芪、党参为君药,益气固表、补气升阳;配以当归、丹参、川芎,活血化瘀、行气止痛、祛风通络;加赤芍、红花、桃仁、地龙,以破血逐瘀、清热凉血、通经活络;配甘草以补脾益气、缓急解毒、调和诸药,达到益气活血、化瘀通络的功效。现代药理学研究表明[19-20],丹参可改善血流动力学指标,且具有抗炎作用,能减轻炎症因子对脑神经细胞的损伤,并促进组织修复再生,从而恢复神经功能;川芎能抑制血小板聚集,增强纤溶系统活性,产生抗血栓作用,还能扩张血管、改善微循环、抑制神经细胞炎症反应,降低血管内皮细胞和神经细胞凋亡,促使中枢神经营养因子表达,保护缺血损伤的神经细胞;当归、红花能抗血小板聚集,并扩血管改善微循环,保护脑神经元;赤芍能缓解脑缺血后引起的脑组织损伤;桃仁可抗血栓形成;地龙中含有纤维蛋白酶和纤维蛋白原激活酶,具有一定的溶栓作用。
本研究发现,手术组和假手术组大鼠的各项指标相比较,无显著差异。与对照组比较,模型组IL-8、TNF-α水平显著升高;与模型组比较,西药组和联合组IL-8、TNF-α水平显著降低;与西药组对比,联合组各指标显著降低。与对照组比较,模型组SOD水平显著降低、MDA水平显著升高;与模型组比较,西药组和联合组SOD水平均显著升高、MDA水平均显著降低;与西药组比较,联合组SOD水平显著升高、MDA水平显著降低。与对照组比较,模型组BDNF水平显著降低、S100B水平显著升高;与模型组比较,西药组和联合组BDNF水平均显著升高、S100B水平均显著降低;与西药组比较,联合组BDNF水平显著升高、S100B水平显著降低。结果表明益气活血通络方能有效减轻炎症,降低氧化应激反应,促进神经功能恢复,保护脑组织。
综上所述,益气活血通络方可降低急性脑梗死模型大鼠IL-8、TNF-α等炎症因子水平,减轻炎性反应;能有效升高SOD水平并降低MDA水平,改善氧化应激反应;能缓解神经细胞凋亡,促进神经功能恢复,保护缺血损伤脑组织。

