胃弥漫大B细胞淋巴瘤合并小细胞肺癌的1例报道并文献复习
虞有超 沈继敏 时国朝 李庆云
多原发肿瘤是指同一患者同时或先后发生2种或2种以上的原发恶性肿瘤。弥漫大B细胞淋巴瘤是最常见的成人非霍奇金淋巴瘤(non-Hodgkin’s lymphoma,NHL)类型之一,40%的患者可有淋巴结外病灶,包括胃肠道、中枢神经系统、软组织以及肺部等脏器。淋巴瘤肺部浸润临床表现及影像学表现缺乏特异性,容易与肺部恶性肿瘤混淆。对于既往有淋巴瘤病史的患者,应鉴别淋巴瘤肺浸润、原发肺肿瘤及肺转移瘤。本文报道我院收治的胃弥漫大B细胞淋巴瘤合并小细胞肺癌1例并结合文献进行复习。
病例资料
患者,66岁男性,因“腹部不适2年,左肺阴影增大4月”于2018年10月我科住院。现病史:2017年7月因上腹部不适,胃镜示胃窦及胃大弯侧壁增厚伴溃疡形成,抑制胃酸治疗无效,后再次胃镜检查并行活检,病理证实弥漫大B细胞淋巴瘤,免疫组化:CK-,EMA-,LCA+,CD3-,CD20+,CD10-,Bcl-6-,Mum-1-,Ki67(70%), CD79a+,CylclinD1+,CD45+,Bcl-2-,EBER-。PET-CT全身评估提示胃底、体部胃壁弥漫增厚,代谢增高,左肺上叶结节(2.0×1.3 cm),代谢增高,两侧颈部及右肺门淋巴结显示,部分代谢增高。诊断为弥漫大B细胞淋巴瘤,肺部浸入可能。遂于2017年10月-2018年1月接受CR-CHOP方案[西达苯胺20mg biw(d1、d4、d8、d11)美罗华700mg d0+长春地辛4mg d1+多柔比星脂质体 60mg d1+环磷酰胺1500mg d1+泼尼松片 50mg bid d1~5]化疗4次。2017年12月PET-CT评估,初发胃部病灶消失,左肺上叶前段结节,大小1.8×1.1cm,代谢增高,继续随访。2018年6月27日复查胸部CT示左肺上叶主动脉弓前不规则软组织密度影(3.6×3.0cm),可见毛刺及分叶,增强后可轻度强化,未重视,2018年10月11日当地医院复查PET-CT示胃部未见代谢异常增高灶,左上肺团块影较前明显增大(4.1×5.1cm)及多发结节伴代谢增高,伴左侧胸腔积液。既往有高血压、左下肢静脉曲张手术史。无吸烟史、否认肿瘤家族史。入院查体:神清,精神可,全身浅表淋巴结未及明显肿大,两肺呼吸音清,未闻及明显干湿啰音。心脏、腹部、皮肤、四肢、神经系统查体阴性。诊治经过:患者入院后即行经皮肺穿刺活检,病理提示小细胞肺癌,免疫组化:AE1/AE3+,CK7(核旁点状+),CgA+,CD56+,Syn+,TTF-1+,P40-,P63-,ki67(约90%),CD20-,Bcl-6少数+,Bcl-2+,CD10+,C-myc-,MUM-1-,CD3-。肿瘤分期T2NXM0。2018年11月19日予EP方案化疗(依托泊苷 100mg D1-3+顺铂 150mg D1),EC方案(卡铂 400mg D1+依托泊苷 100mg D1-3)各一次,2019年1月8日评估病情稳定, 2019年2月14日再次EC方案化疗(方案同前),2019年3月15日评估进展,行锁骨上淋巴结穿刺活检病理提示低分化转移癌,倾向小细胞,调整为IP方案(伊立替康200mg D1+顺铂 140mg D1)。化疗后患者出现水样泻,对症好转后出院。2019年5月1日行第二次IP方案,治疗后患者出现高热、腹泻,三系下降,对症支持治疗后症状虽好转,后因全身状况仍较差,仅给予最佳支持治疗,同年5月29日死亡。
讨 论
多原发肿瘤是指同一患者同时或先后发生2种或2种以上的原发恶性肿瘤,可同一脏器或不同脏器。临床上,非霍奇金淋巴瘤合并其他原发肿瘤并不罕见,国内研究报道约有0.78%的淋巴瘤患者合并原发实体肿瘤[1]。不过,我国关于NHL合并肺部原发肿瘤的报道极少,检索1950年5月~2019年5月万方数据库及中国知网数据库,有3例肺原发恶性肿瘤合并NHL的病例报道。1例为72岁男性,既往有淋巴结弥漫大B淋巴细胞性淋巴瘤,R-CHOP方案治疗完全缓解后发现右下肺占位,手术后病理为肺低分化鳞癌,肺组织周围淋巴结病理为小淋巴细胞性淋巴瘤[2]。第2例为中年女性,鼻型非霍奇金淋巴瘤史,后肺部病灶病理明确为未分化癌,多次放化疗,随访17个月两种肿瘤均进展[2]。第3例为65岁男性发现右肺中叶不张,左肺上叶前段球形影伴右侧胸腔积液,气管镜见右肺下叶基底段开口凸起,病理活检为黏膜相关淋巴结组织边缘区B细胞淋巴瘤合并肺鳞癌[3]。可见淋巴瘤与其他原发恶性肿瘤可发生在同一部位,也可发生在不同部位,使得疾病的诊断更为复杂。
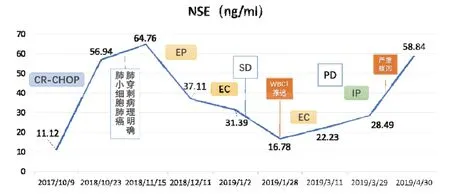
图1 肿瘤标志物(NSE)变化情况
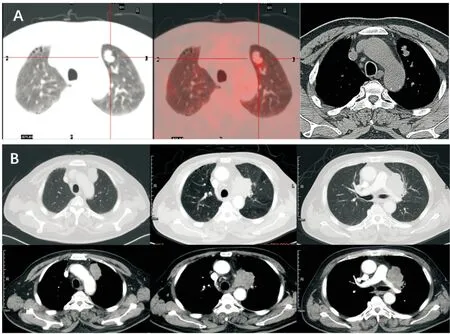
图2 (A)2017年9月4日PET-CT示左肺上叶结节(2.0×1 3cm),代谢增高。(B) 2019年3月13日胸部CT示左肺上叶团块影及左肺主动脉弓前方不规则软组织密度影
目前实体肿瘤与NHL之间关系暂无定论,但两者可能存在相关性。根据2005年Brennan多中心临床研究(13个中心,109000例NHL)发现NHL继发其他原发恶性肿瘤的发病率远高于正常人群,如唇癌、舌癌、鼻咽癌、胃癌、肠癌、肝癌、肺癌、软组织肿瘤、皮肤癌、膀胱癌、肾癌、甲状腺癌、霍奇金淋巴瘤以及白血病的标准化发病比(standardized incidence ratios,SIR)均有明显升高(P均<0.001),其中继发原发性肺恶性肿瘤的SIR为1.48(95%CI1.38~1.58)并呈逐步增加趋势(NHL发病1年内:SIR 1.26,1~5年:SIR 1.30, 5~9年: SIR 1.72,10年以上:SIR 1.78)[4]。然而,针对NHL亚型与肺原发恶性肿瘤的病理类型之间的关联尚未明确,根据现有的国内外文献报道数量,弥漫大B细胞淋巴瘤合并肺鳞癌报道较多[1,5-9],其次为小细胞肺癌[9-10]、腺癌[9]、大细胞肺癌[7,9]。
关于淋巴瘤合并其他原发恶性肿瘤的危险因素及发病机制尚不明确,目前临床观察研究发现其可能与吸烟、年龄、淋巴瘤的化学治疗、自体干细胞移植相关[4,11-12]。EORTC临床对照研究发现NHL使用CHOP方案治疗后继发实体恶性肿瘤的比例与年龄相关,如肺恶性肿瘤总体SIR 0.8(95%CI0.3~1.7),而其中小于45岁的NHL患者继发肺原发恶性肿瘤的SIR为15.4(95%CI4.2~39.4),大于45岁的患者SIR为0.3(95%CI0.1~1.0)[11]。在GELA临床对照研究中,使用ACVBP(阿霉素+环磷酰胺+长春新碱+博来霉素+泼尼松)方案治疗后继发肺恶性肿瘤比例与性别相关,其中男性患者的肺癌发病风险升高(SIR 2.45, 95%CI1.48~3.83)[11],这可能与男性吸烟患者更多相关。自体干细胞移植后恶性肿瘤发病率增加近2倍(SIR 1.97, 95%CI1.49~2.60),但实体恶性肿瘤的发病率无明显升高(SIR 1.3, 95%CI0.9~1.8)[12]。本例患者男性、年龄大于45岁、无吸烟史、曾行RCHOP方案4次,其肺原发恶性肿瘤的发生可能与化疗治疗相关,但是否存在其他危险因素尚不明确。
多原发肿瘤的发生可能与种族、环境暴露(核辐射)、医疗因素(化疗、放疗等)及基因突变等相关[13-14]。目前已知的单基因突变与多原发肿瘤的有如下:PTEN、BRCA1/BRCA2、CDKN2A、MLH1、MSH2、MSH6、PMS2、APC、MUTYH、STK11、CDH1、P53、CHEK2、VHL、SDHB,C,D、Ret、RB1、NTHL1突变等[14-15]。在有肺腺癌的多原发肿瘤患者中,EGFR突变率更高,特别是19外显子[16]。但目前尚无淋巴瘤与肺恶性肿瘤的多原发肿瘤相关特异性基因突变报道,有待进一步研究。本例患者未行基因检测,是否存在肿瘤易感基因尚不清楚。
由于淋巴瘤合并肺原发恶性肿瘤病例罕见,目前国内外尚无同一推荐治疗方案。本例患者在2018年6月即发现肺部阴影增大,但未予重视,直至2018年10月才最终确诊小细胞肺癌,总生存期8月,低于目前小细胞肺癌的中位生存期。早期诊断能否够改善患者的预后、以及采取化疗联合放疗是否可行,均有待于进一步探讨。故此,建议可疑高危人群定期完善肺部CT检查,提高肺癌的检出率,早诊断早治疗,特别是早期肺癌接受手术治疗[2],或有望使多原发癌患者获益。
综上所述,淋巴瘤与肺原发恶性肿瘤在疾病的发生、发展过程中可能存在一定的相关性,虽然具体机制尚未完全阐明,不过文献提示与男性、吸烟、淋巴瘤化疗方案相关。需要广大临床医师提高认识,避免误诊和漏诊。

