lncRNA ADPGK-AS1通过调控miR-217表达对非小细胞肺癌细胞增殖和凋亡的影响
肖钦晓 程宏宁 颜洪顺 王春刚 陆小珠
肺癌是全球最常见的癌症,每年约有160万人死于肺癌,肺癌患者大约有85%的组织亚型是非小细胞肺癌(non-small cell lung cancer,NSCLC)[1]。NSCLC亚型患者通常存在不同的驱动基因突变,这些突变为NSCLC的精确亚分类和患者的靶向治疗和免疫治疗提供了新的方向和进展[2]。研究抑制NSCLC的分子机制,寻找潜在的个性化精准治疗靶点,已成为NSCLC基础研究领域的热点。
大量研究表明,长链非编码(long non-coding RNA,lncRNA)可以通过多种机制调控转录、翻译和蛋白质功能,在NSCLC的诊断和预后中是很有前途的生物标志物,可能是其治疗靶点,并与癌细胞的耐药性和转移等有关[3-5]。研究表明,lncRNA ADP依赖的葡萄糖激酶反义RNA 1(ADP dependent glucokinase antisense RNA 1,ADPGK-AS1)在乳腺癌[6]、胃癌[7]、胰腺癌[8]组织和细胞中表达上调,与癌细胞的增殖、迁移和凋亡等有关,但其在NSCLC中的作用尚不清楚。本研究通过LncBase预测发现,miR-217可能是ADPGK-AS1的靶基因。miR-217在肺癌组织中低表达,过表达miR-217抑制肺癌细胞的增殖、迁移和侵袭,诱导细胞凋亡[9]。miR-217和lncRNA ADPGK-AS1在NSCLC中是否存在某种调控关系,尚不清楚。本课题以NSCLC A549细胞为主要研究对象,研究lncRNA ADPGK-AS1和miR-217对A549增殖、凋亡的影响及潜在分子机制。
资料与方法
一、材料
选取2016年2月至2019年3月于本院病理检查确诊为NSCLC的患者,取患者病理诊断的肿瘤组织和癌旁组织116例,男77例,女39例,年龄范围28~79(53.02±14.53)岁,鳞癌41例,腺癌54例,其他21例。NSCLC诊断标准参照《NCCN临床实践指南:非小细胞肺癌》。
人非小细胞肺癌细胞株A549(购自ATCC);胎牛血清(fetal bovine serum,FBS)(购自美国Hyclone公司),F12K培养基、胰蛋白酶、噻唑蓝(Thiazolyl Blue Tetrazolium Bromide,MTT)和二甲基亚砜(Dimethyl sulfoxide,DMSO)(购自美国Sigma-Aldrich公司);TRIzol试剂、Real-time PCR 试剂盒、反转录试剂盒(RT-PCR)(购自宝生物工程(大连)有限公司);Lipofectamine 2000转染试剂盒(购自美国Invitrogen公司);双荧光素酶报告系统(Dual-Luciferase Reporter Assay System)(购自美国Promega公司);Annexin V-FITC细胞凋亡检测试剂盒(购自上海碧云天生物科技有限公司);lncRNA ADPGK-AS1 抑制剂(si-ADPGK-AS1)、lncRNA ADPGK-AS1过表达载体(pcDNA-ADPGK-AS1)、miR-217模拟物(miR-217)、miR-217干扰剂(anti-miR-217)、阴性对照(si-NC、miR-NC、pcDNA、anti-miR-NC)、ADPGK-AS1野生型和突变型双荧光素酶报告载体均购自上海吉玛制药技术有限公司;CyclinD1抗体、p21抗体、Bax抗体、Bcl-2抗体和GAPDH抗体(购自美国Santa cruze公司);流式细胞仪(购自美国BD公司),Real-time PCR仪(购自美国Bio-Rad公司)。
二、 方法
1 细胞培养 配制含10 % FBS的F12K培养液,将A549细胞培养在添加1%青-链霉素的F12K培养液中,置于37 ℃ 5% CO2培养箱中培养,湿度95%。待细胞生长至对数生长期时,洗涤消化,1 ∶3传代。
2 Real-time PCR检测lncRNA ADPGK-AS1和miR-217的表达 收集NSCLC组织、癌旁组织样本及各组转染后的A549细胞,提取组织样本和细胞总RNA,然后反转录合成cDNA,然后以cDNA为模板进行Real-time PCR反应合成lncRNA ADPGK-AS1和miR-217。引 物 如 下:miR-217 上 游: 5′-CGCTCTACTGCATCAGGAACTGA-3′,下游: 5′-GTGCAGGGTCCGAGGT-3′;ADPGK-AS1上游:5′-GCCGATGTCGACACAAGCG-3′,下游: 5′-AGCAAATGTGTTCCCATCCCT-3′。用2-ΔΔCt方法进行数据分析。
3 细胞转染 将对数生长期的A549细胞以2×105个细胞//孔接种于6孔板中,细胞培养至融合为一层时进行转染。用Lipofectamine 2000转染试剂盒将各组细胞转染入培养好的A549细胞中,培养6h,换成完全培养基,转染48h,收集转染的A549细胞,检测细胞中miR-217和lncRNA ADPGK-AS1的含量,验证转染效果。转染分组:双荧光素酶报告系统组:分别转染miR-NC+WT-ADPGK-AS1,miR-217+WT-ADPGK-AS1,miR-NC+MUT-ADPGK-AS1,miR-217+MUT-ADPGK-AS1;lncRNA ADPGK-AS1过表达组:转染pcDNA-ADPGK-AS1,以转染pcDNA为对照;lncRNA ADPGK-AS1抑制组:转染si-ADPGK-AS1,以转染si-NC为对照;miR-217过表达组:转染miR-217,以转染miR-NC为对照;lncRNA ADPGK-AS1和miR-217双抑制组:转染si-ADPGK-AS1+anti-miR-217,以转染si-ADPGK-AS1+anti-miR-NC为对照。
4 双荧光素酶报告系统实验 通过LncBase Predicted v.2预测lncRNA ADPGK-AS1与miR-217的结合位点,构建含结合位点的lncRNA ADPGK-AS1的野生型(WT-ADPGK-AS1)和突变型(MUT-ADPGK-AS1)双荧光素酶报告载体。根据1.2.3进行A549细胞的培养和转染,将构建的双荧光素酶报告载体分别与miR-NC或miR-217共转染A549细胞,转染48h,收集细胞,裂解细胞,离心收集上清,以海肾荧光素酶活性为内参照,检测上清中相对萤火虫荧光素酶活性。
5 MTT实验测定细胞活性 收集转染后的A549细胞,以2×103个细胞/孔接种于96微孔板中,置培养箱继续培养,分别在24h、48h、72h时进行 MTT 实验,每孔加入 20 μL(5 mg/mL)MTT,培养4h,弃上清,加入DMSO150 μL /孔,室温振荡10 min,酶标仪测定490 nm吸光度值。
6 流式细胞术检测细胞凋亡率 将转染后的A549细胞接种于6孔板中,继续培养48h,收集细胞至离心管中,洗涤并进行胰酶消化,然后离心弃上清,加入195μLAnnexin V-FITC结合液重悬细胞,然后加入5μL Annexin V-FITC和 10μL碘化丙啶(propidium iodide,PI),混匀后室温避光20 min,上流式细胞仪检测凋亡率。
7 Western blot检测Cyclin D1、p21、Bcl-2和Bax蛋白表达 收集lncRNA ADPGK-AS1抑制组、miR-217过表达组和lncRNA ADPGK-AS1和miR-217双抑制组培养48h的A549细胞,破碎细胞,收集细胞总蛋白,进行SDS-PAGE,然后转PVDF膜,将膜在室温条件下封闭2h,洗涤2次,加入稀释的一抗(Cyclin D1抗体 1 ∶2000,p21 抗体1 ∶2000,Bcl-2抗体 1 ∶1000,Bax抗体1 ∶1000),4℃过夜孵育,洗膜后加入稀释的酶标二抗,室温孵育1h,显影,拍照,以GAPDH为内参,检测蛋白灰度。
三、统计学处理
结 果
一、lncRNA ADPGK-AS1和miR-217在非小细胞肺癌组织中的表达
与癌旁组织相比,在116例非小细胞肺癌组织中lncRNA ADPGK-AS1的含量显著升高(P<0.05),miR-217的含量显著下降(P<0.05)(见表1)。

表1 lncRNA ADPGK-AS1和miR-217在非小细胞肺癌组织中的表达
注:与癌旁组织组比较,*P<0.05
二、lncRNA ADPGK-AS1靶向调控miR-217的表达
LncBase Predicted v.2预测发现,lncRNA ADPGK-AS1的序列中含有与miR-217互补的位点,见图4。双荧光素酶报告实验结果显示,过表达miR-217组野生型WT-ADPGK-AS1的萤火虫荧光素酶相对活性与miR-NC对照组显著下降(P<0.05),而突变型MUT-ADPGK-AS1的荧光素酶相对活性无明显变化(见表2)。qRT-PCR结果发现,过表达ADPGK-AS1可显著下调miR-217 含量(P<0.05);干扰ADPGK-AS1表达显著上调miR-217表达量(P<0.05)(见表3)。说明lncRNA ADPGK-AS1靶向负调控miR-217的表达。

图1 ADPGK-AS1的序列中含有与miR-217互补的核苷酸序列

表2 双荧光素酶报告实验
注:与miR-NC组比较,*P<0.05
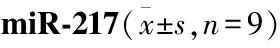
表3 lncRNA ADPGK-AS1调控
注:与pcDNA组比较,*P<0.05;与si-NC组比较,#P<0.05
三、抑制lncRNA ADPGK-AS1表达对非小细胞肺癌A549细胞增殖和凋亡的影响
抑制ADPGK-AS1表达后A549细胞中lncRNA ADPGK-AS1含量显著下降,细胞OD490 nm在24h、48h和72h均显著下降,细胞凋亡率升高,CyclinD1和Bcl-2表达降低,p21和Bax蛋白表达升高,均具有统计学意义(P<0.05)见(图2、表4)。说明抑制ADPGK-AS1表达可以抑制非小细胞肺癌A549细胞增殖并促进细胞凋亡。
四、miR-217过表达对非小细胞肺癌A549细胞增殖和凋亡的影响
miR-217过表达后,A549细胞OD490 nm在24h、48h和72h均显著下降,细胞凋亡率升高,CyclinD1和Bcl-2表达降低,p21和Bax蛋白表达升高,均具有统计学意义(P<0.05)见(图3、表5)。说明过表达miR-217可抑制A549增殖并诱导细胞凋亡。

图2 抑制lncRNA ADPGK-AS1表达对非小细胞肺癌A549细胞增殖和凋亡的影响A:增殖和凋亡相关蛋白表达;B:细胞凋亡流式图
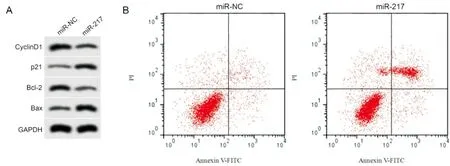
图3 miR-217过表达对非小细胞肺癌A549细胞增殖和凋亡的影响A:增殖和凋亡相关蛋白表达;B:细胞凋亡流式图

表4 抑制lncRNA ADPGK-AS1表达对非小细胞肺癌A549细胞增殖和凋亡的影响
注:与si-NC组比较,*P<0.05
五、干扰miR-217表达逆转了抑制lncRNA ADPGK-AS1表达对非小细胞肺癌A549细胞增殖和凋亡的作用
为确认lncRNA ADPGK-AS1通过调控miR-217发挥对A549细胞的增殖和凋亡的影响作用,在抑制lncRNA ADPGK-AS1的同时干扰miR-217转录。结果表明,抑制ADPGK-AS1同时干扰miR-217转录后A549细胞中miR-217 水平下降,细胞在24h、48h和72h时细胞OD490nm显著升高,细胞凋亡率降低,CyclinD1和Bcl-2含量升高,p21和Bax含量降低,差异均具有统计学意义(均P<0.05),见(图4和表6)。说明干扰miR-217表达逆转了抑制lncRNA ADPGK-AS1对A549细胞增殖、凋亡的作用。
讨 论
肺癌是世界第一大癌症,患者的5年生存率根据阶段和地区的不同从4-17%不等,因为肺癌的亚型不同,靶向治疗也越来越多的应用于患者的个性化治疗中[10]。大量研究表明,已经确定的NSCLC危险因素可能影响lncRNA在NSCLC组织和细胞系中的表达水平,从而影响NSCLC的发生、发展等恶性表型[11]。LncRNA ADPGK-AS1又称ADP依赖的葡萄糖激酶反义RNA 1,其在多种肿瘤组织和细胞中过表达[6-8],下调其表达可抑制癌细胞的增殖和迁移,并促进细胞凋亡。最新研究表明,lncRNA ADPGK-AS1在骨肉瘤(OS)组织和细胞中也高表达,抑制其表达可靶向miR-542-3p减少OS细胞的增殖、迁移和侵袭,抑制细胞凋亡[12]。LncRNA ADPGK-AS1在NSCLC中表达和作用尚不清楚。本研究通过检测116例NSCLC组织和癌旁组织发现,与癌旁组织相比,在NSCLC组织中ADPGK-AS1的含量显著升高。本研究通过LncBase预测发现,ADPGK-AS1的序列中含有与miR-217互补的核苷酸序列,预示ADPGK-AS1与miR-217之间可能存在结合位点。双荧光素酶报告系统结果表明ADPGK-AS1靶向miR-217,qRT-PCR结果表明,ADPGK-AS1负调控miR-217的转录,两者的含量呈负相关。在A549细胞中抑制ADPGK-AS1表达可以降低细胞OD值、周期蛋白CyclinD1和抗凋亡蛋白Bcl-2含量,提高细胞凋亡率、周期蛋白p21和促凋亡蛋白Bax含量,抑制NSCLC A549细胞增殖,诱导A549细胞凋亡,说明lncRNA ADPGK-AS1在NSCLC细胞增殖和凋亡中发挥重要作用。

图4 干扰miR-217逆转了抑制lncRNA ADPGK-AS1表达对非小细胞肺癌A549细胞增殖和凋亡的作用A:增殖、凋亡相关蛋白表达;B:细胞凋亡流式图

表5 miR-217过表达对非小细胞肺癌A549细胞增殖和凋亡的影响
注:与miR-NC组比较,*P<0.05

表6 干扰miR-217逆转了抑制lncRNA ADPGK-AS1表达对非小细胞肺癌A549细胞增殖和凋亡的作用
注:与si-NC组比较,*P<0.05;与si-ADPGK-AS1+anti-miR-NC组比较,#P<0.05
miR-217在急性髓系白血病(AML)[13]、肾癌[14]、甲状腺癌[15]、肝细胞癌[16]等肿瘤中表达显著下调,参与调控肿瘤细胞的增殖、凋亡、侵袭迁移等生物学过程,也参与慢性心力衰竭(CHF)[17]的调控过程。miR-217在NSCLC细胞株中表达下调,是lncRNA HOTAIR的靶基因,miR-217的过度表达可明显抑制H1299和A549细胞的增殖、迁移和侵袭[18]。还有研究发现,miR-217在肺腺癌(LUAD)组织和细胞中表达下调,通过LINC01614/miR-217/FOXP1信号通路参与LUAD的发生和发展[19],miR-217也与肺癌对顺铂的耐药性有关[9]。本研究结果表明,miR-217在NSCLC组织中含量下降,过表达miR-217可降低NSCLC细胞A549的增殖OD值、CyclinD1和Bcl-2蛋白含量,提高细胞凋亡率、p21和Bax蛋白含量,与前述研究结论[18]基本一致。
同时抑制两者转录的研究发现,干扰miR-217表达逆转了抑制lncRNA ADPGK-AS1对A549细胞增殖、凋亡的作用,验证了两者在NSCLC细胞A549中具有调控关系。
综上,本研究阐述了在NSCLC组织中,lncRNA ADPGK-AS1上调,miR-217下调;lncRNA ADPGK-AS1在NSCLC细胞A549中靶向miR-217调控A549细胞增殖和凋亡,lncRNA ADPGK-AS1和miR-217可能是NSCLC的潜在分子靶点,对NSCLC的临床靶向治疗提供了新的思路。

