人WDR70 蛋白结构与功能的生物信息学预测
陈 慧,陈玉梅,周 怡,谢雨彤,杨 潮
(赣南师范大学生命科学学院,江西,赣州 341000)
WD 基序最早被发现存在于G 蛋白的β 亚基中,通常以glycine-histidine(GH)开始而以 tryptophan- asparticacid (WD)结束,GH 和WD 之间由大约 40个保守的氨基酸核心序列组成,其主要功能是形成多个蛋白复合物可逆装配的平台[1-3]。WD 重复蛋白(WD repeat protein)家族是一类蛋白结构域中存在有多个WD 基序的蛋白家族。该家族成员广泛存在于真核细胞中,不仅在信号转导、转录调控和细胞凋亡等生物学过程中发挥重要作用,还与癌症、神经变性病等多种疾病的发生发展密切相关[4-5]。WDR70 隶属于WD 重复蛋白家族,它是一个进化高度保守的基因,参与调控基因的同源重组过程,对基因组和染色体稳定性的维护有重要贡献[6]。在cullin-4-DDB1 Ring 型E3 泛素连接酶复合体的组装中WDR70 蛋白发挥了重要作用,可通过促进组蛋白H2B 的单泛素化来实现对DNA 损伤的修复。WDR70 基因的沉默或WDR70 突变型的过度表达都会破坏同源重组功能蛋白RPA32 的磷酸化水平和重组酶RAD51 在DNA 损伤部位的募集能力,而WDR70 功能的丧失也会导致中期染色体断裂的升高[7]。同时,WDR70 被发现与癌症关系密切,唐子执等发现WDR70 在卵巢癌临床样本中出现多种突变,这些突变可能导致WDR70 转录本稳定性降低,翻译移位或提前终止,都会最终导致WDR70 蛋白功能丧失[8]。
本研究利用多种生物信息学软件对WDR70 蛋白结构与功能进行分析和预测,以人类和其他物种的WDR70 同源蛋白数据作为分析对象,获得了人WDR70 基因特征及蛋白理化性质、二级结构、三级结构和互作网络等信息。同时,比对了不同物种来源的WDR70 蛋白氨基酸序列并构建了系统发育树,为后续开展该蛋白生物学功能的研究提供信息数据支撑。
1 材料与方法
1.1 实验材料
在NCBI 网站上获取不同物种WDR70 蛋白的氨基酸序列(如表1)。

表1 不同物种的WDR70 蛋白信息 Table 1 The information of WDR70 protein from different species
1.2 实验方法
本研究采用了多种生物信息学软件,具体软件和功能如下:ProtParam tool 用于计算WDR70 蛋白各种氨基酸的组成和理化性质分析;TMHMM Server2.0 和 SignalP 4.1 用于分析人WDR70 蛋白是否含有跨膜区域和信号肽;Gene Cards 用于预测人WDR70 蛋白的亚细胞定位情况;MEGA5.0 软件用于分析不同物种来源的WDR70 蛋白之间的进化关系;DNAStar 软件用于不同物种来源的蛋白质多重序列比对;SOPMA 和PSIPRED Server 4.0 软件用于预测人 WDR70 蛋白进行二级结构;SWISS-MODEL 和RasMol 软件用于人WDR70 蛋白进行同源建模和三级结构数据的分析。
2 结果与分析
2.1 WDR70 基因特征
人 WD 重复包含蛋白 70 (WD repeat- containing protein 70)基因位于人类5 号染色体短臂2 区13 带,Gene ID 号为55100,该基因跨越373413 bp,包含有18 个外显子。人WDR70 基因转录产物长度为2169 bp,编码了654 个氨基酸残基,分子量约为 73 kD。
2.2 WDR70 蛋白的理化性质
为了探究人WDR70 蛋白的物理和化学特性, ProtParam tool 软件被用于分析人WDR70 蛋白,结果发现该蛋白由654 个氨基酸残基构成,分子式为C3178H5021N907O1017S31,包含10154 个原子,相对分子量为 73.2016 kD(表2)。在氨基酸组成中,有20 种氨基酸参与了该蛋白的编码,其中丝氨酸的含量最高,所占比例达到了8.6%。同时从表2 中可以看出,人WDR70 蛋白的等电点pI 为5.94;不稳定参数为47.89,数值高于40;蛋白半衰期约为30 h,因而推测人WDR70 为酸性不稳定蛋白质[9]。对WDR70 蛋白的疏水性分析发现,其疏水性平均系数(grand average of hydropathicity,GRAVY)为-0.769,数值小于0,推测人WDR70 为亲水蛋白[10]。同时,ProtScale 软件分析结果发现WDR70 蛋白氨基酸序列中亲水性氨基酸所占比例达到了77.83%,而疏水性氨基酸约占21.56%,其中第157-160 位氨基酸的分值最低为-3.5,第246 位氨基酸的分值最高为1.756,这样的结果表明WDR70 为亲水性蛋白质,与ProtParam tool 软件分析结果一致 (图1)。
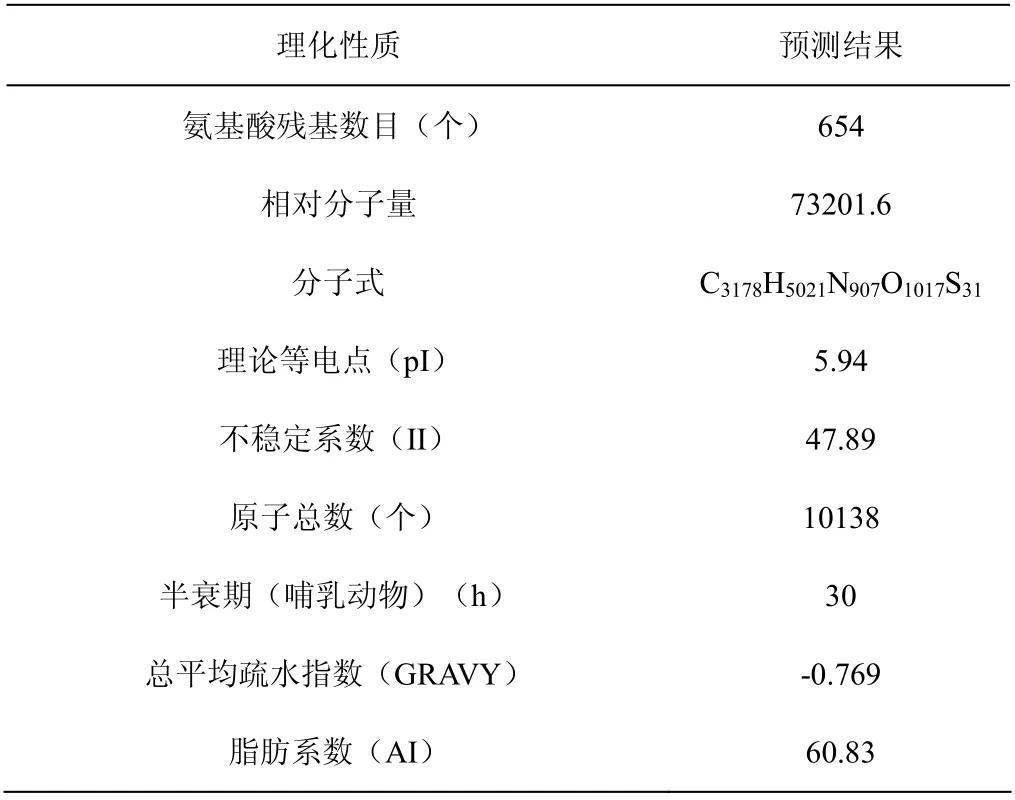
表2 人WDR70 蛋白理化性质分析表 Table 2 The physical and chemical properties of human WDR70 protein

图1 WDR70 蛋白亲水性和疏水性分析 Fig.1 The hydrophilicity/hydrophobicity analysis of human WDR70 protein
2.3 WDR70 蛋白亚细胞定位
为了考察跨膜区域和信号肽是否存在于人WDR70蛋白中,我们采用了TMHMM和SignalP 4.1 软件对人 WDR70 蛋白进行了预测和分析。TMHMM 软件预测结果发现人WDR70 蛋白不包含跨膜区域,预示着人WDR70 蛋白不是跨膜蛋白(如图2)。

图2 WDR70 蛋白跨膜区预测 Fig.2 The prediction of WDR70 protein transmembrane structure
同时,SignalP4.1 软件对人WDR70 蛋白进行分析,结果发现所有氨基酸的C 值、S 值、Y 值均远低于平均值0.5, mean S score 小于0.5 被认为是非分泌性蛋白质,因而推断WDR70 蛋白不具有信号肽,为非分泌性蛋白(图3)。
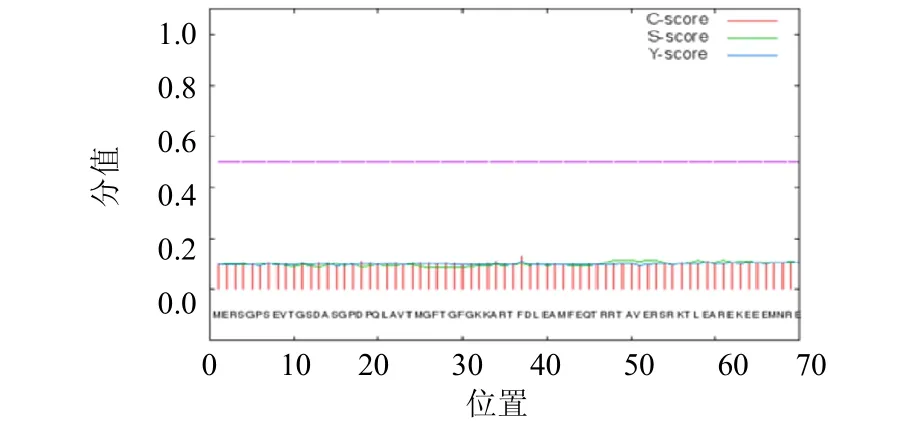
图3 WDR70 蛋白信号肽分析 Fig.3 The prediction of signal peptide in WDR70 protein
Gene Cards 的分析结果显示,人WDR70 蛋白主要定位于细胞核中,在细胞质和线粒体中存在有少量分布。这也印证了人WDR70 蛋白为非分泌蛋白,说明它是一种在细胞内行使功能作用的蛋白(图4)。
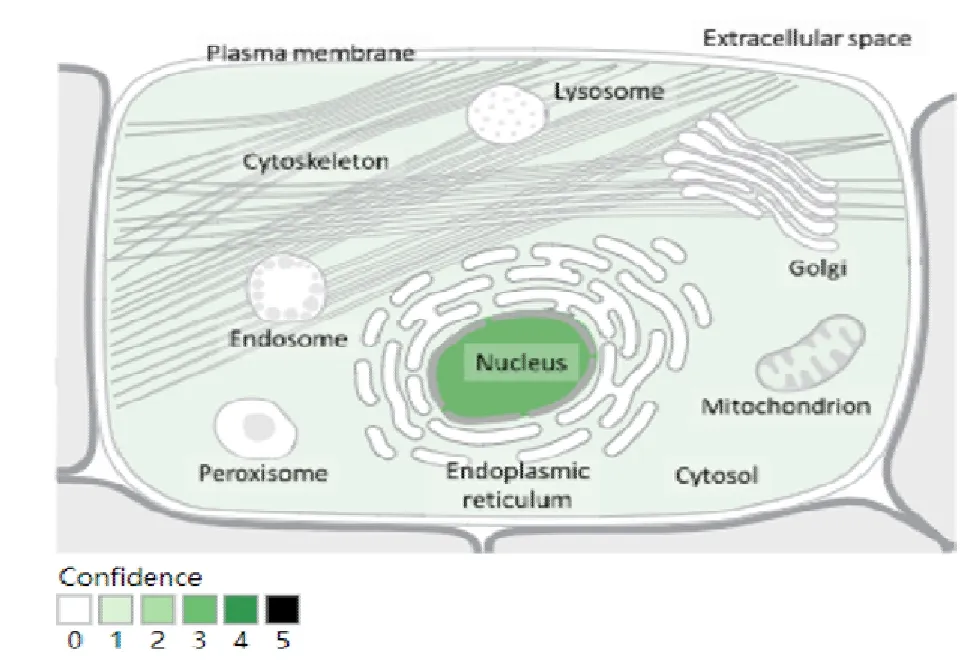
图4 人WDR70 蛋白亚细胞定位 Fig.4 The subcellular localization of human WDR70
2.4 WDR70 蛋白的多重序列比对与系统发育树的构建
为了构建不同物种之间的WDR70 蛋白的系统发育树,我们在NCBI 网站上检索获得了人、黑猩猩、白枕白眉猴和食蟹猕猴等物种的WDR70 蛋白氨基酸序列,利用DNA-Star 软件进行序列比对后发现这些氨基酸序列存在高度的同源性,其中部分氨基酸序列完全重叠(图5)。序列比对的结果显示,人WDR70 与黑猩猩、白枕白眉猴、食蟹猕猴的WDR70 氨基酸序列相似性高达98.78%,表明不同物种来源的WDR70蛋白具有高度的保守性 (图5)。图6 所示的MEGA 软件构建的Neighbor-Joining (NJ)系统发育树,表明人WDR70 与黑猩猩WDR70 蛋白同属于一个分支类群,而其他物种的WDR70 蛋白则形成另外的分支,且与物种之间的亲缘关系和进化关系基本一致(图6)。

图5 人、黑猩猩、白枕白眉猴、食蟹猕猴WDR70 蛋白序列比对结果 Fig.5 The alignment result of the WDR70 sequences from human, Pan troglodytes, Cercocebus atys and Macaca fascicularis.

图6 WDR70 蛋白序列分析进化树 Fig.6 Phylogenetic tree of the A1AT proteins from different spices
2.5 WDR70 的二级结构预测
SOPMA 软件分析结果发现WDR70 蛋白中 a-螺旋、β-折叠和无规则卷曲分别占17.76%、29.71%和53.53%; PSIPRED Server 4.0 软件对WDR70 蛋白分析显示,α-螺旋、β-折叠和无规则卷曲是其主要的结构形式,分别所占比例为12.8%、18.0%和69.2%。两种软件的预测结果显示无规则卷曲是人WDR70 蛋白主要的二级结构(图7 和图8)。
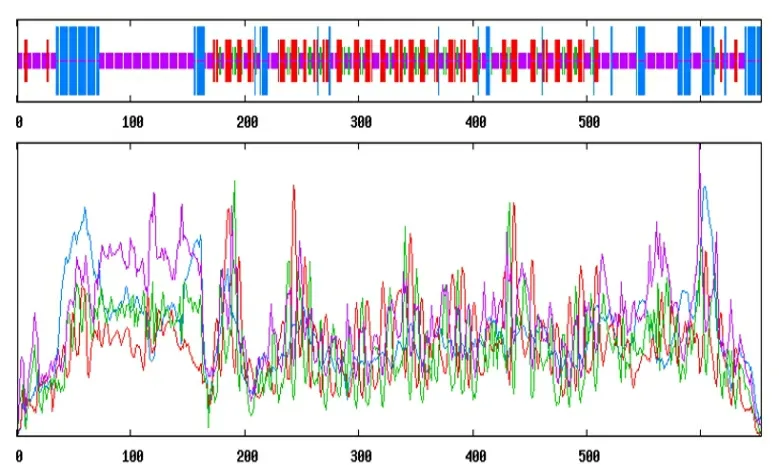
图7 SOPMA 软件预测WDR70 蛋白二级结构 Fig.7 The prediction of WDR70 secondary structure by SOPMA software

图8 PSIPRED 软件预测WDR70 蛋白二级结构 Fig.8 The prediction of WDR70 secondary structure by PSIPRED software
2.6 WDR70 的三级结构建模
对蛋白质的三级结构的了解将有助于更好地理解生物体中蛋白的理化特性,以及其相关联的化学反应途径及其机制,对于生物世界的认识和药物的研发都起着关键作用。我们采用SWISS-MODEL同源建模方式得到人WDR70 蛋白的三维预测模型(如图9), RasMol 软件对三维预测模型分析发现该蛋白三级结构的主要形式是无规则卷曲,这一结果与二级结构预测结果一致,表明模拟构建的WDR70 蛋白三维结构合理。

图9 WDR70 蛋白的三维结构 Fig.9 The 3D structure of WDR70 protein
2.7 与人WDR70 相互作用的蛋白预测及分析
人WDR70 蛋白包含有多个高度保守的WD 基序,其主要功能是形成多个蛋白复合物可逆装配的平台,预示着WDR70 可通过与其他蛋白分子相互作用行使功能。为了更好明确WDR70 蛋白互作网络,我们利用String 数据库对人WDR70 蛋白进行预测,发现在WDR70 相互作用网络中包括转运蛋白 ABCA3、EIF4ENIF1;细胞迁移相关蛋白C5orf42;核孔复合物蛋白NUP155;钠离子依赖性高亲和力氨基酸转运蛋白SLC1A3、SLC2A13;泛素蛋白连接酶PFPF19;促进皮层神经元迁移蛋白NIPBL;与大脑和感觉器官发育相关蛋白OTX1 等(图10)。
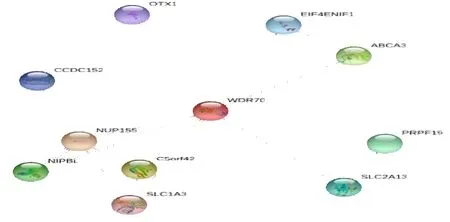
图10 人 WDR70 蛋白相互作用网络 Fig.10 Human WDR70 protein interaction network
3 讨论
同源重组修复是一种无错误的DNA 分子重新组合的方式,对基因组稳定性和完整性的维持具有重要意义。同源重组修复发生错误或异常能够导致个体发育异常和癌症等多种疾病[9-11]。组蛋白H2B 的泛素化能够使染色质更为松散,有利于转录复合物进入DNA 的启动子和编码区域,对同源重组修复起到重要作用[12-13]。WDR70 是WD 蛋白家族的一个重要成员,能够通过促进组蛋白H2B 的单泛素化作用,实现DNA 双链断裂的同源重组修复。此外,WDR70 基因还被发现对胚胎期小鼠脑部的发育有重要的影响[14]。目前,关于WDR70 的功能和机制研究较少,因而本研究利用生物信息学软件分析WDR70 蛋白,为今后的研究工作提供新思路和新线索。
通过多种软件对WDR70 蛋白的氨基酸序列的分析,我们发现该蛋白由654 个氨基酸残基构成,相对分子量约为73 kD,等电点为5.94,半衰期为30 h,无信号肽和跨膜区域,为酸性不稳定蛋白质。为了确立物种之间的亲缘关系,我们比对了不同物种的WDR70 蛋白质序列,发现该蛋白的氨基酸序列是在进化过程中高度保守的,应该归类于直系同源蛋白质(orthologous protein)[15]。这表明不同物种之间的WDR70 蛋白均拥有共同祖先的蛋白,并且具有共同或者相类似的生物学功能。对蛋白质的二级结构预测发现WDR70 蛋白主要的结构形式是无规则卷曲。SWISS-MODEL 和RasMol 软件对人WDR70 蛋白三维结构的预测和分析,发现该蛋白三级结构与二级结构预测结果是一致的。
在蛋白质相互作用网络中,与WDR70 互作的蛋白有包括转运蛋白ABCA3、EIF4ENIF1;细胞迁移相关蛋白C5orf42;核孔复合物蛋白NUP155;钠离子依赖性高亲和力氨基酸转运蛋白SLC1A3、SLC2A13;泛素蛋白连接酶PFPF19;促进皮层神经元迁移蛋白NIPBL;与大脑和感觉器官发育相关蛋白OTX1 等。这些表明WDR70 蛋白功能为一种结合蛋白质,可能在蛋白的泛素化和转运过程中发挥重要的生物学功能。总之,本研究可为今后更进一步揭示WDR70 蛋白的结构与功能,为进一步研究WDR70 蛋白功能和其他蛋白的相互关系提供信息数据支撑和新线索。

