生鲜乳中β-内酰胺酶检验方法的优化
杨小平,郦娟,何荣,曾慧君,杨永
(武汉食品化妆品检验所,武汉430012)
0 引 言
β-内酰胺酶为细菌代谢产生的一种蛋白,能裂解青霉素和头孢类抗生素的β-内酰胺环,从而使抗生素失活[1-2]。β-内酰胺酶的分类有两种方法:布氏法和Ambler的分子分类法[3-5]。近些年,部分不法生产者将其作为生鲜牛乳抗生素分解剂使用[6],使牛乳达到乳品检验合格标准[7]。生鲜乳中β-内酰胺酶来源于两个方面:外源性非法添加;内源性诱导因素,牛体内或牛乳中产β-内酰胺酶的微生物造成牛乳中β-内酰胺酶的残留[8]。
目前关于β-内酰胺酶的检测方法有头孢硝基噻吩显色法、酸度法、碘量法、高效液相色谱法、依赖基质辅助激光解吸/电离傅立叶变换质谱(MALDI-FTMS)法、酶联免疫法和微生物杯碟法[9-11]。食品整治办〔2009〕29 号文(后称29 号文)中规定了乳及乳制品中β-内酰胺酶的检测方法为杯蝶法。杯碟法的灵敏度高、结果判定简单,基本可以满足乳及乳制品中β-内酰胺酶检测的需求,但在实际检验中发现多方面的问题,如不同厂家的β-内酰胺酶标准品,所用酶活性单位不一致,试验中青霉素G、舒巴坦、β-内酰胺酶最适使用浓度的选择与搭配[12];生鲜乳中内源性残留β-内酰胺酶与产β-内酰胺酶菌株之间的关系等[13],这些问题已经有相关的报道。在日常杯蝶法检验中,我们还发现了其他的问题,如:抑菌圈形状不规则,边缘模糊,导致抑菌圈直径偏差大,影响结果判断;29 号文中规定的菌液浓度不易控制;牛津杯内样液易泄露造成试验失败;阴性对照试验不成立,试验失败率高等问题。对此,我们在日常检验的经验积累中对29 号文的方法进行了部分改进与优化,为我国制定更加合理、科学的β-内酰胺酶检测标准提供参考。
1 材料与方法
1.1 材料与设备
藤黄微球菌经复苏后活化三代左右,直接划线接种于营养琼脂斜面上,可按工作需求接种多支斜面,作为工作菌株存放于4 ℃冰箱,一般可存放一个月;营养琼脂,平板计数琼脂,抗生素检测用培养基Ⅱ,购自北京陆桥技术股份有限公司;舒巴坦标准品,德国Dr.Ehrenstorfer;青霉素 G 钠盐,德国 Dr.Ehrenstorfer;β-内酰胺酶,购自东京化学工业公司(TCI)。
恒温培养箱,上海新苗医疗器械制造有限公司;游标卡尺,上海田岛工具有限公司;灭菌锅,松下电器(中国)有限公司;高速离心机,长沙平凡仪器仪表有限公司;牛津杯,新乡市新华检测仪器厂;0.45 μm 无菌过滤器,密理博。
1.2 试验方法与优化
1.2.1 菌悬液的制备
试验前一天取4 ℃保存的藤黄微球菌斜面一支,划线接种于营养琼脂平板,36 ℃培养16~24 h 后,将平板上的藤黄微球菌刮入5 mL 无菌EP 管内,用2 mL无菌生理盐水悬浮菌株制成菌悬液,用无菌生理盐水进行适当稀释,制成工作菌悬液。
1.2.2 样品制备
检验前先将生鲜乳样品摇匀,取样品20 mL 至离心管中,12 000 rpm/min 离心5 min,用注射器吸取离心后的生鲜乳,注意尽量不要吸到表层的脂肪质以防堵塞无菌过滤器,连接无菌过滤器,将生鲜乳过滤到另一个无菌EP管内待用。用无菌水做阴性对照。
1.2.3 检验用平板的制备
取一次性无菌培养皿,先在底层铺一薄层营养琼脂,晃动铺匀,凝固备用;取上述制备好的菌悬液,加入不烫手的营养琼脂培养基中,迅速混匀,将含菌悬液的琼脂培养基倒入上述平板中,晃动铺匀,凝固备用;取灭菌的牛津杯,在酒精灯上稍加热后,将牛津杯放置在上述营养琼脂表面,使牛津杯与琼脂表面形成轻度粘连,每块平板放置四个牛津杯,待用。
1.2.4 样品测定
采用杯蝶法测定生鲜乳中残留的β-内酰胺酶,测定体系中关于青霉素、舒巴坦、β-内酰胺酶的浓度确定可按照参考文献[12]的方法原理,通过抑菌圈的大小先确定青霉素的浓度与用量,再确定β-内酰胺酶的浓度与用量,最后确定舒巴坦的浓度和用量。
1.2.5 结果报告
阴性对照:A,B,D 均产生抑菌圈且|A-B|≤3 mm 且|D-C|≥3 mm,重复性良好。阴性对照成立是试验成功的前提。
阳性:B,D 均产生抑菌圈且|C-D|≥3 mm 且|B-A|≥3 mm,重复性良好。
阴性:B,D 均产生抑菌圈且|C-D|≥3 mm 且|B-A|≤3 mm,重复性良好。
2 结果与分析
2.1 菌悬液的浓度控制
在试验中,我们选择了系列浓度梯度的藤黄微球菌菌悬液,加入到营养琼脂培养基中进行测试,以阴性对照为例,各个不同菌量的试验条件下,抑菌圈直径如表1 所示。从抑菌圈直径的数据分析,加入菌悬液的量对抑菌圈的直径大小基本无影响,所以在实际检验中不需要刻意控制,只需要保证藤黄微球菌生长状态良好,无杂菌污染即可。
2.2 样品前处理对抑菌圈的影响
在检验中,我们比较了离心去脂肪层与无菌过滤处理和未做前处理的生鲜乳样品,使用同样的方法进行检验,通过比较发现,离心与无菌过滤处理的生鲜乳样品组,其抑菌圈呈圆形,边缘清晰可见,比较规则,抑菌圈直径易测量,测量数据基本无波动(图1);而未经过离心过滤处理的生鲜乳样品,其抑菌圈不规则,有时类似椭圆形,有时呈蔓延式生长,有时抑菌圈边缘不清晰,抑菌圈直径不易测量。生鲜乳样品如果不离心分离乳脂肪颗粒,基本无法过滤。以某养殖场某批次生鲜乳为样品,将经过离心与无菌过滤处理以及未处理的样品分别进行检验,做三个平行,取A、B、C、D 管抑菌圈直径的平均值,结果如表2所示。
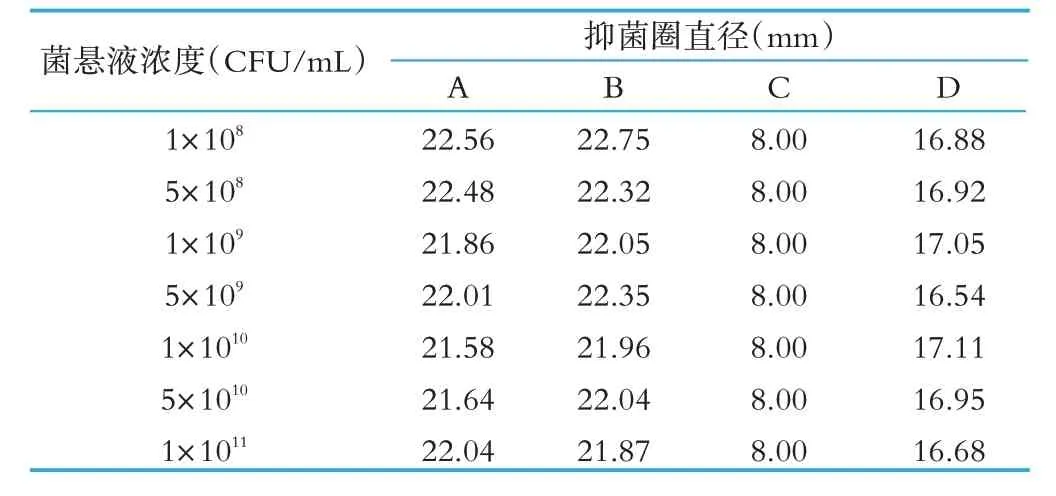
表1 不同浓度的菌悬液测量的抑菌圈直径

图1 离心和无菌过滤的样品检验平板
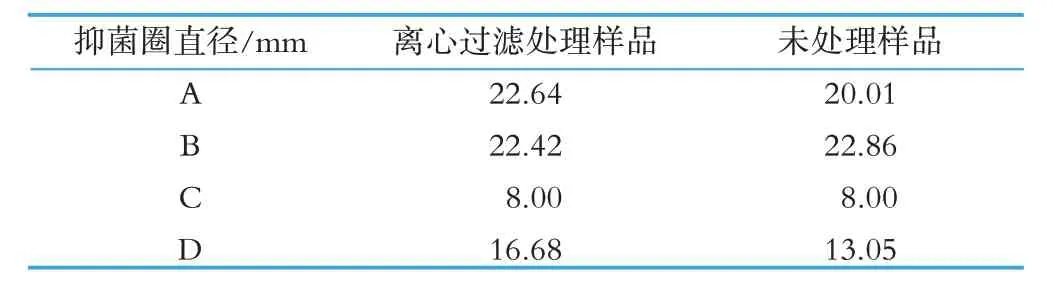
表2 离心过滤处理与未处理的样品测定结果
2.3 检验用平板的制备技巧
按照29 号文的要求,检验中需要用到抗生素检测用培养基Ⅱ,在实际检验中发现,完全可以用营养琼脂代替抗生素检测用培养基Ⅱ,制备检验平板时,平板底层和含菌层只使用营养琼脂,足以满足藤黄微球菌生长繁殖中对营养的需求,以阴性对照为例,使用抗生素检测用培养基Ⅱ和营养琼脂的检验数据如表3所示。在制备检验用平板时,需要将牛津杯放置在混合有藤黄微球菌的琼脂面上,若直接放置牛津杯,在加样品溶液、加盖培养皿盖、转运检验平板时,极可能会导致牛津杯内的样品溶液直接泄露到检验平板上,这将导致整个试验的失败。所以在制备检验用平板时,第二层混合有藤黄微球菌的琼脂层不必太厚,能够覆盖即可;同时在放置牛津杯时,可将牛津杯在酒精灯上稍加热,让牛津杯的余热融化少量琼脂,冷却后,牛津杯将和琼脂表面轻微粘连在一起,能有效防止牛津杯内样品溶液的泄露。
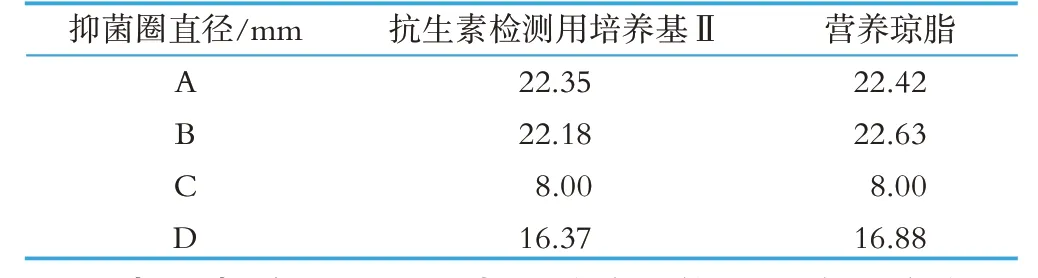
表3 使用抗生素检测用培养基Ⅱ和营养琼脂的抑菌圈直径
2.4 青霉素、舒巴坦、β-内酰胺酶最佳使用浓度的确定
根据试验原理,青霉素抑制藤黄微球菌的生长,β-内酰胺酶能降解青霉素,舒巴坦能抑制β-内酰胺酶的活性。所以我们先确定青霉素的浓度与用量,再确定β-内酰胺酶的浓度和用量,最后确定舒巴坦的浓度与用量。整个试验体系的关键是青霉素、舒巴坦、β-内酰胺酶三者之间的浓度与使用量的配比。关于青霉素的浓度与用量,参照29 号文使用量5 μL,我们配制了不同浓度的青霉素工作液,抑菌圈直径如表4所示。可以发现,按照29号文的浓度与用量,0.1 mg/mL的青霉素溶液,产生的抑菌圈直径能满足实验的要求。
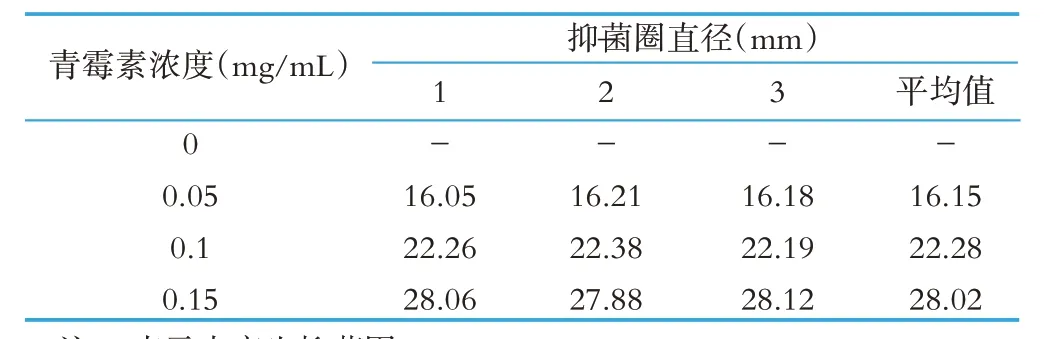
表4 不同青霉素浓度的抑菌圈直径
β-内酰胺酶的浓度与用量是本试验的关键。在确定好青霉素的浓度与使用量之后,根据29 号文中的判定规则,纯水阴性对照的结果为A、B、D 均应产生抑菌圈,C 不产生抑菌圈,据此来确定β-内酰胺酶的浓度与用量。29 号文中规定β-内酰胺酶的浓度为16 000 U/mL,使用量为25 μL。目前市面上常见的β-内酰胺酶主要有TCI 和Sigma 公司生产,其酶活性单位并不统一。严格来讲,需要依照中华人民共和国药典(2015 版)第四部生物活性测定法中青霉素酶及其活力测定法进行测定酶活,但实际检验中如此操作会比较麻烦。我们可以参照β-内酰胺酶的标签说明配制β-内酰胺酶标准工作液,β-内酰胺酶的浓度与使用量以C 刚好不产生抑菌圈为宜,即C 管内的β-内酰胺酶刚好可以全部失活A 管内的青霉素。因每个实验室使用的β-内酰胺酶品牌不统一,β-内酰胺酶的活性单位也不统一,所以本文不提供β-内酰胺酶的具体浓度与使用量。
舒巴坦的浓度和用量则依据D 的抑菌圈直径来确定。实际检验中如果完全依照29 号文中的试剂浓度与用量进行检验,以阴性对照为例,发现D 没有产生抑菌圈,或者D 产生的抑菌圈与C 相比小于3 mm,这说明β-内酰胺酶过量,需要降低β-内酰胺酶的用量,或者增加舒巴坦的用量,确保在阴性对照中D 产生的抑菌圈与C 相比大于3 mm。根据实际检验经验,D 的抑菌圈直径在16 mm 左右为宜。
3 讨论与总结
在试验中我们首先探讨了藤黄微球菌的菌悬液浓度与抑菌圈直径之间的关系。通过大量的试验证实,在日常检验中无需刻意调整菌悬液的浓度,菌悬液的浓度与用量不影响抑菌圈的直径大小,只是最终检验平板的颜色有深浅的区别。因为藤黄微球菌对青霉素高度敏感,所以试验菌株的菌量对抑菌圈的直径无影响。生鲜乳中各类微生物较多,含量各异[14],在检验中如果对生鲜乳样品不过滤除菌,理论上这些微生物将或多或少与青霉素发生相互作用,导致与藤黄微球菌发生作用的青霉素的量有变化,最终将影响抑菌圈的直径,所以理论上样品必须是无菌的。生鲜乳样品离心去除脂肪颗粒,这些脂肪颗粒将直接影响过滤的效果与速率,如果不去除这些脂肪颗粒,这些脂肪颗粒还可能会与样品溶液中的青霉素、舒巴坦或β-内酰胺酶发生相互作用,最终影响抑菌圈的直径;同时,脂肪颗粒等大颗粒杂质可能会限制青霉素、舒巴坦和β-内酰胺酶在琼脂层的扩散,最终影响抑菌圈的形状或直径,所以生鲜乳样品必须离心过滤除菌。在检验用平板制备环节,我们优化了培养基的使用,因为藤黄微球菌的营养要求不高,营养琼脂足以满足其生长中的营养需求。通过微加热巧妙的种植牛津杯,能有效防止牛津杯中的样品溶液直接泄露到琼脂平板上,提高试验的成功率。最后,通过阴性对照组中抑菌圈的直径来调整试验体系中青霉素、舒巴坦和β-内酰胺酶这三种试剂之间的浓度与使用量,确保整个试验体系的有效性。通过以上各种措施的联合使用,将大大提高试验的成功率,试验结果的判定分析也更清晰,为制定食品中β-内酰胺酶检测标准提供参考。

