脓毒症大鼠来源的外泌体对WJ-MSC的免疫调控能力的影响
方均燕 宋阿会 佟琰 丁峰 刘英莉
间充质干细胞(MSC)具有多向分化及自我更新能力,可通过自分泌和旁分泌等作用调控免疫性疾病[1-2]。研究发现,不同来源MSC的免疫调控功能有差异,其中人脐带华通胶来源的间充质干细胞(WJ-MSC)具备更好的免疫调控作用,其表面HLA-ABC分子较少,免疫原性更低,且来源于丢弃的脐带,不受伦理限制,更适合应用于临床治疗[3]。MSC分泌的外泌体在其旁分泌机制中发挥重要作用[4]。外泌体(Exosome)是一种由双层磷脂分子层包裹的细胞外囊泡,直径在30~150 nm。外泌体不仅是细胞排泄的代谢废物,其中还包含多种蛋白质、核酸、磷脂等物质,也能够发挥细胞间通讯、细胞迁移、血管新生、肿瘤生长等多种功能[5-6]。外泌体存在于血液、尿液、唾液等体液中,性质稳定,不易被破坏,可通过超速离心、蔗糖差速离心、PEG沉淀等方法分离获得。外泌体常见的表面标志物包括CD9、CD63、CD81等,在透射电镜(TEM)下可观察到外泌体具有杯盏状结构[7]。研究发现,通过炎症刺激(如IL-1β、LPS)处理MSC,能够增强其外泌体的免疫调控能力[8-9]。因此,通过改变WJ-MSC的培养条件,有可能进一步增加其免疫调节能力。
脓毒症是一种由于宿主对感染的免疫反应失调引起的临床综合征,由于缺乏早期的诊断和治疗,易发展至多器官功能障碍而危及生命。针对严重的脓毒症,目前尚缺乏特效的治疗手段[10]。研究发现,脓毒症的发生以细菌内毒素引起的免疫失调为主,内毒素激活巨噬细胞后,促使其分泌多种促炎性细胞因子(如IL-6、TNF-α、IL-1β等),促进巨噬细胞转化为促炎型巨噬细胞(M1),进一步加重组织器官的损伤[11-12]。体外研究表明,用LPS刺激THP-1巨噬细胞能够模拟体内炎症反应发生的启动过程,有助于探究预处理后的WJ-MSC在这一炎症反应中发挥的作用。脓毒症患者外周血中的外泌体在脓毒症的发展中发挥细胞间通讯作用,参与调节多种免疫细胞的功能,因而有助于脓毒症的早期诊断和监测[13-14]。研究发现,脓毒症患者外周血中的外泌体携带的hsa-miR-7-5p能够直接作用于抗凋亡基因,改善T细胞的凋亡,降低脓毒症大鼠死亡率[15]。结合既往研究,提示脓毒症大鼠外周血中的外泌体可能具备免疫特性,有望改善WJ-MSC的免疫调控能力。
本研究探索经脓毒症大鼠外周血来源的外泌体预处理后的WJ-MSC的细胞活性、凋亡、细胞因子的变化,并与LPS刺激下的THP-1细胞共培养,检测巨噬细胞的炎症因子变化,以明确脓毒症大鼠外周血外泌体对WJ-MSC的细胞增殖、凋亡及免疫调节特性的影响。
1 材料和方法
1.1 实验动物、试剂及仪器
6~8周雄性SD大鼠,体质量约220 g(上海交通大学医学院附属第九人民医院中心实验室)。
外泌体提取试剂盒(QIAGEN,美国),αMEM培养基、1640完全培养基、10%胎牛血清、1%青霉素和链霉素(Hyclone,美国),PKH67(Sigma,美国),SYRB试剂盒(Takara,美国)。
细胞超净工作台(Thermo,美国),超速离心机、流式细胞仪(Beckman,美国),倒置荧光显微镜(Nikon,日本),酶标仪(BioTek,美国),实时荧光定量PCR仪(ABI,美国)。
1.2 脓毒症大鼠模型的建立
实验组(n=6):SD大鼠麻醉后打开腹腔,暴露肠道,用棉签勾出盲肠,将粪便挤压至盲肠末端,在盲肠末端1/2至2/3间用1号缝线进行结扎,然后用4号针头在结扎盲端处刺穿盲肠,并挤出少许粪便,然后将盲肠回纳至腹腔,逐层缝合腹部皮肤。
对照组(n=6):仅进行腹腔打开、盲肠勾出等步骤,不结扎穿刺盲肠。
1.3 大鼠外周血外泌体的提取及鉴定
造模36 h后,麻醉两组大鼠,每只大鼠心脏采血5 mL(每组总30 mL),2 000 r/min、4 ℃离心15 min,吸取上层血清,采用外泌体提取试剂盒提取外泌体,电镜检查外泌体的形状,Western-blot检测外泌体表面标志物CD81和CD63的表达。
1.4 细胞培养和预处理
人脐带华通胶间充质干细胞(WJ-MSC)由上海市第一妇婴保健院王凯教授课题组捐赠,已完成该原代细胞株的鉴定[16]。WJ-MSC的培养采用αMEM培养基,添加10%胎牛血清、1%青霉素和链霉素。取第3~7代WJ-MSC细胞以104个/孔接种至96孔板或106个/孔接种于六孔板,待其长至80%融合时分别加入对照组及实验组大鼠外周血外泌体(20 μg/mL),孵育24 h后,取上清或细胞用作后续CCK8、Annexin-V-FITC/PI流式细胞检测。
两组外泌体分别用PKH67标记4 h,PBS洗去多余的染料。将WJ-MSC细胞与标记的外泌体共孵育24 h,然后用DAPI染WJ-MSC细胞核,鬼笔环肽染细胞骨架,使细胞核及骨架可视化。荧光显微镜观察染色的WJ-MSC外泌体(绿色)、细胞核(蓝色)及细胞骨架(红色)的位置。
人单核巨噬细胞(THP-1细胞)来源于中国细胞库,采用1640完全培养基(含10%胎牛血清,1%青霉素和链霉素)进行培养,先用佛泼酯(PMA,160 ng/mL)诱导成贴壁状态,再用LPS(100 ng/mL)进行培养,或将各组外泌体预处理后的WJ-MSC联合LPS与其共培养。实验分为4组:未处理的THP-1细胞(空白组)、THP-1细胞+LPS(LPS组)、THP-1细胞+LPS+对照组外泌体(LPS+Ne组)、THP-1细胞+LPS+实验组外泌体(LPS+Ce组)。
1.5 CCK8检测细胞活性
取经过各组外周血外泌体预处理的WJ-MSC(1×106个),未处理的WJ-MSC作为空白对照组。实验分为3组:未处理的WJ-MSC(空白对照组)、对照组外泌体预处理的WJ-MSC(Ne组,即对照组)、实验组外泌体预处理的WJ-MSC(Ce组,即实验组)。各孔加入10 μL CCK8,37 ℃孵育4 h后,用微孔酶标仪检测各孔在450 nm处的吸光值,Graphpad 5分析各组差异。
1.6 Annexin-V-FITC/PI检测细胞凋亡
取经过各组外周血外泌体预处理的WJ-MSC(1×106个),未处理的WJ-MSC作为空白对照组。实验分为3组:未处理的WJ-MSC(空白对照组)、对照组外泌体预处理的WJ-MSC(Ne组,即对照组)、实验组外泌体预处理的WJ-MSC(Ce组,即实验组)。用0.25%胰蛋白酶消化各孔细胞,其余各孔细胞消化后1 000 r/min离心5 min,舍弃上清,用100 μL Annexin Buffer重悬后加入4 μL Annexin V,避光孵育10 min,加入4 μL PI,立即上机检测,结果用CytExpert软件进行分析。
1.7 qPCR检测细胞因子的表达
分别取3组WJ-MSC细胞与4组THP-1细胞,用TRIzol法提取各组细胞总mRNA,逆转录为cDNA,接着用SYRB试剂盒进行实时定量PCR检测,以GAPDH为内参基因,检测细胞因子(IL-6、IL-10、TNF-α、IL-1β)的表达。计算各组各细胞因子的RQ值(表1)。
1.8 数据处理及统计学分析
所有实验均用GraphPad软件统计分析三次独立实验结果,计算各组间均值和标准差,多组间差异比较用ANOVA one-way检验,P<0.05表示差异有统计学意义。
2 结果
2.1 鉴定各组大鼠外周血来源的外泌体
为了确定分离提取大鼠外周血来源外泌体的方法可靠,本实验使用电镜拍摄各组外泌体的形状,Western-blot检测其表面标志物,外泌体吞噬实验检测两组外泌体被WJ-MSC吞噬的能力。电镜结果显示,对照组和实验组外泌体形状一致,似杯盏状,直径相似。Western-blot结果显示对照组和实验组的外泌体均能表达外泌体表面标志物CD63和CD81(图1 A、B)。
两组外泌体经PKH67标记(绿色)后,与WJ-MSC细胞共孵育。结果显示,标记了PKH67的外泌体(绿色)围绕着DAPI染色的细胞核(蓝色),这表明两种外泌体类型都能被WJ-MSC细胞摄取,且吞噬能力无明显差异(图1C)。
2.2 各组大鼠外周血外泌体对WJ-MSC增殖、凋亡的影响
流式细胞仪检测发现,与空白对照组相比,Ne组和Ce组中WJ-MSC的凋亡细胞比例均明显下降(P<0.01),但Ne组和Ce组之间无明显差异(P>0.05)。CCK8结果显示,与空白对照组相比,Ne组和Ce组中WJ-MSC的细胞增殖无明显差异(P>0.05)(图2)。
2.3 各组大鼠外周血外泌体对WJ-MSC分泌的细胞因子的影响
qPCR结果表明,与空白对照组相比,Ne组IL-10的mRNA表达降低,Ce组IL-10的mRNA表达则增加,差异均具有统计学意义(P<0.01);且与Ne组相比,Ce组IL-10的mRNA表达也明显增加(P<0.01);与空白对照组相比,Ne组WJ-MSC细胞中TNF-α的mRNA表达明显增加(P<0.01);与Ne组相比,Ce组中TNF-α的mRNA表达降低,两组之间具有统计学差异(P<0.05)(图3)。

A:电镜下外泌体的形状;B:Western-blot检测外泌体上CD81和CD63的表达;C:荧光显微镜下观察外泌体被WJ-MSC细胞的摄取a: The shape of exosomes observed under electron microscope; B: Expressions of CD81 and CD63 on exosomes detected by Western-blot; C: The uptake of exosomes by WJ-MSC observed under fluorescence microscope图1 各组外泌体的鉴定Fig. 1 Identification of exosomes of each group
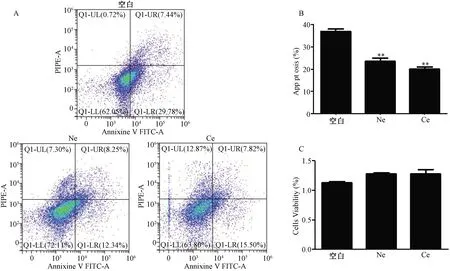
A、B:流式细胞仪检测外泌体处理WJ-MSC后的凋亡细胞比例;C:CCK8检测外泌体对WJ-MSC细胞活性的影响 A, B: The proportion of apoptotic cells after exosome treated with WJ-MSC detected by flow cytometry; C: The effects of exosomes on the activity of WJ-MSC detected by CCK8图2 各组外泌体对WJ-MSC细胞增殖及凋亡的影响(**: 与空白对照组相比,P<0.01)Fig. 2 Effects of exosomes on proliferation and apoptosis of WJ-MSC in each group (**: compared with blank control group, P<0.01)

A:IL-10;B:TNF-α(**: 与空白对照组相比,P<0.01; &: 与Ne相比,P<0.05; &&: 与Ne相比,P<0.01)a: IL-10; B: TNF-α(**: compared with blank control group, P<0.01; &: compared with Ne group, P<0.05; &&: compared with Ne group, P<0.01)图3 qPCR检测各组外泌体对WJ-MSC中细胞因子mRNA水平的影响Fig. 3 Effects of exosomes on mRNA levels of cytokines in WJ-MSC detected by qPCR of each group
2.4 各组大鼠外周血外泌体对WJ-MSC免疫调控能力的影响
qPCR的结果显示,与空白对照组相比,LPS组、LPS+Ne组和LPS+Ce组IL-10的mRNA水平均显著升高(P<0.01);与LPS组相比,LPS+Ne组和LPS+Ce组中IL-10的mRNA水平略有升高,但无统计学差异(P>0.05);LPS+Ne组和LPS+Ce组之间IL-10的mRNA水平无明显差异(P>0.05)。
与空白对照组相比,LPS组、LPS+Ne组和LPS+Ce组IL-6的mRNA水平均明显升高(P<0.05);LPS+Ne组和LPS+Ce组较LPS组该指标均有所增加,但差异无统计学意义(P>0.05);LPS+Ne组和LPS+Ce组之间IL-6的mRNA水平无明显差异(P>0.05)。
与空白对照组相比,LPS组、LPS+Ne组和LPS+Ce组IL-1β的mRNA水平均显著升高(P<0.01);与LPS组相比,LPS+Ne组和LPS+Ce组中IL-1β的mRNA水平均显著下降(P<0.01);但是,LPS+Ne组和LPS+Ce组之间的IL-1β的mRNA水平无明显变化(P>0.05)。
与空白对照组相比,LPS组TNF-α的mRNA水平明显升高(P<0.01);与LPS组相比,LPS+Ne组和LPS+Ce组TNF-α的mRNA水平均明显下降(P<0.01);但LPS+Ne组和LPS+Ce组之间TNF-α水平无明显差异(P>0.05)(图4)。

A:IL-10;B:IL-6;C:IL-1β;D:TNF-α(**: 与空白对照组相比,P<0.01; &&: 与LPS组相比,P<0.01)a: IL-10; B: IL-6; C: IL-1β; D: TNF-α(**: compared with blank control group, P<0.01; &&: compared with LPS group, P<0.01)图4 qPCR检测不同预处理后WJ-MSC对LPS诱导下THP-1细胞中细胞因子mRNA水平的影响Fig. 4 qPCR was used to detect the effects of different pretreatment of WJ-MSC on the mRNA levels of cytokines in THP-1 cells induced by LPS
3 讨论
外泌体作为一种细胞外囊泡,由供体细胞通过胞吐方式分泌,再以胞吞形式被受体细胞摄取,释放携带的多种物质,调节受体细胞的多项功能[17]。本研究提取了两组大鼠外周血来源的外泌体,并通过Western-blot验证了外泌体标志物的表达,电镜下观察到类似杯盏状结构,证明了提取方法的可靠性及稳定性。通过外泌体吞噬实验,验证了两种外泌体均能够被WJ-MSC细胞摄取。目前研究认为,脓毒症外周血来源的外泌体作为一个混合物,包含来自免疫细胞、血细胞等多种类型细胞的信息,能够发挥促血栓形成、促炎症、介导内皮功能障碍或抗炎等作用,由病原微生物种类、宿主免疫状态等决定其发挥保护或损伤作用[18-20]。Exline等[21]认为,脓毒症外周血来源的外泌体能够释放caspase-1,诱导淋巴细胞凋亡。本研究发现,脓毒症外周血来源的外泌体也能够抑制WJ-MSC的细胞凋亡,但不影响其细胞增殖活性,具体作用机制仍需进一步研究。
既往研究提示,MSC经缺氧、炎性因子、细菌及药物等预处理后,所得外泌体具有更强的免疫调控能力,如LPS预处理后的MSC-EV,具有更加优化的免疫调控能力,可以促使巨噬细胞向M2型极化增加,降低促炎性细胞因子水平(IL-1β,IL-6和TNF-α),降低脓毒症死亡率[9]。另外还发现,经过脓毒症外周血来源的外泌体预处理后的单核细胞,在LPS刺激下,分泌的TNF-α含量显著降低,提示其能够增强单核细胞的免疫耐受能力[22]。以上结果提示脓毒症外周血外泌体有望成为增强WJ-MSC的免疫能力的刺激物。与在淋巴细胞中的研究发现类似,本研究发现,脓毒症大鼠外周血来源的外泌体能够促进WJ-MSC细胞中抗炎因子(IL-10)的mRNA水平表达,下调促炎性因子(TNF-α)的mRNA水平表达,可能增强了WJ-MSC的免疫调控能力。
MSC通过自分泌或者旁分泌的方式,分泌细胞因子、趋化因子以及外泌体等,参与多种免疫性疾病的调节。为了进一步验证两种外泌体对WJ-MSC免疫调控能力的影响,我们利用细胞共培养体系,将经过两种外泌体预处理的WJ-MSC与LPS诱导下THP-1细胞共培养,检测THP-1细胞中细胞因子的mRNA水平表达变化。结果表明,经过两种外泌体预处理后的WJ-MSC均能够降低THP-1细胞中促炎性因子(TNF-α、IL-1β)的mRNA水平,但两组之间无明显差异,表明脓毒症大鼠外周血外泌体并不能更好地逆转LPS刺激的THP-1细胞的急性炎症反应。
本研究首次验证了脓毒症外周血外泌体能够抑制WJ-MSC的细胞凋亡,上调IL-10的表达,抑制TNF-α的表达,但并不能增强其对LPS刺激下THP-1细胞中炎性因子的抑制作用。但是,脓毒症外周血外泌体发挥抑制WJ-MSC细胞凋亡及细胞因子水平的具体机制仍需进一步探究。此外,仍需探究经两种外泌体预处理的WJ-MSC对LPS诱导下THP-1细胞的吞噬等功能的影响。

