石榴鞣花酸提取物对人肺癌细胞A549凋亡的诱导
赵胜娟,费 鹏,刘丽莉,程玉江
(1.河南科技大学 食品与生物工程学院,河南 洛阳 471023;2.洛宁县市场监督管理局,河南 洛阳 471700)
0 引言
肺癌是临床最常见的恶性肿瘤之一,其治疗手段主要有手术、放疗、化疗、靶向治疗和免疫治疗等,但这些治疗方式存在较大的毒副作用以及价格昂贵等问题[1-3]。因此,寻找一种抗癌效果显著,副作用小且成本低的治疗途径是亟待解决的科学问题。
肿瘤细胞的生长繁殖与细胞的凋亡水平紧密相关,诱导细胞凋亡是防治癌症的一个重要策略[4],而天然产物能够显著地降低肿瘤细胞的生命活性[5],因此,越来越多的研究致力于探讨不同天然产物对肿瘤细胞的抑制作用。文献[6]对葱类蔬菜治疗癌症的前景进行了综述。文献[7]研究了青蒿提取物的抗肿瘤活性,并明确了其有效成分。文献[8]研究了4种伏牛山原生药用植物的抗癌活性,发现其醇提物在体外对食管癌细胞或肝癌细胞具有浓度依赖的生长抑制作用,以70%(体积分数)乙醇提取物活性最强。石榴具有驱虫、抗菌、抗病毒、预防和治疗心脑血管、抗癌等多种药理作用[9-11],而这些功效都归结于石榴中含有丰富多样的酚类物质。鞣花酸(ellagic acid,EA)是石榴中主要的酚类物质之一,文献[12-13]研究了石榴皮多酚提取物和其主要活性物质安石榴苷、鞣花酸对肝癌细胞的凋亡诱导,发现它们能够通过线粒体通路干预细胞的凋亡,而石榴鞣花酸提取物(ellagic acid extracts from pomegranate,EAEFP)对肺癌细胞的抑制作用及其可能的作用途径尚未得到清晰的揭示。
本文以A549肺癌细胞为研究对象,分析EAEFP对A549肺癌细胞存活率、细胞形态、细胞周期和细胞凋亡的作用,以期揭示EAEFP诱导A549肺癌细胞凋亡的可能作用途径,为石榴的深度加工利用和新型天然抗肿瘤功能性食品的开发提供一定的理论参考,对充分挖掘石榴的食用及保健价值具有积极意义。
1 材料与方法
1.1 试验材料
人非小细胞肺癌细胞株A549:河南科技大学食品与生物工程学院细胞室保存;石榴鞣花酸提取物(EAEFP):西安维特生物科技有限责任公司提供,由石榴皮(产地:陕西临潼)用100%(体积分数)甲醇提取所得。
四甲基偶氮唑盐(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT),4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI):美国Sigma公司;细胞培养基:RPMI-1640,美国Gibco公司;胎牛血清:Gibco 10099-141,美国Gibco|Life Technologies公司;细胞周期检测试剂盒:Annexin V-FITC/PI双染细胞凋亡试剂盒,南京建成生物工程研究所。
1.2 试验仪器
Agilent 1200 Infinity 系列高效液相色谱(high performance liquid chromatography,HPLC)系统:北京安捷伦科技公司;CO2恒温培养箱:CCL-170B-8型,新加坡ESCO有限公司;普通倒置显微镜:OLYMPUS CKX41型,日本OLYMPUS公司;全波长酶标仪:Multiskan GO型,美国热电公司;生物柜:ESCO AC2-4S1型,新加坡 ESCO有限公司;流式细胞仪:FACSCalibur型,美国BD公司;荧光倒置显微镜:Leica DM3000型,上海徕卡仪器有限公司。
1.3 试验方法
1.3.1 石榴鞣花酸提取物HPLC分析
准确称取0.10 g的EAEFP,溶于甲醇中,配制成质量浓度为1 mg/mL的样品溶液,用0.22 μm的过滤膜过滤后注入高效液相色谱系统进行成分分析。液相检测条件:色谱柱 Aglient Zorbax SB-C18(5 μm,4.6 mm×250 mm),紫外检测波长280 nm,柱温30 ℃,进样量20 μL,流动相A为1%(质量分数)冰醋酸,流动相B为甲醇,流速1 mL/min。检测程序:0~70 min(流动相 A:95%~56%(体积分数),流动相 B:5%~44%(体积分数)),70~80 min(流动相A:56%,流动相B:44%)[14]。
1.3.2 石榴鞣花酸提取物溶液配制及细胞培养
称取一定量的EAEFP,用二甲基亚砜(dimethyl sulfoxide,DMSO)溶解,配制成质量浓度为15 mg/mL的贮存液,避光保存于4 ℃冰箱中备用。试验时,用无血清培养基把贮存液按2∶3(体积比)稀释成一系列工作浓度,保证DMSO在终体系中体积分数不大于1‰。A549肺癌细胞用含10%(质量分数)的RPMI-1640培养液,置于37 ℃,5%(体积分数)CO2相对饱和湿度恒温培养箱中培养。
1.3.3 细胞增殖抑制试验
利用MTT比色法检测EAEFP对A549肺癌细胞存活率的影响。取对数生长期的A549肺癌细胞,计数后调整至适宜种板密度,每孔种板90 μL。过夜培养后,分别加入10 μL不同质量浓度的EAEFP。继续培养48 h后,每孔加入20 μL MTT,孵育4 h后加入50 μL三联液,过夜孵育后用全波长酶标仪检测570 nm波长处的吸光度,以对照组为100%计算各处理组的细胞活力。各质量浓度的EAEFP设6个平行复孔,为了消除原始细胞对吸光度的影响,不同处理样品最后的吸光值均减去原始细胞的吸光值。
1.3.4 DAPI染色法分析细胞形态
取对数生长期的A549肺癌细胞接种于六孔板,种板密度为1×105mL-1,每孔2 mL,将经过多聚赖氨酸包被的无菌玻片放入六孔板中。过夜培养后,加EAEFP继续孵育48 h,将上清液弃去,加入4%(质量分数)多聚赖氨酸固定。将固定液去除后,加入DAPI染色液,染色15 min后,用荧光显微镜拍照[15]。
1.3.5 细胞周期的检测
利用流式分析仪分析EAEFP对A549肺癌细胞周期的影响。取对数生长期的A549肺癌细胞接种于六孔板,种板密度为1×105mL-1,每孔2 mL。过夜培养后,加EAEFP继续孵育48 h,离心收集细胞,弃上清液,用预冷磷酸盐缓冲溶液(phosphate buffer saline,PBS)洗细胞2次。加入预冷70%(体积分数)乙醇,于4 ℃固定过夜,或-20 ℃长期固定。离心收集细胞,以1 mL的PBS洗细胞1次,加入500 μL PBS(含50 μg/mL碘化丙啶(propidium iodide,PI),100 μg/mL RNase A),4 ℃避光孵育30 min。用流式细胞仪检测,一般计数1×104个细胞,结果用细胞周期拟合软件ModFit进行分析。
1.3.6 细胞凋亡率的检测
根据文献[16]的方法,利用Annexin V-FITC/PI双染法流式细胞仪,检测EAEFP对A549肺癌细胞的凋亡。按照试剂盒操作说明进行如下操作:将对数生长期A549肺癌细胞接种于六孔板中,种板密度为1×105mL-1,每孔2 mL。过夜培养后加EAEFP。相同条件下,继续孵育48 h,消化收集细胞,用PBS洗2次,加入100 μL 结合缓冲液、5 μL异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的Annexin-V和1 μL PI,室温避光30 min。加入400 μL缓冲液,立即用FAC Scan进行流式细胞术定量检测,以不加Annexin V-FITC及PI作为阴性对照。
1.4 数据分析
以上试验每组样品测3个平行样,所得数据用Microsoft Excel数据统计软件进行处理、制图,并用DPS软件进行差异性分析,显著水平为P<0.05。
2 结果与分析
2.1 石榴鞣花酸提取物成分鉴定及定量
在前期的研究中,确定了鞣花酸标品HPLC图谱中最高峰在保留时间65 min左右出现。进而,利用HPLC法分析EAEFP的组成成分,结果如图1所示。由图1可知:EAEFP在65 min时出现最大峰,说明EAEFP中鞣花酸占绝大部分,根据峰面积计算得出此提取物中鞣花酸质量分数达90.41%,其他物质未确定。
2.2 石榴鞣花酸提取物对A549肺癌细胞增殖的抑制作用
利用MTT比色法分析EAEFP对A549肺癌细胞存活率的影响,结果如图2所示。图2中,图柱上方不同字母表示差异显著(P<0.05)。由图2可知:随着EAEFP质量浓度的增大,A549肺癌细胞的存活率逐渐降低,呈现较好的剂量效应。当EAEFP质量浓度为0.88 μg/mL时,细胞存活率为83.54%,与对照组相比差异显著(P<0.05)。当EAEFP质量浓度为15.00 μg/mL 时,细胞存活率仅为35.77%。可见EAEFP对A549肺癌细胞的增殖具有良好的抑制作用。

图1 EAEFP成分HPLC图

图2 EAEFP对A549肺癌细胞存活率的影响
2.3 石榴鞣花酸提取物对A549肺癌细胞形态的影响
A549肺癌细胞经EAEFP处理后,利用DAPI染色法对其进行形态学分析,结果如图3所示。图3a为空白对照组,由图3a可见:细胞大小均一,轮廓清楚,未见明显的悬浮细胞。图3b为3 μg/mL EAEFP处理后的细胞,由图3b可见:A549肺癌细胞的生长受到显著的抑制,细胞数量明显减少,细胞核出现了一定程度的皱缩,甚至出现了一些细胞碎片。且对细胞的这种破坏随着EAEFP质量浓度的提高而加剧(见图3c)。因此,初步推断EAEFP具有促使A549肺癌细胞形态异常化的作用,从而促进了A549肺癌细胞的凋亡,这一发现与白花蛇舌草乙醇提取物对A549肺癌细胞的作用途径相似[17]。

(a) 对照组 (b) 3 μg/mL EAEFP (c) 6 μg/mL EAEFP
图3 EAEFP对A549肺癌细胞形态的影响(200倍)
2.4 石榴鞣花酸提取物对A549肺癌细胞周期的影响
细胞的分裂一般分为3个阶段,分别为G1期(DNA合成前期)、S期(DNA合成期)、G2期(DNA合成后期)。为了探究EAEFP对A549细胞增殖的抑制作用是否与其阻滞了细胞周期有关,本文利用流式细胞仪分析EAEFP作用于A549肺癌细胞48 h后,对A549肺癌细胞周期的影响,如图4所示。

(a) 对照组

(b) 3 μg/mL EAEFP

(c) 6 μg/mL EAEFP

(d) 各时相细胞个数百分比统计图
从图4a~图4c可以看出:当3 μg/mL和6 μg/mL的EAEFP作用于A549肺癌细胞 48 h后,S期细胞个数明显少于对照组,且随着EAEFP质量浓度的增大,S期细胞个数越来越少。数据统计结果显示(见图4d):EAEFP作用于A549肺癌细胞后,G1期细胞个数百分比由66.93%增加至81.66%,S期细胞个数百分比由29.20%降低至15.21%,G2期细胞个数百分比无明显变化。这表明EAEFP将A549肺癌细胞阻滞在G1期,抑制A549肺癌细胞进入DNA合成期,影响DNA正常复制,从而抑制了A549肺癌细胞的增殖。
2.5 石榴鞣花酸提取物对A549肺癌细胞凋亡的影响
采用Annexin V-FITC/PI双染流式细胞仪分析EAEFP对A549肺癌细胞凋亡的影响,结果如图5所示。图5a~5c中:横坐标为荧光探针Annexin V-FITC的信号强度;纵坐标为荧光探针PI的信号强度。图5a~图5c为A549肺癌细胞Annexin V/PI染色点阵图。图5d为A549肺癌细胞凋亡率统计图,图柱上方不同字母表示差异显著(P<0.05)。从图5a~图5c可以看出:当3 μg/mL和6 μg/mL的EAEFP作用于A549肺癌细胞 48 h后,细胞凋亡数量明显高于对照组,且有剂量依赖关系。图5d显示两个质量浓度处理组的A549肺癌细胞凋亡率分别为10.41%和17.35%,均显著高于对照组A549肺癌细胞凋亡率(P<0.05)。表明EAEFP能诱导A549肺癌细胞凋亡并呈剂量依赖性。

(a) 对照组
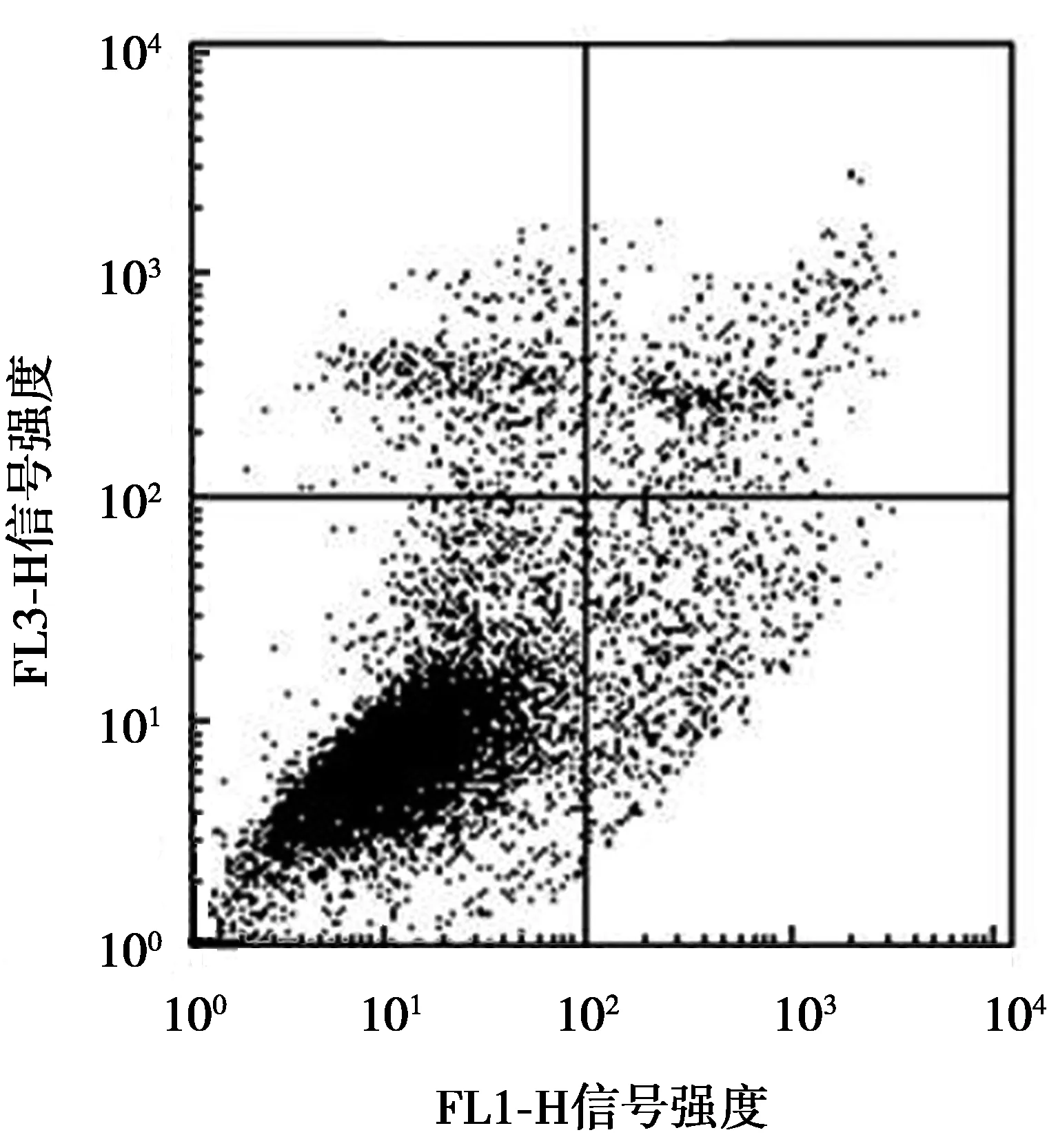
(b) 3 μg/mL EAEFP

(c) 6 μg/mL EAEFP

(d) 细胞凋亡率统计图
3 结束语
石榴鞣花酸提取物能显著抑制A549肺癌细胞的增殖,且在质量浓度为0~15 μg/mL时呈现良好的剂量效应。石榴鞣花酸提取物可以使A549肺癌细胞形态发生改变,细胞核发生皱缩,且随质量浓度增大,细胞核皱缩更加严重。石榴鞣花酸提取物可以干扰A549肺癌细胞生长周期,将细胞阻滞在G1期,抑制细胞DNA正常复制。石榴鞣花酸提取物可以引起A549肺癌细胞凋亡,且呈剂量依赖性。
石榴鞣花酸提取物对A549肺癌细胞具有良好的凋亡作用,是潜在的抗癌天然物质。文献[18]指出树莓鞣花酸对肝癌细胞和肺癌细胞等具有显著的抑制作用,发现鞣花酸在癌细胞分裂过程中,鞣花酸组织细胞有丝分裂G0/G1期的转换,抑制了细胞DNA的合成,从而诱导细胞凋亡,本研究的结果与此基本吻合。文献[19]研究发现:鞣花酸能够与姜黄素协同作用,共同诱导活性氧的产生,使p53蛋白大量累积,诱导了癌细胞的大量凋亡。文献[20]利用膜透析技术制备鞣花酸的双载核壳纳米粒,优化后的颗粒观察到更高的细胞毒性,可作为乳腺癌治疗联合用药。这些文献均提示鞣花酸对肺癌细胞等癌细胞具有显著抑制作用。但关于石榴鞣花酸提取物诱导A549肺癌细胞凋亡的研究报道较少,其作用机制和凋亡通路更是缺乏研究。本文明确了石榴鞣花酸提取物对A549肺癌细胞的凋亡作用以及作用机制,可以拓展石榴鞣花酸的应用领域,进一步指导该天然产物在抗癌功能上的应用。

