非小细胞肺癌化疗前后血清糖类抗原125、肿瘤异常蛋白水平变化及其与疗效的关系
彭 峰,彭奕华,张宏华,杨印楼
广东省韶关市粤北人民医院呼吸内科(韶关512026)
非小细胞肺癌(Non small cell lung cancer,NSCLC)是临床较为常见的恶性肿瘤之一,其病因相对复杂,早期可表现为胸痛、痰血等表现,若不加以干预,病情的发展可进一步危及患者的生命安全[1]。目前,NSCLC主要通过辅助化疗治疗,能够改善患者病情,杀死或抑制肿瘤的发展,但可能部分患者对化疗敏感度不佳,导致其治疗效果不佳[2]。而有研究显示,血清肿瘤异常蛋白(Tumor abnormality protein,TAP)、糖类抗原125(Carbohydrate antigen 125,CA125)是临床上常见的肿瘤标记物,其水平变化可作为对NSCLC患者预后评估的重要指标,但关于二者在评估NSCLC化疗疗效的应用较少[3-4]。对此,本研究通过放射免疫法和TAP检测患者的血清CA125、TAP水平,探讨上述两种因子与NSCLC化疗疗效的关系,现报告如下。
资料与方法
1 一般资料 选取2015年8月至2018年8月本院收治的NSCLC患者120例作为NSCLC组,病例纳入标准:①经临床诊断、影像学、病理学证实为NSCLC[5];②年龄大于18岁且病变长度均>3 cm;③院前无相关治疗;④签署知情同意书。排除标准:①本次药物过敏史;②血液性疾病;③有心、肝、肾等严重性疾病;④资料不全。其中男65例,女55例,年龄23~80岁,平均(52.64±14.64)岁,癌症TNM分期:Ⅱ期41例,Ⅲ期42例,Ⅳ其37例,癌症类型:鳞癌50例,腺癌39例,腺鳞癌 31例,同期选取健康对象60例作为健康组,男30例,女30例,年龄22~70岁,平均(51.23±13.65)岁,本次研究经我院伦理委员会审批且通过,两组一般资料比较,差异无统计学意义(P>0.05),具有可比性。
2 研究方法
2.1 化疗方法:所有患者在治疗前给予注射7.5 mg地塞米松,2次/d,持续应用3 d,同时使用5-HT3受体拮抗剂昂丹司琼防止呕吐止吐药物,一切就绪后给予奈达铂注射剂联合多西他赛注射液治疗,其中每个疗程第1天给予静脉滴注80 mg/m2奈达铂(50 mg, 国药准字H20064295),每个疗程的第2天给予静脉滴注100 mg/m2多西他赛(1 ml∶20 mg, 国药准字H20123222),总共4个疗程。
2.2 CA125检测:抽取上肢静脉血4 ml于无菌试管,予以分离血清后通过放射免疫法检测血清CA125,操作均根据说明书执行。
2.3 TAP检测:取所有研究对象0.25 ml血液于涂片,风干后取TAP试剂滴入血液,加凝聚助剂干燥,使其成为血液标本,并于实验室内进行TAP检测,观察其水平变化。以上相关仪器及配套设施均购自浙江省慈溪市瑞生医疗仪器厂。
3 指标观察和标准 记录患者化疗前、化疗3 d及健康人员的TAP、CA125水平及患者的化疗效果。化疗效果依据文献进行评价[6]:①完全缓解(Complete remission,CR):肿瘤消除且无复发,持续时间为1个月;②部分缓解(Partial remission,PR):肿瘤最大直径和最大垂直直径乘积缩小≥50%并持续≥30 d,无其他病情恶化;③稳定(Stable disease,SD):肿瘤最大直径和最大垂直直径乘积缩小<50%,或增大≤25%;④进展(Progression disease,PD):肿瘤最大直径和最大垂直直径乘积增大>25%。
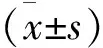
结 果
1 两组血清CA125、TAP水平比较 NSCLC组血清CA125、TAP水平明显高于健康组(P<0.05),见表1。
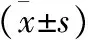
表1 两组血清CA125、TAP水平比较
2 NSCLC化疗后不同疗效患者的血清TAP、CA125水平比较 NSCLC组化疗后,CR 24 例(20.00%)、PR 54例(45.00%)、SD 36例(30.00%)、PD 6例(5.00%);CR、PR、PD患者化疗前、化疗后3 d血清CA125、TAP水平及其下降比比较,差异有统计学意义(P<0.05),SD患者化疗前、化疗后3 d血清CA125、TAP水平及其下降比比较(P>0.05),见表2、3。
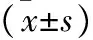
表2 NSCLC化疗后不同疗效患者的血清TAP水平比较
注:与同组化疗前比较,*P<0.05
3 评估NSCLC化疗有效性的ROC曲线分析 ROC曲线分析结果显示,在评估NSCLC化疗有效性的敏感度、特异度、准确度方面,CA125下降比以>27%为临界值时88.46%(69/78),69.48%(29/42),81.67%(98/120),TAP下降比以>18%为临界值时为85.90%(67/78),69.48%(29/42),80.00%(84/120),TAP联合CA125为96.15%(75/78),90.48%(38/42),94.17%(113/120),TAP联合CA125明显高于二者单独时,比较差异有统计学意义(P<0.05),见表4(图1)。
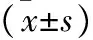
表3 NSCLC化疗后不同疗效患者的血清CA125水平比较
注:与同组化疗前比较,*P<0.05
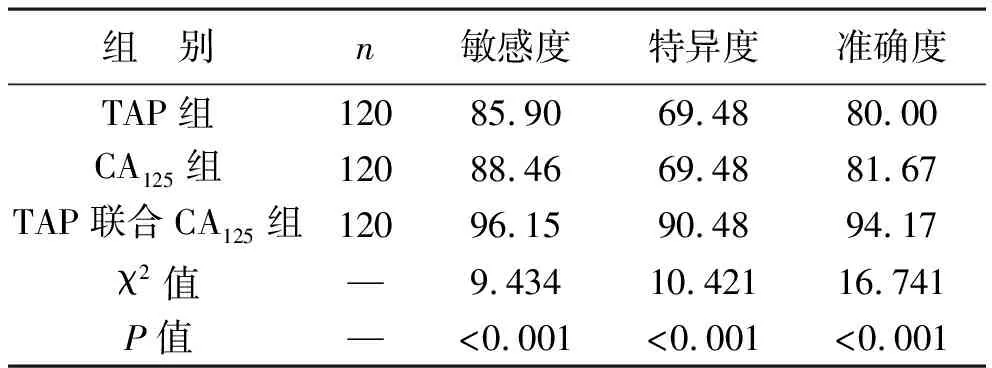
表4 不同方法评估NSCLC化疗有效性的效能比较(%)
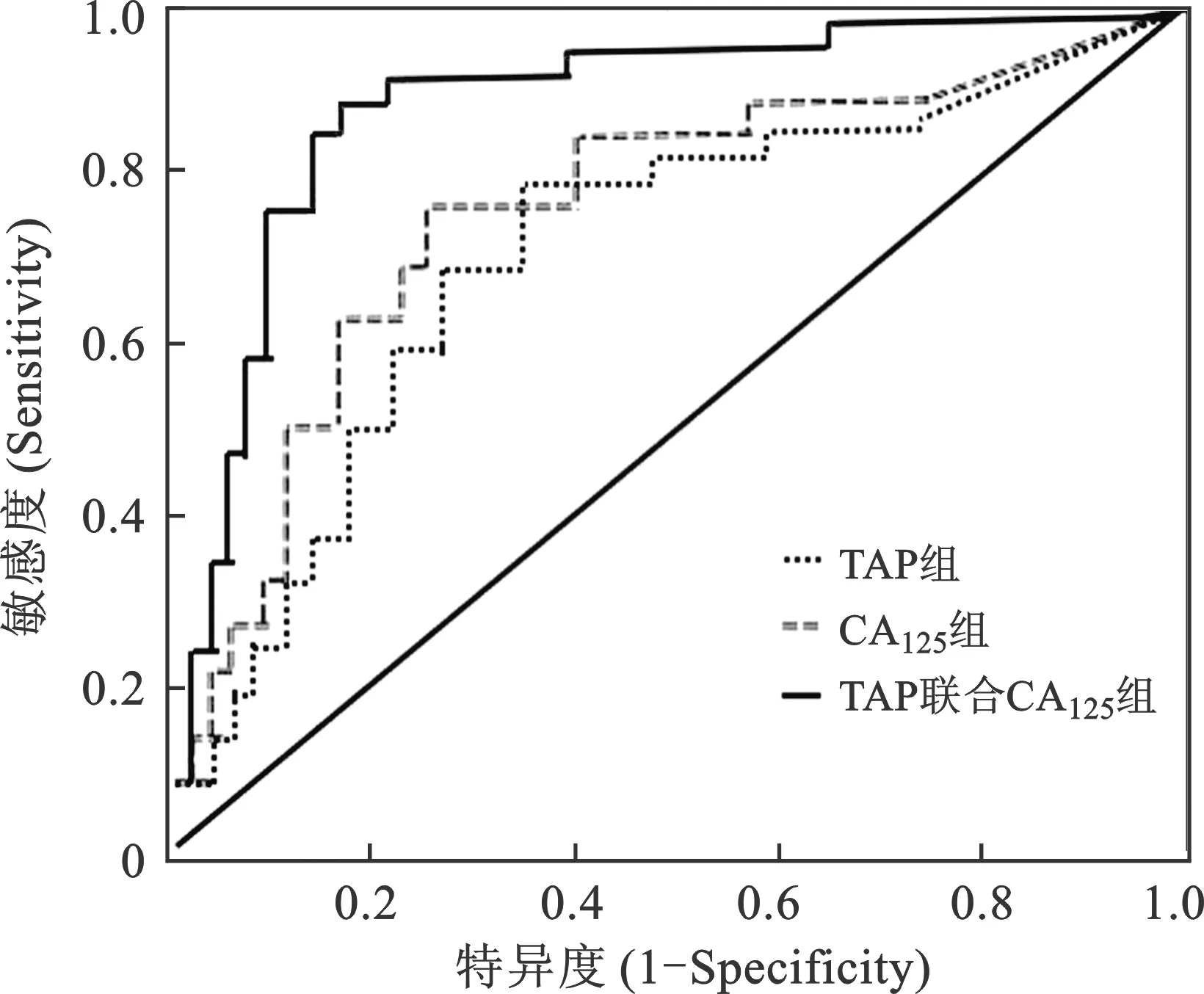
图1 不同方法评估NSCLC化疗有效性的ROC曲线分析
讨 论
NSCLC是当代社会高发率及高病死率的恶性肿瘤,占肺癌80%,由于NSCLC缺乏明显的特征,多数患者往往难以早期确诊而延误治疗,严重影响病情的预后发展[7-9]。目前,奈达铂注射剂联合多西他赛注射液化疗方案是NSCLC常见的化疗方案,该疗法可有效抑制癌细胞的发育,具有抗肿瘤活性作用,已被广泛应用于各种癌症的治疗中,但仍有部分患者的癌细胞异常增殖和快速转移,导致化疗疗效欠佳[10]。
相关文献指出,肿瘤标志物作为一种肿瘤因子近年来已被临床医学关注和重视。其存在可能与肿瘤的发展机制有很大关系,同时也提示肿瘤标志物可能对肿瘤患者的预后进行评估。其中CA125是胚胎发育期体腔上皮的一种糖蛋白抗原,由于体腔上皮细胞发生恶性病变时,可被大量释放至血液中,其可能与肿瘤的存在有一定关系[11-12]。同时,当癌细胞侵袭正常细胞时,会影响细胞的正常发育,从而破坏其膜表面的聚糖结构,继而衍生各种聚糖分支如N-链聚糖,产生更多的TAP,提示TAP与肿瘤的进展也有关系[13]。
本研究结果发现NSCLC组血清CA125、TAP水平明显高于健康组,此与薛珊、姜峰等[14-15]的研究结果基本相同,表明血清TAP、CA125与NSCLC的病理发生密切相关。这可能是当机体存在肿瘤细胞时,会向正常组织侵袭、渗透,尤其是对机体上皮细胞的渗透,会导致大量CA125释放分解至血浆中,同时细胞膜表面的聚糖结构由于肺癌细胞的侵袭导致发生异常,从而引起TAP大量释放至血液,进一步扩散肺癌细胞的生长。而NSCLC组经过化疗后有24 例CR、54例PR、36例SD、6例PD,表明化疗是NSCLC患者一种有效的治疗方法,但仍存在部分患者对化疗不敏感。同时本研究中还发现CR、PR、PD患者化疗前后血清CA125、TAP水平及其下降比比较,差异有统计学意义,SD患者化疗前后血清CA125、TAP水平及其下降比比较基本相同,此与王雪冰、王纯等[16-17]的研究结果基本相同,表明血清TAP、CA125水平与化疗疗效有关。这有可能FOLFOX4化疗可有效抑制或杀死尚未转移及恶化的癌细胞,从而提高肿瘤周围正常细胞的生存环境,激活了糖基转移酶、糖苷酶等糖基化修饰酶,从而调节了细胞膜表面的聚糖结构,继而降低了TAP、CA125的水平。而化疗无效的患者,可能由于奈达铂联合多西他赛的化疗无法抑制机体的癌细胞,从而使其持续扩散侵袭,导致机体不断释放TAP、CA125。此外,本研究在评估NSCLC化疗有效性的效能分析上,发现TAP联合CA125的效能度明显高于单独检测,表明血清TAP和CA125联合检测能够准确的评估NSCLC患者的化疗疗效。故本研究建议NSCLC患者经治疗后,可进行TAP、CA125检测以评估疗效。若其水平不降反升,则可能需要进行其他治疗。
综上所述,NSCLC化疗前后血清CA125、TAP水平变化与疗效有关,检测血清CA125、TAP水平可作为评估患者化疗疗效的重要指标,且二者联合时具有更佳的效能。

