培养学生“模型认知”能力的实验教学
华丽芬
江苏省前黄高级中学国际分校(213161)
“模型认知”是高中化学学科的核心素养之一,其内涵为通过分析、探究等方法认识研究对象的本质特征、构成要素及其相互关系,建立认知模型,并能运用模型解释化学现象,揭示现象的本质和规律。“化学反应速率”是高中生认识化学反应的重要角度,体现了化学学科核心概念中的“变化观”。本文以苏教版化学1“探究影响化学反应速率的因素”为主题,基于“联系生活提出问题-实验探究建立模型-运用模型解决问题”的教学流程探讨如何培养高中学生“模型认知”能力。
1 教学过程
1.1 联系生活提出问题
“化学反应有快有慢”是学生已有的认知,如节日的烟花转瞬即逝而钟乳石的形成却是一个漫长的过程;炎热天气食物容易腐败而放入冰箱可以保存更长时间。那么“铁生锈”是快反应还是慢反应?当老师提出这个问题后,学生众说纷纭,有的认为是慢反应,理由是:①跟烟花相比很慢,②不锈钢制品很难生锈;有的认为是快反应,理由是:①跟钟乳石的形成相比很快,②厨房里的铁锅水渍没有擦干隔天就会生锈。在看似矛盾的答案中,学生发现1个问题:化学反应的快慢是相对的,不同研究对象、不同环境条件、不同观察者看到的现象各不相同。那么如何更科学地进行反应快慢的比较呢?
1.2 实验探究建立模型
学生的实验桌上有以下实验用品:镁条和铁片(形状大小相同),碳酸钙(块状、粉末状),二氧化锰粉末,盐酸(0.5 mol/L,3 mol/L),H2O2溶液(2%),碳酸饮料(雪碧)。试管、针筒(20 mL)、药匙、胶头滴管、酒精灯、试管夹、火柴。面对如此众多的实验用品,有的学生一会儿拿了这个瓶子看看,一会儿又去拿另一个瓶子看看,不知如何下手。有的学生想都不想拿起试管就倒试剂,有的直接拿出火柴点燃了酒精灯……教师笑而不语,静观其变。两分钟后,有学生放下了手里的实验用品,一边在纸上写写画画,一边还在跟同桌交流。教师请这位同学说说为什么不继续做实验?学生说:我用了0.5 mol/L的盐酸和粉状碳酸钙反应,同桌用了3 mol/L的盐酸和块状碳酸钙反应,我们2支试管中产生气泡一样快。我觉得这样比较没有意义,所以就先停下来再想想怎么比较。
学生的学习兴趣需要教师的悉心呵护,学生的实验探究能力需要教师的方法引导。教师这样引导学生:
教师:你想研究哪个反应的快慢?
学生:盐酸与碳酸钙反应。
教师:你想研究哪个因素?
学生:浓度、温度、接触面积都可以吧。
教师:能同时研究几个因素吗?
学生:好像不行。
教师:那你怎样保证每次只研究1个因素?
学生:(思考一会之后回答)我可以用等体积0.5 mol/L的盐酸和3 mol/L的盐酸同时跟等量的粉末状碳酸钙反应然后看产生气泡快慢。
教师:其它因素怎么研究呢?
学生:我还可以用0.5 mol/L的盐酸分别和块状碳酸钙、粉末状碳酸钙反应看产生气泡的快慢。
教师:请继续你的研究吧!
模型认知是一种具有描述、分析、解释、预测等功能的科学方法,学生在教师的逐步引导下建立了探究反应规律的认知模型:首先确定研究对象,即要研究对哪个化学反应的影响,是研究碳酸钙与盐酸的反应,还是双氧水分解的反应,抑或是金属与酸的反应。其次确定自变量和因变量,即要研究哪个因素对化学反应快慢的影响,是研究温度影响,还是浓度、压强、催化剂影响,抑或是接触面积的影响。然后设计实验操作改变单一自变量,即要设计实验如何只改变1个条件,选择温度影响就要用到酒精灯(常温与加热条件),选择浓度影响就要用到不同浓度的盐酸(0.5 mol/L,3 mol/L),选择压强影响就要用到碳酸饮料与针筒(常压与加压条件),选择催化剂影响就要用到二氧化锰粉末,选择接触面积影响就要用到不同形态的碳酸钙(块状、粉末状)。最后观察实验现象得出结论。学生利用“控制变量”思维模型进行实验探究过程如图1和表1所示。
图1 “控制变量”思维模型

表1 探究影响化学反应速率的因素
设计实验方案探究化学反应速率的影响因素,使学生认识到物质自身的性质会影响化学反应的快慢,通过改变外界条件(浓度、温度、压强、催化剂、接触面积等)可以调控化学反应的快慢。帮助学生初步形成实验探究化学反应规律的思路方法,提高利用控制变量思想设计实施实验的能力。
2 运用模型解决问题
问题1:工业上采用接触法制取硫酸,下列工艺的设计分别利用或体现了哪些影响反应速率的因素?
①沸腾炉中:将矿石粉碎后送入炉内;鼓入足量空气沸腾焙烧;②接触室中:反应温度为400~500 ℃,V2O5作催化剂;③吸收塔中:用98.3%浓硫酸喷淋吸收SO3。
设计意图:此题主要诊断学生是否掌握调控化学反应快慢方法,同时让学生认识到调控化学反应快慢在工业生产中的重要作用,体会化学科学对社会发展的贡献。
问题2:某化学兴趣小组欲测定KClO3溶液与NaHSO3溶液反应的化学反应速率。所用试剂为10 mL 0.1 mol/L KClO3溶液和10 mL 0.3 mol/L NaHSO3溶液(已知:ClO3-+3HSO3-=Cl-+3SO42-+3H+)。某同学分析实验数据后发现,反应过程先快后慢。该组同学针对这一现象进一步通过测定c(Cl-)随时间变化的曲线探究影响因素,具体如表2所示。
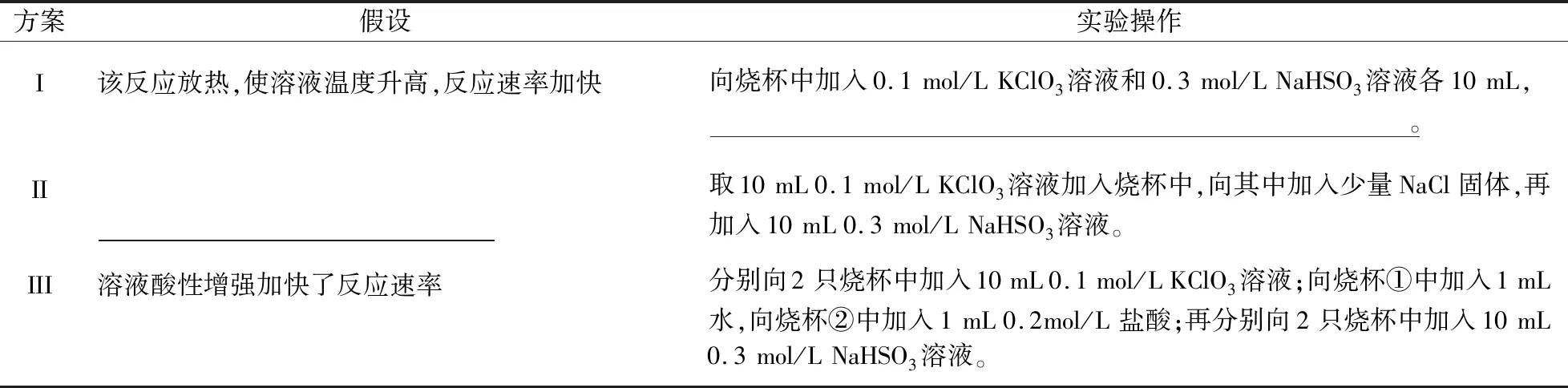
表2 实验过程
①I中实验操作为____________;II中假设为____________。
②除I、II、III中的假设外,还可以提出的假设是____________。
③在已知方案I的假设不成立的情况下,某同学从控制变量的角度思考,认为方案III中实验操作设计不严谨,请进行改进:____________。
④反应后期,化学反应速率减小的原因是____________。
设计意图:此题探究化学反应速率的影响因素,帮助学生初步形成了实验探究化学反应规律的思路方法,建立认知模型,此题主要诊断学生能否较为熟练地运用“控制变量”思维模型进行学习迁移、解决实际问题的能力。①方案I中反应放热,使溶液温度升高,反应加快,因此需要测量反应过程中溶液温度的变化,则实验操作为插入温度计;方案Ⅱ与方案I相比较加入了少量NaCl固体,所以方案Ⅱ中的假设为生成的Cl-加快了化学反应。②由于反应中还有SO42-生成,还可以假设生成的SO42-加快了化学反应。③为防止Cl-对实验的干扰,需要改进的措施是将1 mL水改为1 mL 0.2 mol/L NaCl溶液。④反应进行到后期,由于反应物浓度一直在减小,所以化学反应速率也减小。
3 研究感悟
“化学反应速率”的知识内容在高中化学必修课程中的教学要求是学生认识化学反应速率的概念,了解温度、催化剂等因素对化学反应的影响,所以在常规教学中,教师可能会将化学反应速率的计算公式直接告诉学生,接着做几个演示实验,象征性地给学生看看,然后布置几道题让学生练习巩固一下就结束了。本节课通过实验探究化学反应速率的影响因素,将学生感性的、模糊的认识上升为系统化、结构化的知识,通过建立模型并运用模型让学生体会控制变量的研究方法,促进了深度学习,也进一步锻炼了学生实验设计与操作能力,发展了创造性思维与批判性思维。

