纯铁在均匀液膜下的CO2腐蚀机制
李 强, 张玉瑜, 刘 刚,, 朱铁燕, 唐 晓, 李 焰
(1.山东省油气储运安全重点实验室,山东青岛 266580;2.中国石油大学(华东)储运与建筑工程学院,山东青岛 266580;3.中国石油大学(华东)材料科学与工程学院,山东青岛 266580)
CO2腐蚀是管道内腐蚀破坏最重要的类型之一[1],而水的存在是CO2腐蚀的必要条件。在湿气管道内,输送介质中夹带的自由水[2]以及管道沿程温度和压力变化导致的凝析水共同形成了CO2腐蚀所需的水环境。此外,水可与气流形成低持液率气液两相流,在气体流速、管道倾角等因素[3-4]的影响下,以液膜形式分布于管道内壁的不同位置,引发局部位置的腐蚀破坏[2,5-6]。尽管已认识到液膜对腐蚀行为的重要影响[5,7],但由于相关研究开展较少,对液膜环境下CO2腐蚀机制的认知还非常有限。张今朝[8]、Guan等[9]的研究表明,当液膜厚度在一定范围内改变时,X80钢的腐蚀将由高度局部化的点蚀向均匀腐蚀发展。Qian等[10]研究了X52钢在含饱和CO2的模拟凝结液膜中的腐蚀行为,指出当液膜厚度由100 μm增大到1 000 μm时,腐蚀阴极过程由活化控制转变为传质控制,腐蚀速率随液膜厚度的增加而增大。笔者设计、搭建可实现温湿度控制、液膜厚度表征与控制以及三电极电化学测试的试验装置,采用纯铁开展试验测试(旨在消除材料因素的干扰[11]),借助极化曲线与电化学阻抗谱(EIS)技术,研究纯铁在均匀液膜下的CO2腐蚀电化学机制。
1 试验方案
1.1 试验溶液
试验溶液采用质量分数为1% NaCl溶液,由去离子水(电阻率为0.78 MΩ·cm)和分析级NaCl试剂配置而成。试验前,分别采用100% CO2与5% CO2+95% N2(简称5% CO2)气体(对应CO2分压分别为0.1和0.05 MPa)对溶液除氧,除氧时间不低于4 h,然后密封待用。试验温度为25 ℃,测得该温度下溶解100% CO2与5% CO2的溶液pH分别为3.98和5.1。
1.2 试验材料
工作电极(WE)材料选用质量分数为99.999%的纯铁,经线切割加工成尺寸为5 mm×5 mm×5 mm的方块。
为消除传统参比电极(RE)对液膜测试体系的影响,参比电极选用质量分数大于99.995%的锌[12]。实际选用直径为1 mm的高纯锌丝(99.998%),其开路电位在溶解100% CO2与5% CO2的溶液环境中都可以很快地达到稳定状态,且最终稳定电位相对于标准氢电极(SHE)分别为-0.806和-0.862 V。
纯铁电极块一侧先与铜导线焊接,然后与高纯锌丝共同经环氧树脂固化封装成组合电极,其中纯铁电极工作面积为25 mm2,纯铁电极与锌丝距离为2 mm。组合电极工作面由200号水磨砂纸逐级打磨至1200号,再用丙酮和蒸馏水清洗,经冷风吹干后放入干燥皿中备用。
对电极(CE)选用高纯铂丝(99.99%),测试前将其沿组合电极外围环绕一周。
1.3 试验装置
设计、搭建了如图1所示的液膜腐蚀电化学测试装置。电解池轴向竖直截面呈“W”形,通过预设的支座将电解池固定于环境箱内。环境箱底板设有调平螺钉,以确保组合电极工作面处于水平状态。箱体顶盖包含外盖、内盖两个部分,其下端面均采用倒“V”形设计,以确保凝结液滴不会掉落进电解池。外盖上安装有温湿度组合探头与航空插头,分别用于温湿度测试导线与对电极导线的外接;内盖则用于添加试验溶液,测量液膜厚度。环境箱外壁包覆电加热带,用于箱体加热。试验前,在环境箱底部预装一定量预先除氧并预热到试验温度的蒸馏水,同时从进气口通入试验用气体对预装蒸馏水鼓泡。该方法可排尽环境箱内空气,并可在25 ℃时实现环境箱内湿度维持在85 %。试验过程中持续通入试验用气体。
液膜厚度测量采用探针电流差法[9]进行。由图1可见,当探针向下移动并依次接触溶液和电极表面时,电流表读数会发生两次突变,记录电流突变时探针所处的高度,其高度差值即为液膜厚度。选用自行搭建的可同时实现X轴、Y轴运动的电动位移平台对探针移动距离进行控制,探针移动精度为1 μm。
1.4 电化学测试
首先开展开路电位测试,待开路电位稳定(5 min内电位变化小于2 mV),再分别在开路电位下开展EIS及极化曲线测试。EIS测试中,激励信号幅值为10 mV,测试频率为10-2~105Hz。极化曲线扫描区间为相对开路电位-0.25~0.25 V,扫描速率为0.333 mV/s。选取EIS测试结果拟合得到的溶液电阻对极化曲线测试中的欧姆降进行补偿。

图1 液膜腐蚀电化学测试装置示意图Fig.1 Schematic diagram of testing setup for corrosion electrochemical testing under water film conditions
2 试验结果
2.1 纯铁在100% CO2环境不同厚度液膜
纯铁在100% CO2环境不同厚度均匀液膜中的极化曲线见图2。腐蚀电位受液膜厚度影响较小,基本维持在-500 mV附近。阴、阳极电流密度受到液膜厚度影响较显著,尤其是阴极电流密度。在所有液膜厚度下,阴极区都出现了极限扩散电流,这表明阴极过程受到扩散控制;阳极区整体则表现为活化控制,仅在微小的电位区间内出现了活化向钝化的转变现象。
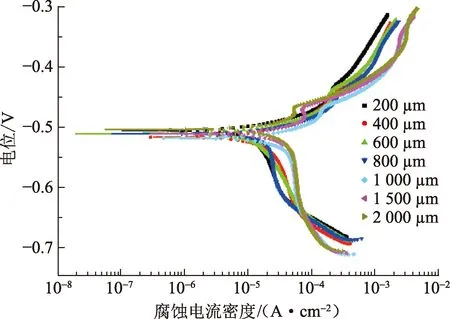
图2 纯铁在100%CO2环境不同厚度液膜中的极化曲线Fig.2 Polarization curves of pure Fe in 100% CO2 and varied water film thickness conditions
对阴极区极限扩散电流密度进行线性拟合,拟合得到的直线与腐蚀电位的交点对应为纯铁的腐蚀电流密度[13]。经法拉第定律公式计算,可得到纯铁在100% CO2环境不同厚度均匀液膜中的腐蚀速率,如图3所示。当液膜厚度由200 μm增长到1 000 μm时,纯铁的腐蚀速率整体随液膜厚度的增加而增大,但在400 μm时腐蚀速率发生突增。液膜厚度大于1 000 μm时,腐蚀速率基本保持不变。
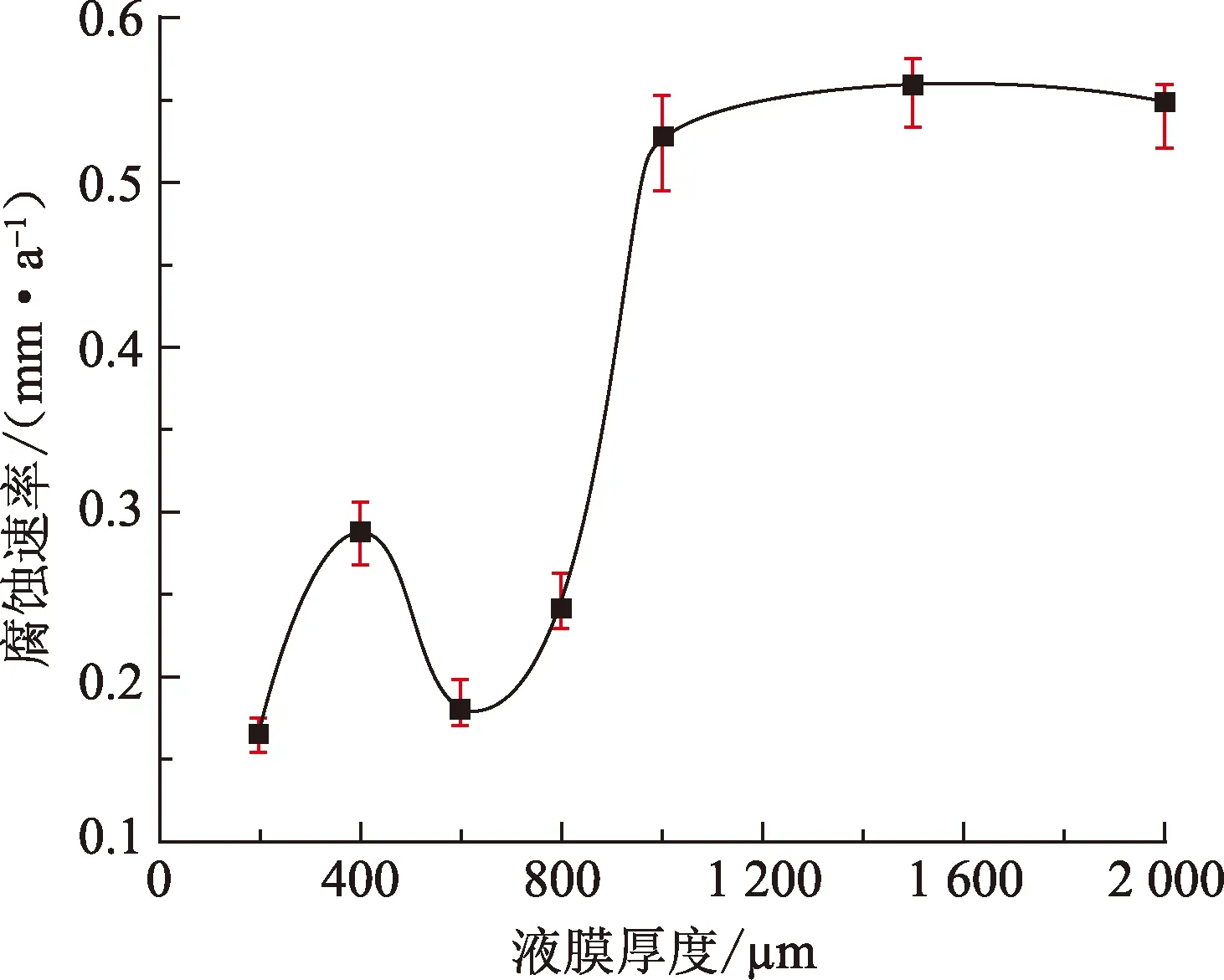
图3 纯铁在100%CO2环境中腐蚀速率随液膜厚度变化Fig.3 Corrosion rates of pure iron as a function of water film thicknesses in 100% CO2
图4为纯铁在100%CO2环境不同厚度均匀液膜中的EIS测试结果。在所有液膜厚度下,阻抗谱都是由一个高频区容抗弧和一个低频区感抗弧组成。其中液膜厚度为200 μm时,容抗弧半径最大;而液膜厚度大于等于1 000 μm时,容抗弧半径则均较小。采用如图5所示的等效电路对阻抗谱进行拟合,拟合结果见表1。图5中Rs为溶液电阻,CPE为常相位角元件(CPE的阻抗可计算为ZCPE=Y0-1(jω)-1),Rct为电荷转移电阻,L为电感,RL为感应电阻。
由表1可知,溶液电阻随液膜厚度的增加而减小,这是由于工作电极与参比电极之间的溶液截面积增大,溶液导电能力增强。随液膜厚度增大,电荷转移电阻整体呈减小趋势,但液膜厚度为400 μm时的电荷转移电阻要小于液膜厚度为600 μm时的电荷转移电阻。液膜厚度大于1 000 μm时,电荷转移电阻不再显著变化。由于腐蚀速率与电荷转移电阻呈反比关系,可知腐蚀速率随液膜厚度的增大而整体呈增大趋势,液膜厚度在400~600 μm时腐蚀速率局部降低,液膜厚度大于1 000 μm时腐蚀速率维持基本不变。显然,EIS测试结果所反映的腐蚀速率随液膜厚度的变化规律与极化曲线测试结果基本一致。
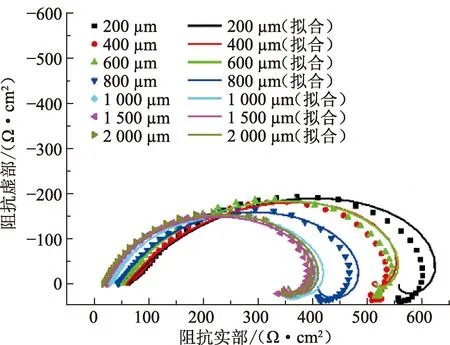
图4 纯铁在100%CO2不同厚度均匀液膜中的电化学阻抗谱Fig.4 EIS plots of pure Fe in 100% CO2 and varied water film thickness conditions
表1 不同液膜厚度下的EIS拟合结果(100%CO2)
Table1FittedparametersofpureFein100%CO2andvariedwaterfilmthicknessesconditions
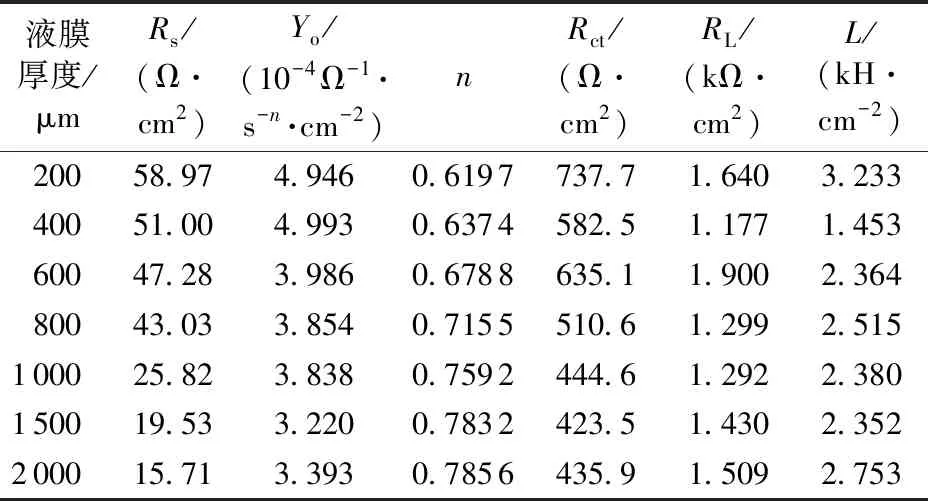
液膜厚度/μmRs/(Ω·cm2)Yo/(10-4Ω-1·s-n·cm-2)nRct/(Ω·cm2)RL/(kΩ·cm2)L/(kH·cm-2) 20058.974.9460.6197737.71.6403.233 40051.004.9930.6374582.51.1771.453 60047.283.9860.6788635.11.9002.364 80043.033.8540.7155510.61.2992.515 100025.823.8380.7592444.61.2922.380 150019.533.2200.7832423.51.4302.352 200015.713.3930.7856435.91.5092.753
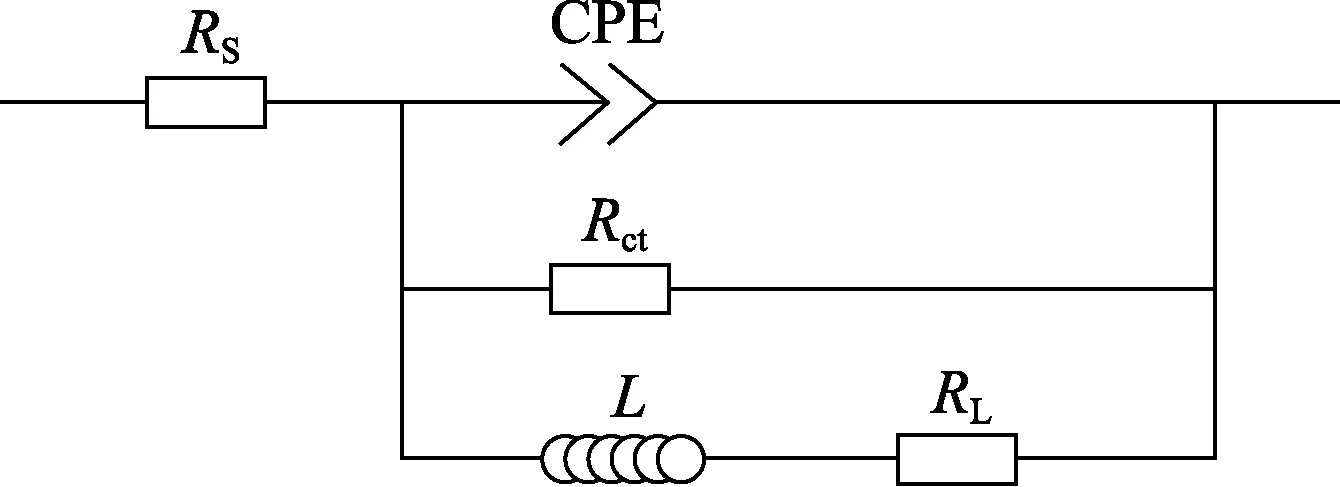
图5 等效电路图Fig.5 Equivalent circuit diagram
2.2 纯铁在5% CO2环境不同厚度液膜
开展纯铁在5% CO2环境不同厚度均匀液膜中的腐蚀电化学测试,其中极化曲线测试结果如图6所示。不同厚度液膜中的腐蚀电位均在-0.535 V附近,较100% CO2环境下的腐蚀电位整体负移约35 mV。在5% CO2环境不同厚度的均匀液膜中,阳极曲线仅在液膜厚度较薄时出现微弱的活化-钝化转变迹象,整体表现为活化控制。阴极过程都表现为扩散控制。同样采用拟合方法获取腐蚀电位下的极限扩散电流密度,并计算得到不同厚度液膜中的腐蚀速率,如图7所示。在5% CO2环境下,液膜厚度由200 μm增大到1 000 μm时,腐蚀速率整体增大;但在400 μm时出现腐蚀速率的突增。液膜厚度大于1 000 μm时,腐蚀速率则基本维持不变。这些变化规律都与100% CO2环境下的极化曲线测试结果基本一致。但是,在5% CO2环境下纯铁的腐蚀速率都要小于100% CO2环境。此外,在液膜厚度为400 μm时,5% CO2环境下纯铁的腐蚀速率大于液膜厚度为1 000 μm甚至更大时的腐蚀速率,这与100% CO2环境下的测试结果截然相反。
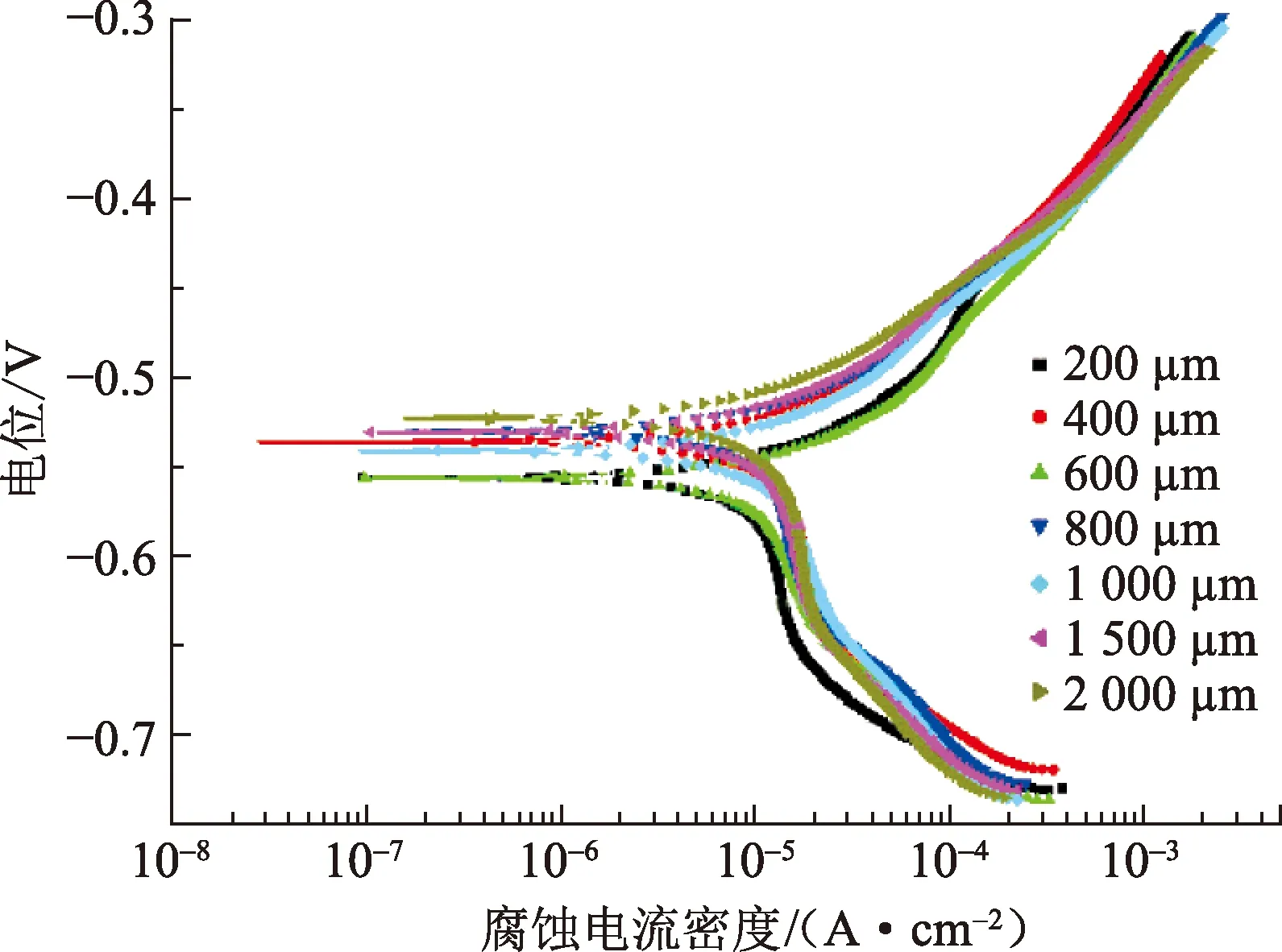
图6 纯铁在5%CO2不同液膜厚度下的极化曲线Fig.6 Polarization curves of pure Fe in 5% CO2 and varied water film thickness conditions
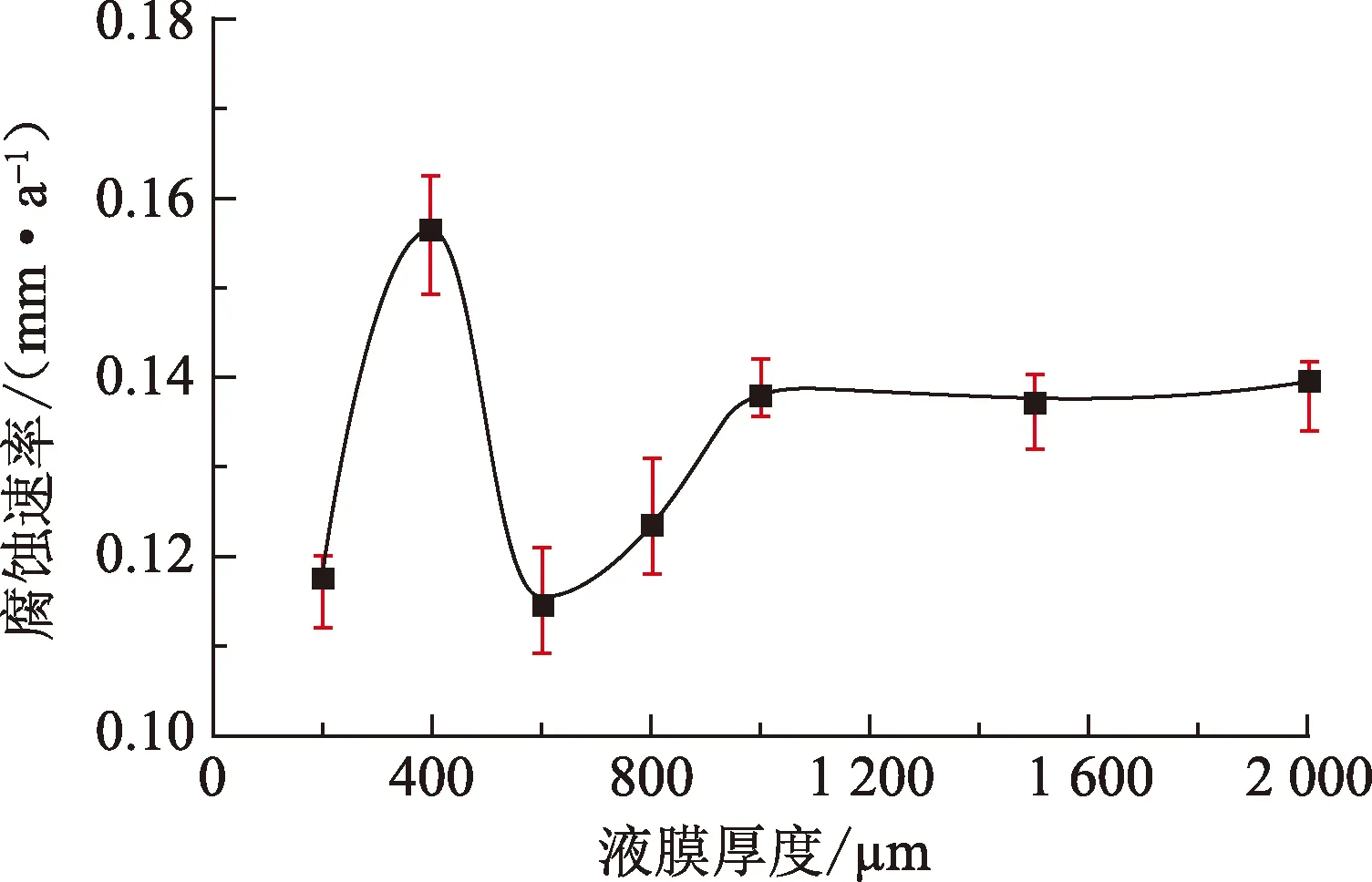
图7 纯铁在5%CO2环境中腐蚀速率随液膜厚度的变化Fig.7 Corrosion rates of pure iron as a function of water film thicknesses in 5% CO2
图8为纯铁在5%CO2环境不同厚度均匀液膜中的EIS测试结果。电化学阻抗谱同样包括一个容抗弧和一个感抗弧,容抗弧最大半径对应液膜厚度600 μm,而最小半径则对应液膜厚度400 μm。采用图5所示等效电路进行阻抗谱拟合,结果见表2。分析可知,由电荷转移电阻反映的腐蚀变化规律基本等同于由极化曲线得到的规律。
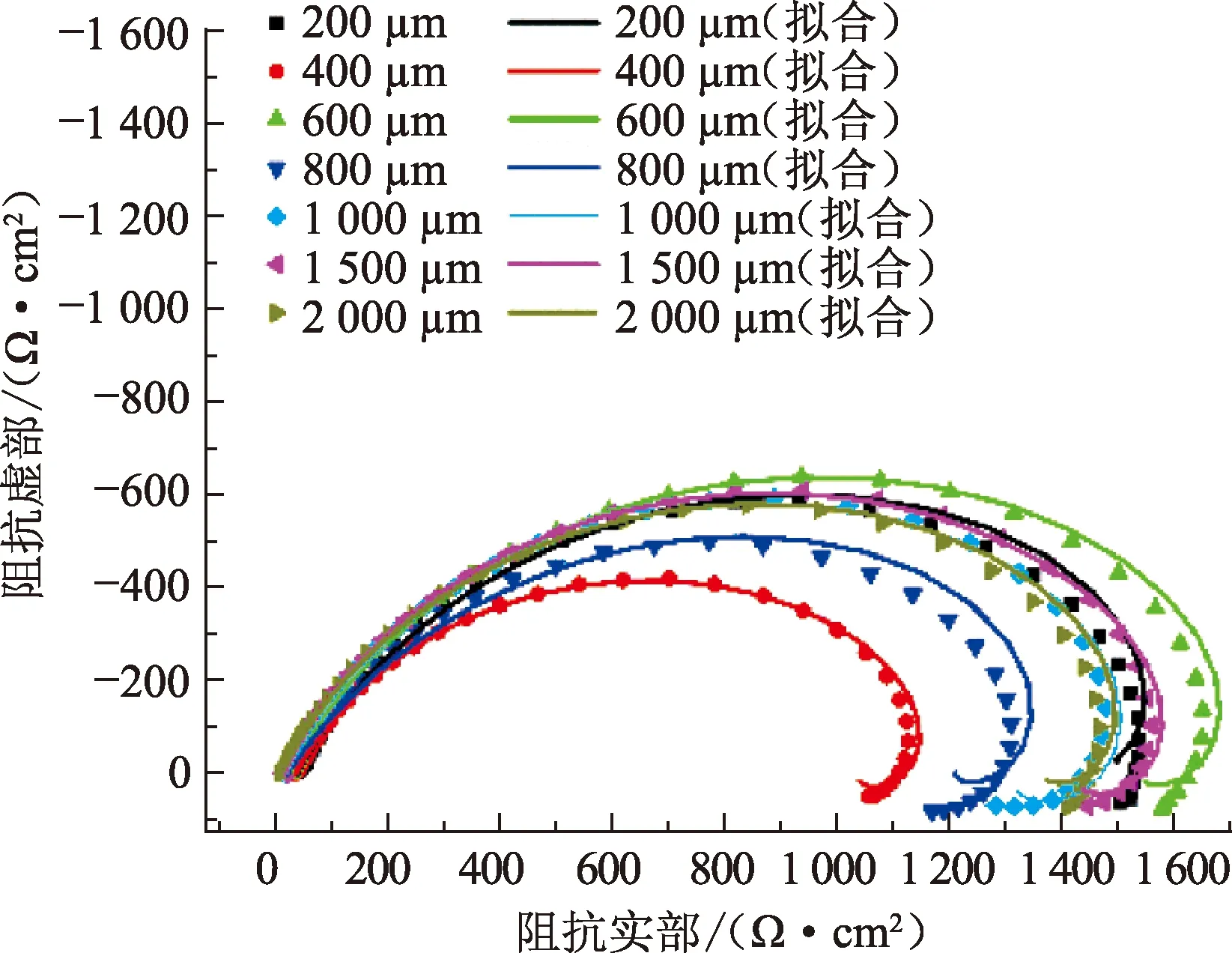
图8 纯铁在5%CO2不同厚度液膜中的电化学阻抗谱Fig.8 EIS plots of pure Fe in 5% CO2 and varied water film thicknesses conditions
表2 不同液膜厚度下EIS拟合参数(5%CO2)
Table2FittedparametersofpureFein5%CO2andvariedwaterfilmthicknessesconditions
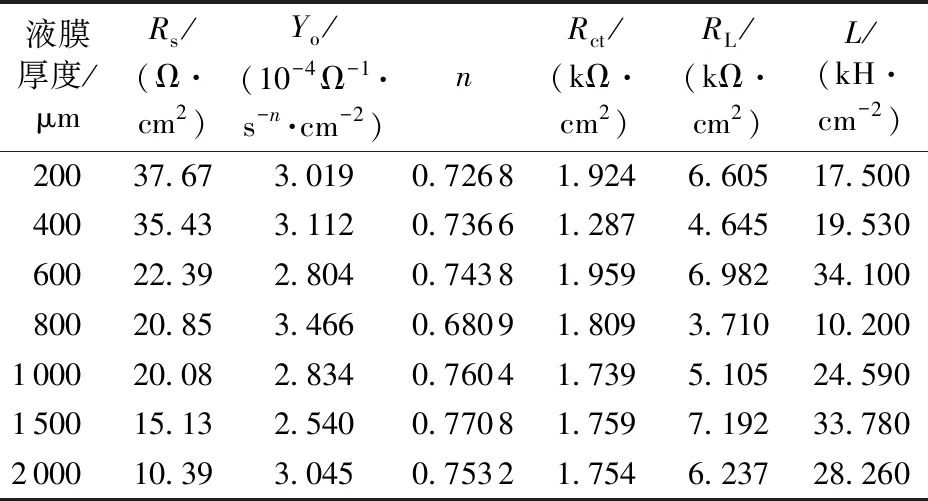
液膜厚度/μmRs/(Ω·cm2)Yo/(10-4Ω-1·s-n·cm-2)nRct/(kΩ·cm2)RL/(kΩ·cm2)L/(kH·cm-2) 20037.673.0190.72681.9246.60517.500 40035.433.1120.73661.2874.64519.530 60022.392.8040.74381.9596.98234.100 80020.853.4660.68091.8093.71010.200 100020.082.8340.76041.7395.10524.590 150015.132.5400.77081.7597.19233.780 200010.393.0450.75321.7546.23728.260
3 讨 论
3.1 液膜中的CO2腐蚀机制
CO2腐蚀体系下,阳极过程为铁的氧化反应为

(1)
该反应又分为多个连续的子步骤[14],其中中间产物FeOHads可导致电化学阻抗谱图中感抗弧的存在[10]。阴极过程跟溶液pH有关,由于当前100% CO2与5% CO2环境下的pH分别为3.98和5.1,阴极反应将主要为氢离子和碳酸的还原反应[15]:

(2)

(3)
由于100% CO2与5% CO2环境下的阴极过程都受扩散控制,因而H+和H2CO3向金属表面的扩散速率决定了阴极反应速率,也同时决定了纯铁的腐蚀速率。
对于受扩散控制的腐蚀过程,工作电极表面会存在一扩散层。在扩散层内液膜厚度越小,传质速率越快,反之则越慢。当液膜厚度大于扩散层厚度,传质速率则不随液膜厚度的改变而显著变化。据此推断,当前研究体系下的扩散层厚度都要小于1 000 μm。
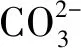

(4)
FeCO3在金属壁面的沉积成膜可抑制电化学反应物质向金属壁面的传质,减少金属壁面的活性区域,进而降低金属的腐蚀速率[16]。但仅有致密的FeCO3产物膜才能有效抑制腐蚀速率,这就要求FeCO3的生成速率足够快,或者其过饱和度大于1。FeCO3的过饱和度(SFeCO3)可表示为
(5)
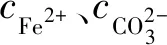

表3 25 ℃时FeCO3、CO2的溶解度与离子强度关系Table 3 Solubility of FeCO3 and CO2 as a function of ionic strength at 25 ℃
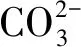
CO2在液膜中的溶解度也会受到离子浓度的影响。根据模型公式[18]计算得到温度为25 ℃不同离子强度下的CO2溶解度(Ksol),见表3。可见,CO2溶解度随离子强度的增大而显著减小。当溶解的CO2减少,CO2水化及电离反应生成的碳酸与氢离子也相应地减少,扩散速率将因此而降低。所以,随液膜厚度的减小,阴极极限扩散电流密度并不会单一地升高;而是在某一液膜厚度下出现极大值,然后随液膜厚度减小而减小。当前研究发现,液膜厚度为400 μm时,极限扩散电流密度出现极大值,这与Guan等[9]测得的最大总阳极电流密度出现在液膜厚度为350 μm的试验结果较为一致。由此可以推断,液膜厚度低于400 μm时,腐蚀行为受到CO2溶解度的显著影响,这种影响将在液膜厚度大于400 μm时减弱。
当液膜厚度由400 μm增加到1 000 μm时,腐蚀速率先减小后增加,这主要归结为腐蚀产物膜的影响[10]。由400 μm增加到600 μm时,液膜厚度较薄,腐蚀产物膜较容易生成,对腐蚀速率的抑制作用明显;由600 μm到1 000 μm时,腐蚀产物膜的生成速率逐渐降低,对腐蚀速率的抑制也逐渐减弱。
3.2 CO2分压对纯铁腐蚀行为的影响
在CO2腐蚀体系下,氢离子还原(式(2))或碳酸还原(式(3))反应的平衡电位均可表示为
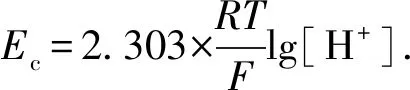
(6)
式中,Ec为阴极平衡电位,V;R为理想气体常数,8.314 J·mol-1·K-1;T为绝对温度,K;F为法拉第常数,96 485 C/mol;[H+]为氢离子活度,mol·L-1。
当溶液pH发生改变时,阴极反应的平衡电位也会发生改变,并导致腐蚀电位的变化。本研究中100% CO2与5% CO2环境下溶液pH相差1.12,对应阴极平衡电位负移应为66 mV,大于35 mV。由此推断,除腐蚀电位外,5% CO2环境下纯铁表面的阴、阳极反应动力学参数较100%CO2环境也有所差异。
对比100% CO2与5% CO2环境,100% CO2环境下的腐蚀速率整体更大,这是由于液膜中溶解了更多的CO2,pH也更低,因而阴极反应速率更快。此外,当CO2分压升高,腐蚀产物膜的生成速率也会越大[19],尤其是在较薄的液膜环境下。鉴于此,在100% CO2环境下液膜厚度为400 μm时的腐蚀速率小于液膜厚度为1 000 μm时;而在5% CO2环境下则截然相反,这种差异可归结于两种环境下腐蚀产物膜的生成速率不同,进而腐蚀速率受抑制程度也有所不同。
4 结 论
(1)液膜下的CO2腐蚀过程受阴极扩散控制,同时还受到CO2溶解度与腐蚀产物膜的影响。
(2)CO2腐蚀体系下,电极表面扩散层厚度小于1 000 μm,因而当液膜厚度大于1 000 μm时,纯铁的腐蚀速率不再随液膜厚度增加而发生显著变化。
(3)液膜厚度小于1 000 μm时,腐蚀速率的主导因素因液膜厚度而异。液膜厚度小于400 μm时,CO2在液膜中的溶解度是制约腐蚀速率的重要因素;液膜厚度在400~1 000 μm时,腐蚀产物膜则成为影响腐蚀速率的主要因素。
(4)升高CO2分压可加快纯铁的腐蚀速率,同时又可以在薄层液膜环境下加快腐蚀产物膜的生成。

