急性高白细胞白血病临床特点回顾性分析
刘 盼,刘明辉,周芙玲
武汉大学中南医院血液内科(武汉 430000)
急性高白细胞白血病是一种血液系统恶性肿瘤急症,指外周血白细胞计数≥100×109/L,占每年新发白血病病人总数的10%-20%[1],表现出高的早期并发症及临床病死率。急性高白细胞白血病占白血病总数的10% -20%,占急性白血病的7.3%-8.5%[2],在急性髓系白血病的发生率为 5%-13%,M4及M5是最常见的类型[3]。如果没有经过积极的治疗,其1周病死率可以达到40%[4]。高白细胞白血病发病机制还不清楚,免疫调节及基因异常表达在其发病及进展中起到非常重要的作用。高白细胞白血病较非高白细胞白血病患者骨髓增殖明显活跃,与外周血白细胞计数呈正相关,且存在更低的血红蛋白及血小板(P<0.05)[5]。细胞间粘附分子-1(ICAM-1)和淋巴细胞相关抗原-1(LFA-1)影响白血病细胞与毛细血管内皮细胞的粘附、瘀滞等[6]。白血病细胞瘀滞在微循环中,形成微血栓,竞争氧气,损伤血管内皮,释放可溶性细胞因子,进一步向血管周围转移。RB1和CDKN2A基因的缺失[7],11q23 异位或Ph染色体阳性的患者更容易出现白细胞升高[8]。口服羟基脲及细胞单采技术是目前快速降低白细胞负荷常用的治疗手段[9-10]。本研究主要对我院65例初诊高白细胞白血病临床资料进行回顾性分析,旨在为高白细胞白血病患者预后及早期干预提供临床依据。
1 资料和方法
1.1 病历资料与治疗方法
我院2011年10月31日到2018年4月19日65例(男30,女35)初诊急性高细胞白血病病人,定义白细胞总数>100×109/L为高白细胞白血病,白细胞总数≥200×109/L为超高白细胞白血病,诊断均参照张之南等《血液病诊断与疗效标准》第三版,随访至2018年4月19日,其中高白细胞白血病为46例,超高白细胞白血病为19例。60岁以上者为37人,中位年龄为58岁(12-87岁)。按FAB分型:急性髓细胞性白血病(Acute myeloid leukemia,AML)M1 8例,M2 10例,M3 3例,M4 3例,M5 25例,ALL 15例,未分型1例。14例患者出现早期出血表现(6例患者出现颅内出血,4例消化道出血,2例皮肤出血,1例泌尿系出血,1例弥漫性血管内凝血)。收集患者住院基本信息以及临床资料包括:总生存时间(OS)、白细胞计数、红细胞计数、血红蛋白、血小板计数、谷丙转氨酶、谷草转氨酶、肌酐、D二聚体、凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)、纤维蛋白原(FIB)、肌酸激酶同工酶(CKMB)、乳酸脱氢酶(LDH)、呼吸衰竭、心力衰竭、肺部感染。入院后给予羟基脲(2-6g/d)或白细胞单采,同时给予充分碱化水化治疗,加强支持对症,白细胞达到20×109/L开始进行诱导化疗。
1.2 统计学处理
分析急性高白细胞白血病与极高白细胞白血病临床特点,羟基脲及单采技术的应用对于患者血常规的影响,采用Kaplan-Meier法生存分析、相关性分析及COX回归分析患者死亡的相关因素,SPSS 20.0处理所有数据,用比值比 (OR)表示, 计算 0R值的95% 可信区间并进行显著性检验, 以α取0.05作为假设检验水准, 以P≤0.05为差异有统计学意义。
2 结果
2.1 基本临床特征
65例急性高白细胞白血病患者中,1周内死亡17例(26.2%),28天死亡38例(58.5%),3个月内死亡49例(79.4%)。急性高白细胞白血病与超高白细胞白血病在OS、白细胞计数、CKMB、LDH上存在显著性差异(P<0.05),其临床数据分析见表1。
2.2 生存分析
使用寿命表法对患者进行生存率分析,1年总生存率为15%,3年总生存率为12%,中位生存时间为28.13天。Kaplan-Meier 法生存分析显示,患者的性别、红细胞计数、血红蛋白、血小板计数、谷丙转氨酶、谷草转氨酶、肌酐、PT及FIB差异均无统计学意义。白细胞计数、年龄、D二聚体、LDH有统计学差异,如图1所示。
2.3 相关分析
对收集的临床资料进行相关性分析显示,心肺功能、凝血功能受损与患者的死亡存在显著相关性,白细胞计数越高生存期越短,如表2。同时进行COX回归分析,研究患者生存时间的影响因素,结果显示年龄、白细胞计数、心力衰竭、肺部感染及LDH是患者死亡的独立影响因素,如表3。
2.4 治疗效果分析
高白细胞的瘀滞是临床早期死亡的重要因素,积极降低肿瘤负荷,减少化疗引起的肿瘤溶解综合征风险,是治疗的关键,白血病细胞迅速增高的同时伴有严重的贫血及低血小板,羟基脲及单采的治疗可以有效的降低白细胞总数,但对血红蛋白及血小板同样存在影响,我们对使用羟基脲及单采前后血常规进行配对样本T检验,结果如表4。
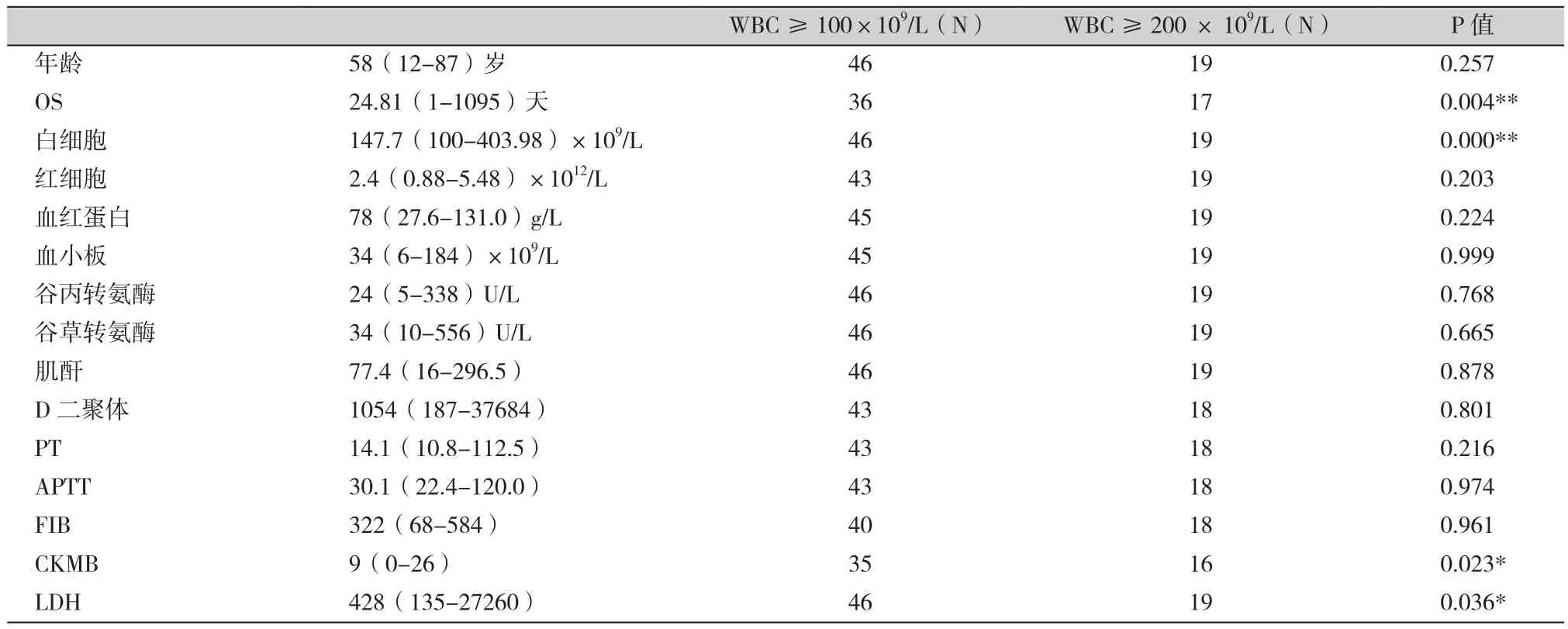
表1 高白细胞白血病与超高白细胞白血病临床数据分析Table 1. Analysis of clinical data of high leukemia and ultra high leukemia
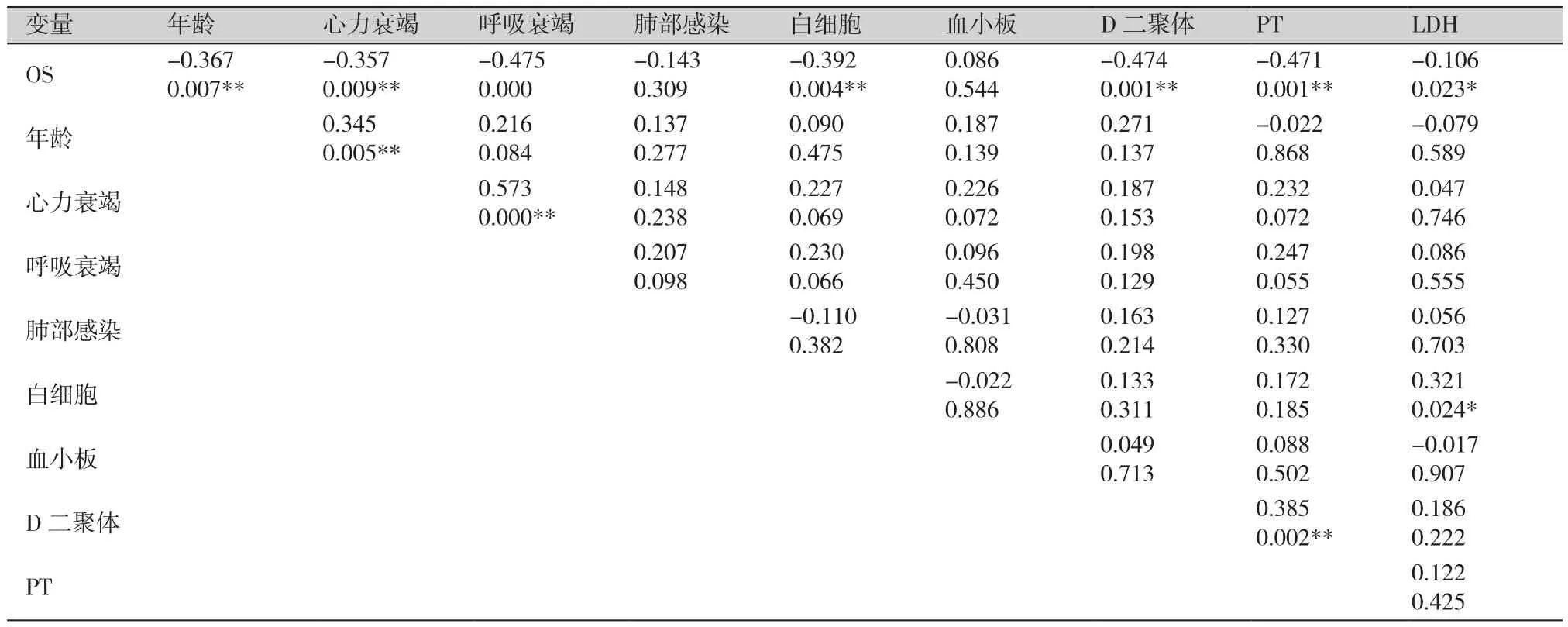
表2 几种临床数据的相关性分析Table 2. Correlation analysis
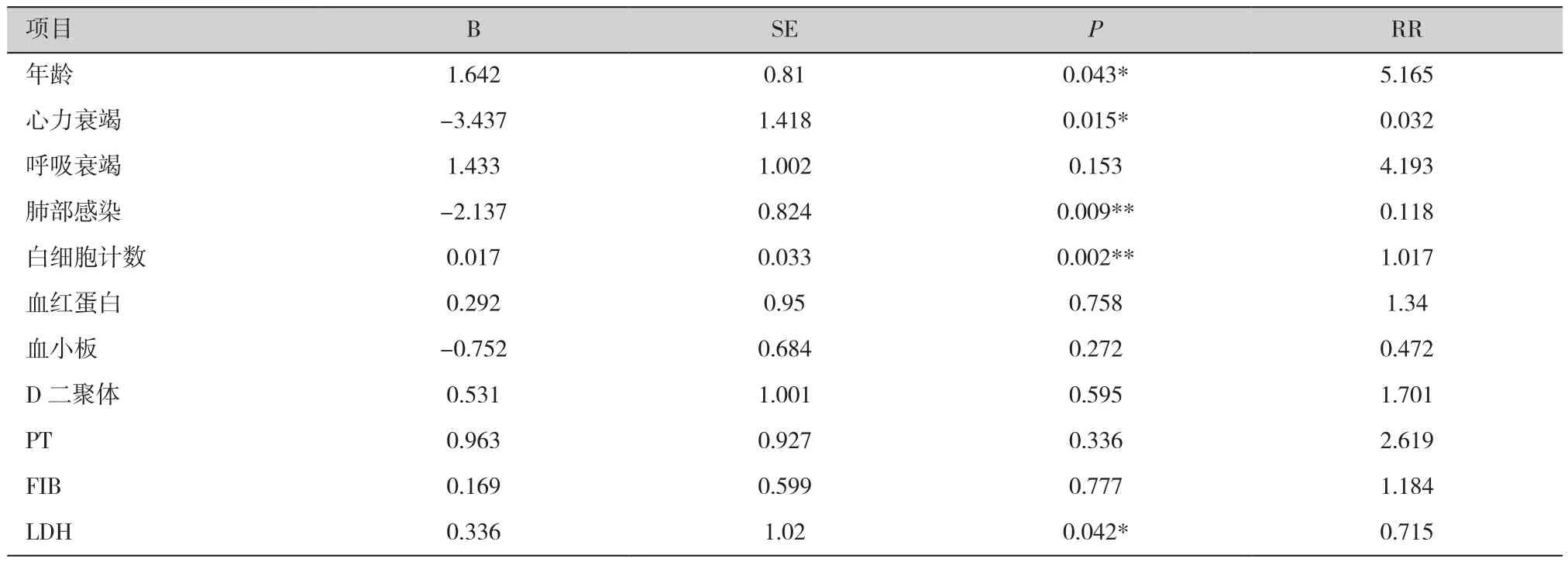
表3 急性高白细胞白血病患者死亡危险因素COX分析Table 3. COX analysis of risk factors for death in patients with acute high leukemia
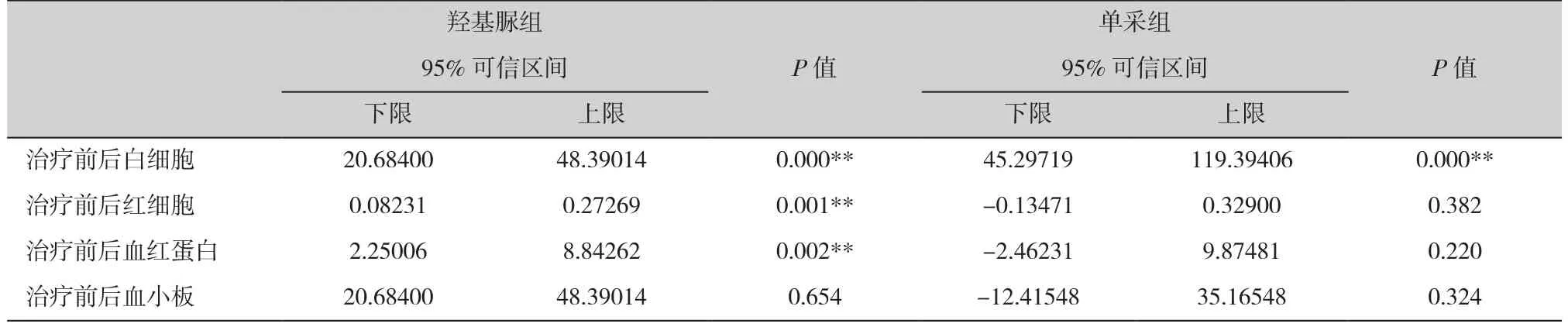
表4 降肿瘤细胞治疗前后血常规配对T检验Table 4. Blood routine paired T test before and after tumor cell reduction
3 讨论
高白细胞白血病早期死亡率高,并发症多,本研究中65例急性高白细胞白血病患者1周死亡率为26.2%,文献报道1周死亡率可高达15%-30%,多脏器功能衰竭、凝血功能障碍导致颅内出血,是常见的早期死亡并发症[11]。Chang MC等[12]研究报告年龄≥65岁(P=0.012)及呼吸衰竭(P=0.018)是高白病人早期死亡的危险因素。Gesine Bug等[13]研究报告呼吸困难(P=0.005)和乳酸脱氢酶血清水平较高(P=0.021)是早期死亡的独立危险因素,降低白血病细胞负荷可以显著降低早期死亡率。本研究中患者肿瘤负荷越高,出现心力衰竭,并发凝血功能障碍与患者的早期死亡明显相关,年龄越大,死亡风险越高。同时我们进一步进行COX回归分析发现年龄(>60岁)(P=0.043)、白细胞计数(P=0.002)、心力衰竭(P=0.015)、肺部感染(P=0.009)及乳酸脱氢酶(P=0.042)是患者死亡的独立影响因素。因此,早发现早治疗,早期干预降低肿瘤负荷,预防感染可以为后续治疗提供保障。
Andry Van de Louw等[14]研究高白细胞患者呼吸功能改善状态提示积极降低细胞瘀滞可以显著改善患者早期的呼吸功能。白细胞单采及羟基脲的应用是目前高白细胞白血病常用的两种治疗手段,在对160例高白细胞白血病患者研究发现口服羟基脲组较对照组降低5%的死亡率(P=0.047)[9]。同时,在我们早期对高白细胞白血病病人的细胞单采应用中报告显示白细胞分离术可以显著降低白细胞计数(P<0.001)[15]。本研究中,羟基脲组与单采组均明显降低白细胞总数,减轻瘀滞反应,但羟基脲的细胞毒性作用同时可以降低血红蛋白及血小板,而有报道指出单采技术显著降低血小板及纤维蛋白原,延长凝血时间,增加早期出血风险[16],因此如何选择有效的干预的方式及尽量减少治疗相关的风险是关键,在对65名患者治疗前后的血常规研究发现,应用羟基脲组对血红蛋白具有显著影响(P=0.002),而两种干预措施对血小板的降低均无显著影响,上海市白血病协助组对244名高白细胞白血病患者研究发现低血红蛋白是早期死亡的独立危险因素(Hb≤ 40 g/L,P<0.001)[17],早期加强支持治疗可能减少死亡风险。
虽积极探索其发生机制并且尽可能降低肿瘤负荷,但急性高白细胞白血病进展仍迅速,需要更多的临床研究为控制疾病发展提供依据,以期降低早期死亡率,为后期化疗或移植等争取更多机会,延缓生存时间。

