东太湖养殖区、生态恢复区和对照区水质对比研究
苏 芮,徐慧敏,王树人,陆建明,曾 巾,赵大勇
(1.河海大学 水文水资源与水利工程科学国家重点实验室,江苏 南京 210098;2.中国科学院南京地理与湖泊研究所 湖泊与环境国家重点实验室,江苏 南京 210008;3.江苏省太湖渔业管理委员会办公室,江苏 苏州 215004;4.河海大学 水利学科专业实验教学中心,江苏 南京 210098)
湖泊是开展淡水养殖的主要水域,湖泊养殖在我国渔业发展中具有举足轻重的地位。然而,放养和围网养殖会引发一系列湖泊生态环境问题[1],如因过度追求养殖经济效益而投放大量饵料,饵料残留在水体和沉积物中造成严重的养殖污染[2-3];同时,大规模高密度的传统养殖模式易对湖泊生态环境造成破坏[4],特别是破坏了有“水下森林”之称的沉水植被,改变了湖泊水生植物的组成和分布,进而引发湖泊次生环境灾害[5]。因此,亟需走生态渔业发展之路,调整和优化养殖模式,利用湖区水草、螺蚬等天然饵料资源,减少人工饵料投喂,同时提高水产品质量,实现经济和水环境的良性循环[6]。
太湖是我国重要的淡水湖泊,其水体水质及生态环境质量对长江中下游地区经济社会发展具有重要影响。太湖东南部水域为典型浅水草型湖区,从1979年起,东太湖围网养殖面积逐年扩大,2006年已达105.87 km2[7],从而导致水体环境质量下降,东太湖沼泽化和富营养化现象渐趋严重[8]。2007年“太湖蓝藻事件”之后,政府对东、西太湖围网养殖进行了管理整治,将136 km2养殖围网全部拆除,重新建立了30 km2规范化的围网养殖区[9]。同时,对新建立的围网养殖区内养殖模式进行了优化调整[7],在低密度的围网养殖区内合理种植水生植物[9]。水生植物作为湖泊生态系统的重要组成部分,具有吸收水体氮、磷营养物质和抑制藻类生长的作用, 可以改善湖泊水质[10]。研究[11]发现,东太湖水生植物生长区中不同形态营养物质含量低于无水生植物区域。渔业养殖区人工种植的沉水植物可作为天然水草饲料,为底栖动物、虾、鱼等提供栖息生境,进而丰富饵料生物资源量,提高养殖生物产量及质量[12]。除了在养殖区种植沉水植物外,还可以根据不同水生生物的共生原理,进行多种水产品的混合养殖,从而达到保护养殖区水环境的作用[13-14]。研究[15]发现,混合养殖模式可以实现养殖区水环境的自我修复与调控及养殖期间用水的零排放,而且饲料利用率大幅度提高,经济效益显著增加。
近年来,东太湖的围网养殖模式进行了优化调整,但对养殖模式优化后围网养殖区水质变化的研究还较少。因此,作者于2016年不同月份对东太湖湖泊养殖污染控制区(蟹草养殖,XC)、湖泊养殖优化区(混合养殖,HY)、生态恢复区(HF)和对照区(DZ)4个区域进行调查研究,通过水环境指标的测定,对比分析养殖区、生态恢复区和对照区的水质情况,并通过主成分分析法进行水质评价,探究新型的渔业养殖模式对水质的影响,从而探索合理的养殖模式,为湖泊污染的治理提供新思路。
1 实验
1.1 采样区域及采样点
采样区域分为湖泊养殖污染控制区(蟹草养殖区, XC)、湖泊养殖优化区(混合养殖区,HY)、生态恢复区(HF)和对照区(DZ)。蟹草养殖区在养殖系统中通过人工种植沉水植物对养殖污染物进行吸收转化,从而净化养殖水体,提高养殖生物产量及质量;混合养殖区是利用虾、蟹、鱼、贝及水生植物的共生原理,通过合理搭配不同生物品种及数量,调整生态布局,获得经济和环境效益的双赢,主要是进行河蟹、青虾、罗氏沼虾和鳜鱼等品种的混合养殖;生态恢复区是针对已经受到严重污染、水生植被退化的湖区,通过人工维护水环境,构建沉水植物、浮叶植物和挺水植物等优质水生植被自然生长的区域;对照区是历史上从未进行过水产养殖的区域,距离养殖区(XC3、HY3、XC4、HY4)约2 km。
在东太湖4个采样区域共设置14个采样点,其中:蟹草养殖区4个采样点(XC1、XC2、XC3、XC4),混合养殖区4个采样点(HY1、HY2、HY3、HY4),生态恢复区3个采样点(HF1、HF2、HF3),对照区3个采样点(DZ1、DZ2、DZ3),如图1所示。
1.2 水样采集及指标测定
分别于2016年1月、3月、4月、8月及11月,在14个采样点用采水器采集水面以下0.5 m处的水样1 000 mL,分装于已灭菌处理的蓝盖玻璃瓶中,立即密封,避光保存于4 ℃保温箱中,并尽快运回实验室进行过滤处理及指标分析。
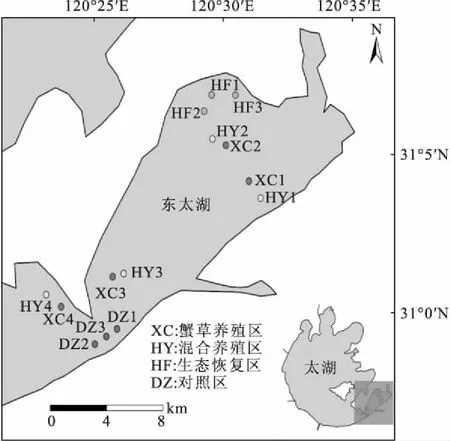
图1 采样区域及采样点Fig.1 Sampling areas and sampling sites
1.3 水质评价
采用主成分分析法对水质进行评价。主成分分析法是一种将多维因子纳入同一系统中进行定量化研究、理论比较完善的多元统计分析方法,它可以从众多的变量中抽象出少数互不相关的综合因子,而这少数的几个综合因子可对研究结论作出合理的解释[17]。
主要步骤如下:
(1)将各水环境因子xi标准化,以消除量纲影响。
(2)在标准化数据矩阵的基础上计算各水环境因子的相关系数矩阵。
(3)解特征方程,并将其p个特征值按大小顺序排列(λ1≥λ2≥…≥λp),选取前m个特征值对应的单位特征向量,即可写出主成分计算公式Fi=∑ai×xi(Fi为第i个主成分,xi为第i个水环境因子,ai为xi的评价系数)。
(4)将各待评采样点的标准化数据分别代人各主成分的表达式中,计算采样点的各主成分得分Fi;以方差贡献率(di)为权数求和,按公式F=∑Fi×di计算综合得分F。
1.4 数据分析
运用软件SPSS Statistics 17.0进行One-Way ANOVA分析和主成分分析[18],运用软件Sigma Plot12.5绘制柱状图。
2 结果与讨论
2.1 水环境因子的时空变化特征
东太湖4个区域的水环境因子平均值见表1。
表1 东太湖4个区域的水环境因子平均值
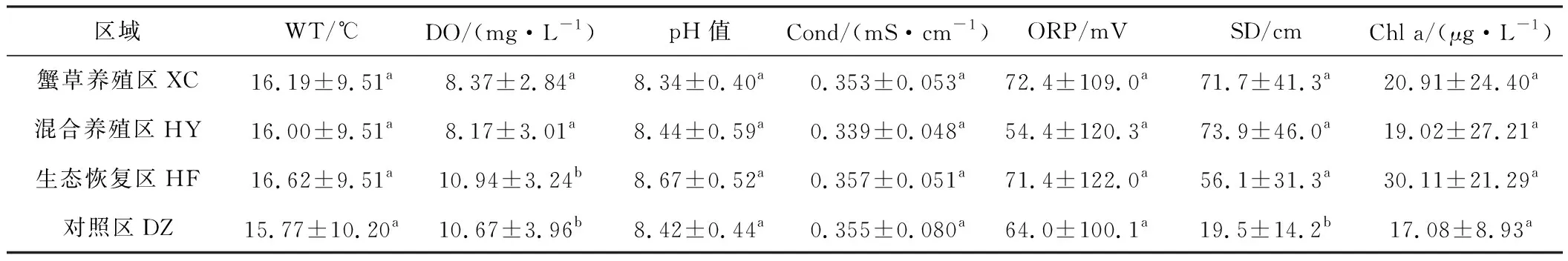
Tab.1 Average values of water environmental factors for four areas in East Taihu Lake
注:数据表示为均值±标准差(XC和HY,n=20;HF和DZ,n=15);每一列数字后不同字母表示具有显著差异(P<0.05),下表同。
从表1可知,养殖区(XC和HY)与非养殖区(HF和DZ)的溶解氧平均浓度差异显著,对照区的平均透明度显著低于其它3个区域,而其它水环境因子的平均值在4个区域之间无显著差异。
1月、3月、4月、8月及11月,东太湖4个区域的水环境因子的时空差异见图2。
从图2可知,随着采样月份的延后,东太湖4个区域的水温先升高后降低,溶解氧浓度先降低后升高,pH值波动较小,电导率呈缓慢下降的趋势;氧化还原电位在4月份为负,在其它月份均为正;对照区的透明度在8月份最高,在其它月份较低,其它3个区域的透明度从1月份至4月份随着采样月份的延后逐渐升高,在8月份和11月份明显降低;养殖区(XC和HY)和生态恢复区的叶绿素a浓度从4月份至8月份呈显著上升趋势,在8月份达到峰值后下降,对照区的叶绿素a浓度整体呈缓慢上升趋势。经One-Way ANOVA分析比较4个区域的水环境因子的变化特征,发现除了8月份,对照区的透明度都低于其它3个区域;养殖区(XC和HY)的叶绿素a浓度在1月份和3月份显著低于生态恢复区(P<0.05),在4月份显著低于生态恢复区和对照区(P<0.05)。
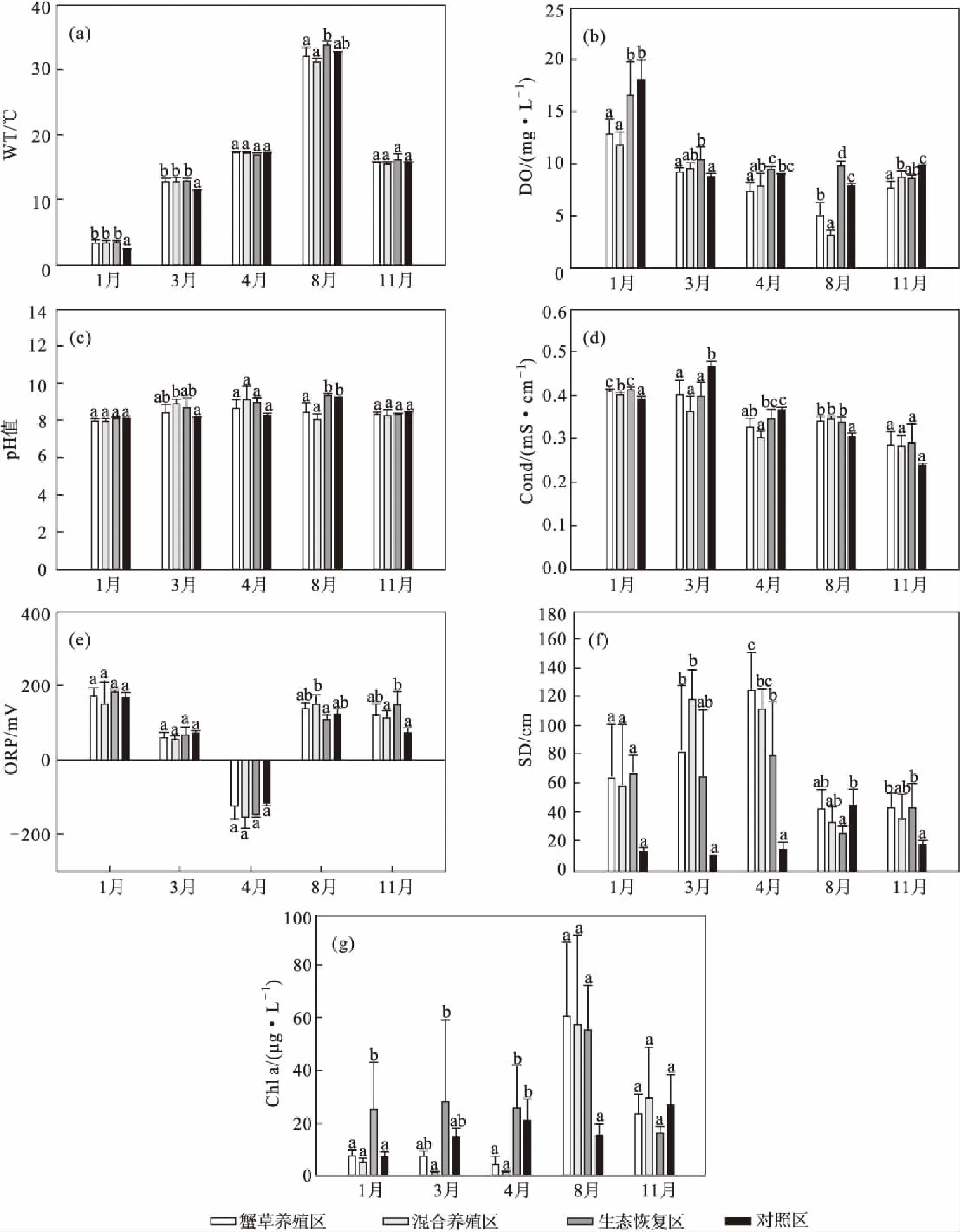
图2 各月份东太湖4个区域的水环境因子的时空差异Fig.2 Spatial and temporal differences of water environmental factors for four areas in East Taihu Lake at each month
2.2 营养物质浓度的时空变化特征
东太湖4个区域的营养物质平均浓度见表2。
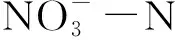
1月、3月、4月、8月及11月,东太湖4个区域的营养物质浓度的时空差异见图3。
表2 东太湖4个区域的营养物质平均浓度/(mg·L-1)
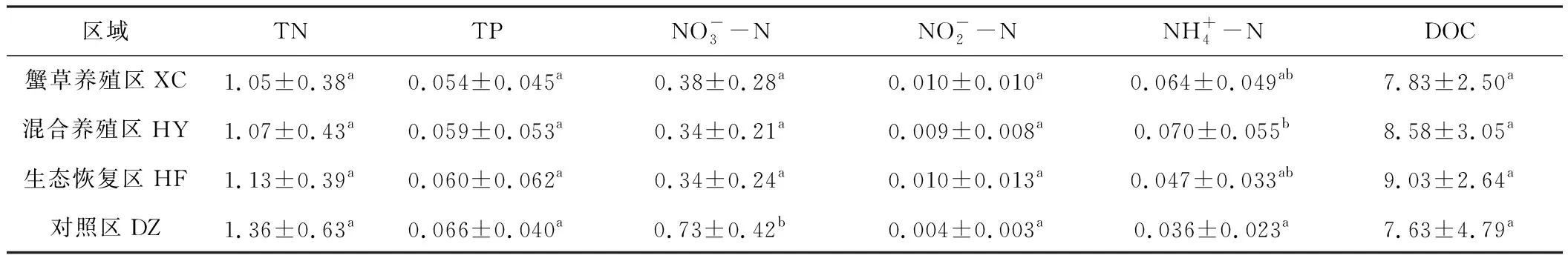
Tab.2 Average concentrations of nutrients for four areas in East Taihu Lake/(mg·L-1)
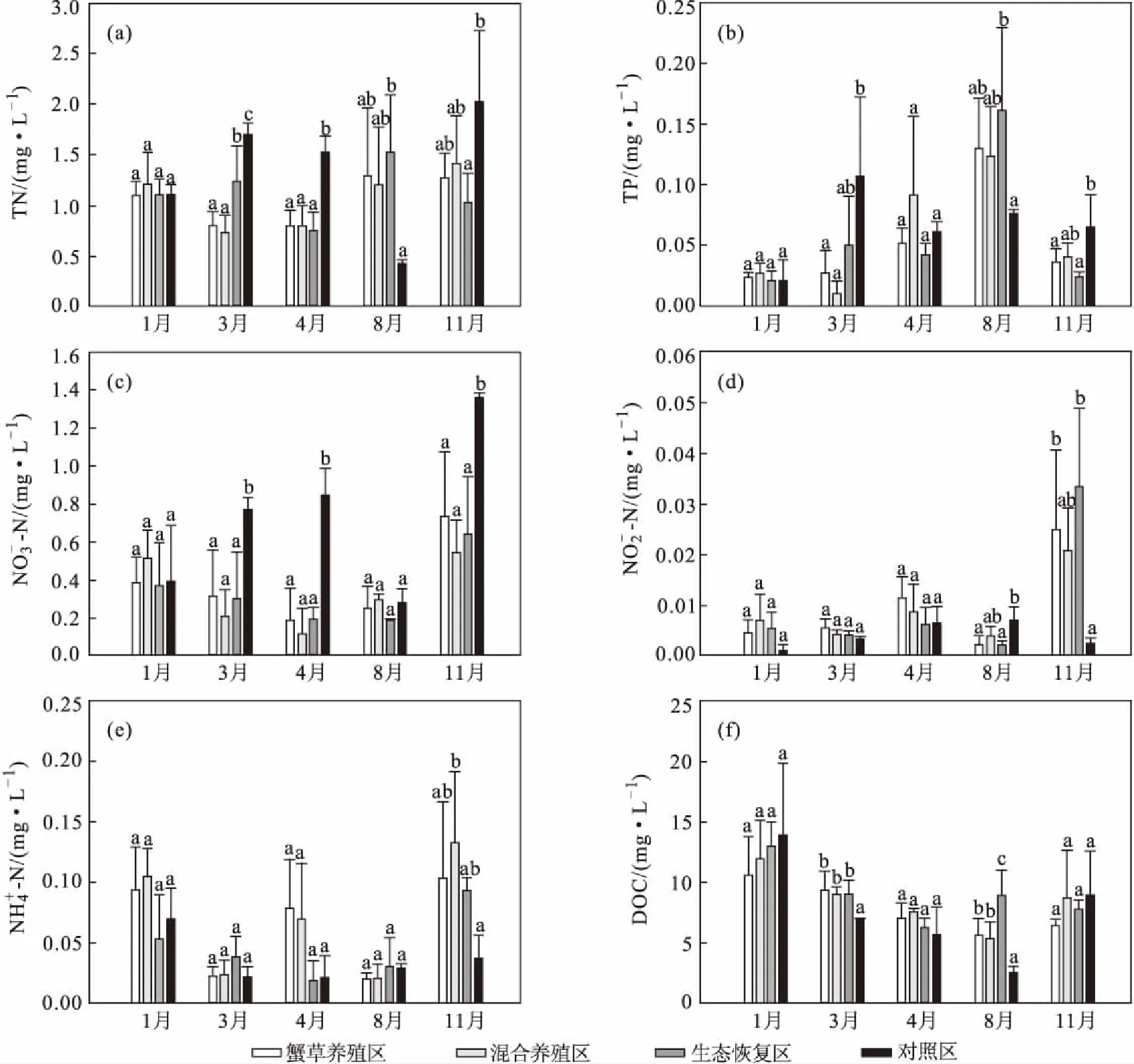
图3 各月份东太湖4个区域的营养物质浓度的时空差异Fig.3 Spatial and temporal differences of nutrients concentrations for four areas in East Taihu Lake at each month
2.3 水质评价
首先通过计算,将东太湖4个区域各月份的每个水质指标与均值的差值除以标准差,得到标准化数据(表3),再用软件SPSS Statistics 17.0对标准化数据进行主成分分析,得到各个主成分的方差贡献率以及各水环境因子在各主成分下的得分情况,提取前4个主成分,即F1~F4(累积贡献率为78.945%),基本可以反映水质状况。前4个主成分的方差贡献率见表4,各水环境因子得分系数矩阵见表5,最终评价结果见表6,其中F值越大表示水质越差[17]。
表3 东太湖4个区域各月份的水质指标标准化数据
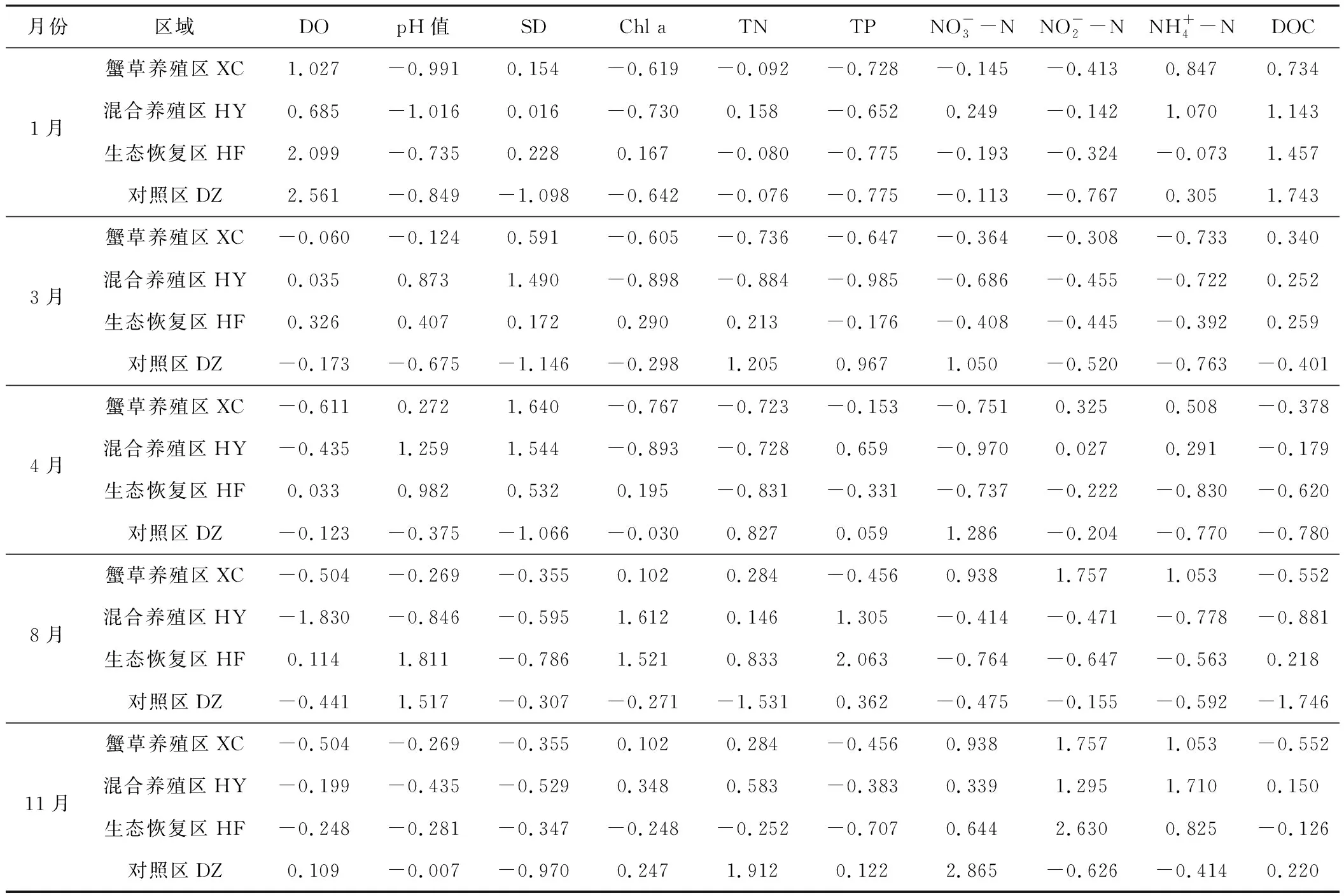
Tab.3 Standardization data of water quality indexes for four areas in East Taihu Lake at each month
表4 主成分的方差贡献率/%
Tab.4 Variance contribution rate of principal component
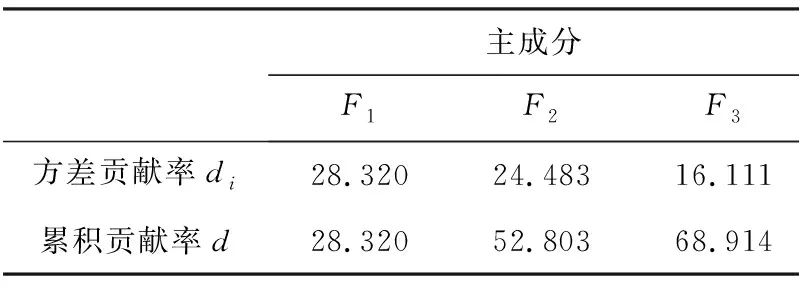
主成分F1F2F3F4方差贡献率di28.32024.48316.11110.031累积贡献率d28.32052.80368.91478.945
表5 各水环境因子得分系数矩阵
Tab.5 Score coefficient matrix of each water environmental factor
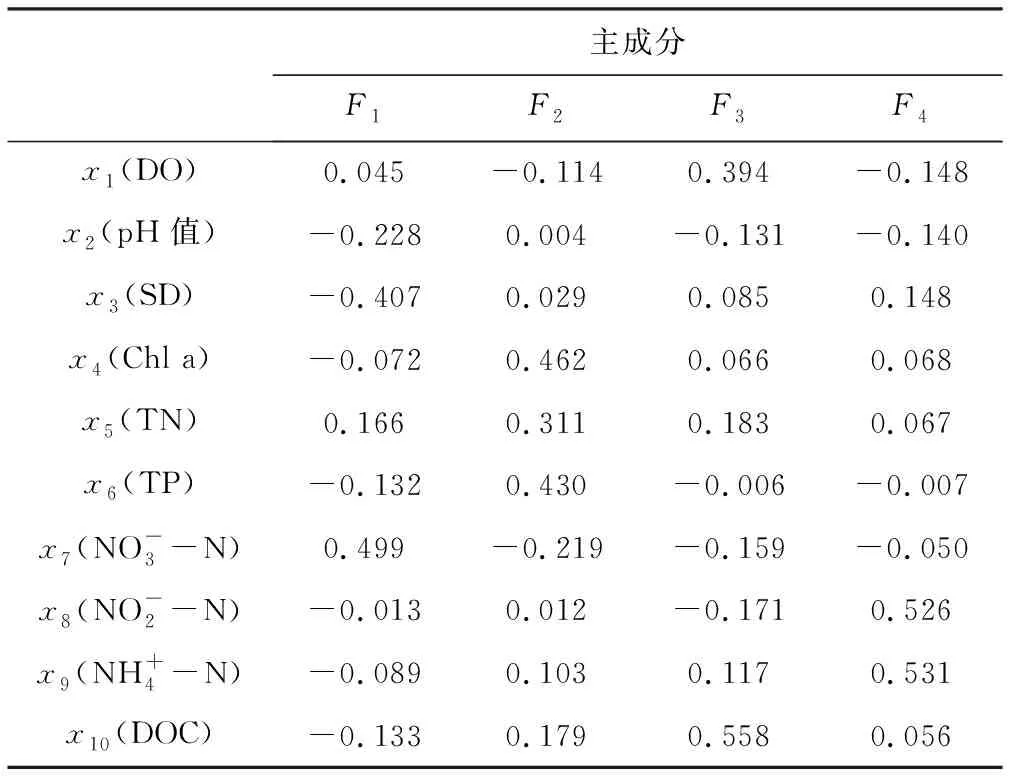
主成分F1F2F3F4x1(DO) 0.045 -0.114 0.394 -0.148x2(pH值) -0.228 0.004 -0.131 -0.140x3(SD) -0.407 0.029 0.085 0.148x4(Chl a) -0.072 0.462 0.066 0.068x5(TN) 0.166 0.311 0.183 0.067x6(TP) -0.132 0.430 -0.006 -0.007x7(NO-3-N) 0.499 -0.219 -0.159 -0.050x8(NO-2-N) -0.013 0.012 -0.171 0.526x9(NH+4-N) -0.089 0.103 0.117 0.531x10(DOC) -0.133 0.179 0.558 0.056
表6 东太湖4个区域各月份水质评价结果
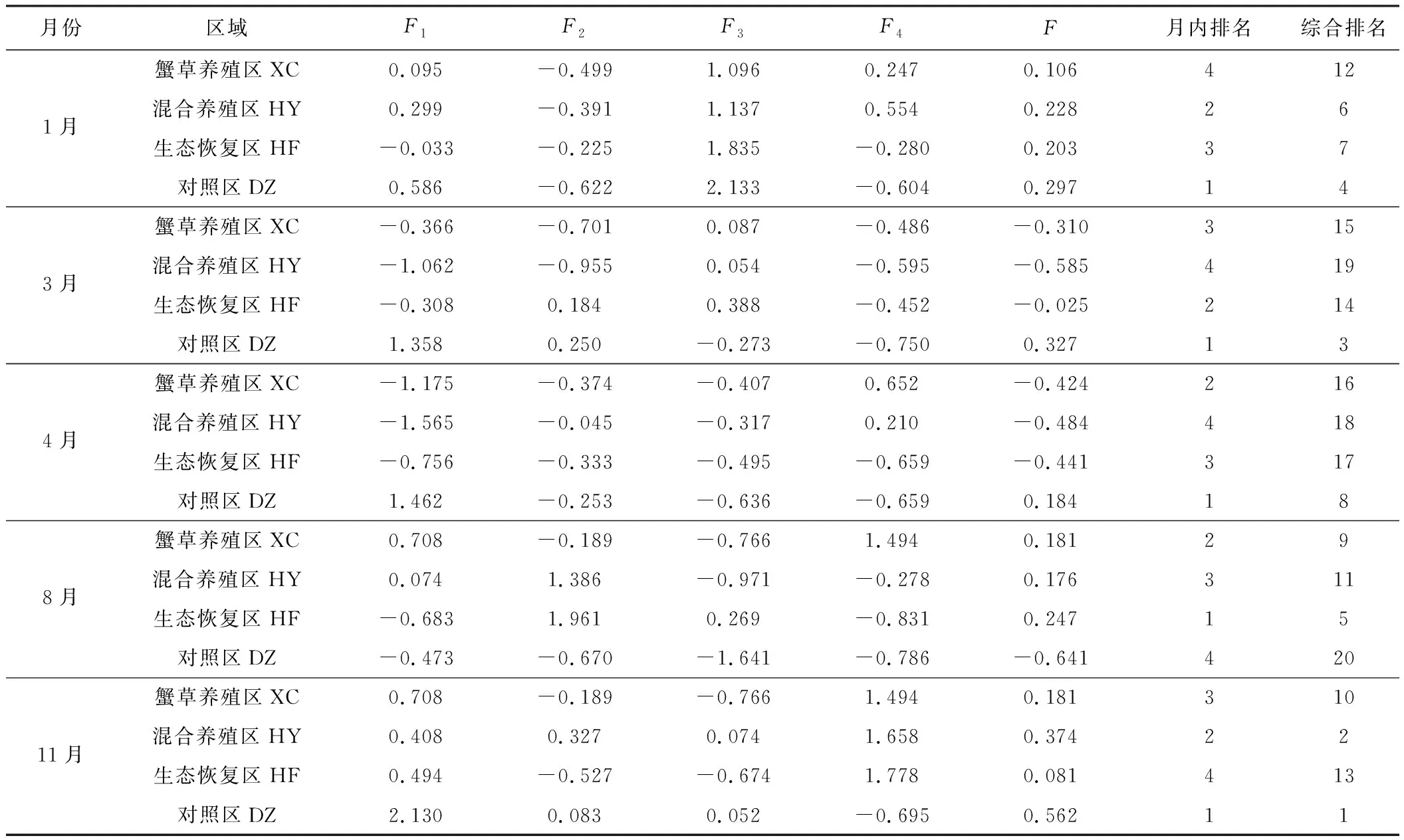
Tab.6 Evaluation results of water quality for four areas in East Taihu Lake at each month
从表6可知,除8月份外,在其余月份对照区的月内排名都是第1名,水质最差,并且综合得分与其它区域相比有明显差距;但在8月份,生态恢复区的水质最差,蟹草养殖区和混合养殖区次之,而对照区的水质最好。从综合排名看,11月份的对照区水质最差,其次是11月份的混合养殖区,8月份的对照区水质最优。综合来看,春季(3月份和4月份)各区域的水质要优于秋冬季(1月份和11月份),而8月份的情况较为特殊。
2.4 讨论
2.4.1 水环境因子的季节变化
东太湖4个区域各项水质指标存在一定的季节差异,在春季(3月份和4月份),溶解氧充足,透明度较高,叶绿素a浓度也较低,水质状况较好,这与养殖区域水生植物生长良好有关[19]。在夏季(8月份),与生态恢复区和对照区相比,养殖区(XC和HY)的溶解氧降低,而叶绿素a浓度较高。这与太湖2016年夏季洪水[20-22]和蓝藻爆发有关。2016年7~8月份太湖流域降雨较多,导致太湖水位升高,底层水体缺氧,氮磷大量释放,促进了蓝藻爆发,水体透明度大大降低,引发养殖区和生态恢复区大量水生植物和养殖生物死亡,进一步导致养殖区水质下降[20-22]。在秋季(11月份),对照区的透明度低于养殖区(XC和HY)和生态恢复区,同时其它3个区域叶绿素a浓度都降低,并且养殖区(XC和HY)的溶解氧浓度增加。这是因为秋季养殖区水生植物虽已开始衰败,但由于定期打捞[7]和河蟹牧食,养殖区(XC和HY)和生态恢复区的水质情况仍要优于对照区。在冬季(1月份),4个区域的溶解氧浓度都较高,叶绿素a浓度较低,对照区的透明度较低。对照区临近太湖主湖区,强烈的风浪扰动导致对照区的透明度下降,且该区水生植物群落多样性和生物量低于养殖区(XC和HY),造成营养物质分解或消耗较为缓慢,因此对水质有一定影响[23-24]。
夏季是藻类生长旺季,适宜的生长条件和充足的营养物质容易导致藻类的爆发[25-26],因此叶绿素a浓度在夏季容易达到高峰期(图2g),进而使得湖水透明度降低(图2f)。而溶解氧浓度会因为植物的光合作用以及水生生物的呼吸作用呈现一定的季节和日变化规律[27]。有研究表明,冬季溶解氧浓度最高,而秋季和夏季较低[27],本研究的溶解氧变化趋势与之相同。
2.4.2 营养物质浓度的季节变化
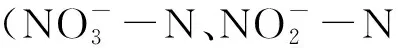
2.4.3 水质分析
主成分分析法得到的水质评价结果显示,在1月份、3月份、4月份及11月份,养殖区(XC和HY)和生态恢复区的水质均要优于对照区,这主要是因为,养殖区(XC和HY)和生态恢复区具有更完整的生态格局。在春、夏季节,水生植物处在生长旺期,由于它们对营养物质的吸收和降解,减轻了水体污染负荷;在秋、冬季节,水生植物衰败死亡,但定期的水面清理工作避免了水生植物尸体腐烂耗氧从而恶化水体环境。但是在8月份,养殖区(XC和HY)和生态恢复区的水质要劣于对照区,这主要是由于,8月份太湖发生了特大洪水[20],连续的降雨对于本研究有较大的影响,因此8月份的数据相对于其它月份来讲并不具有代表性。总体上,养殖区(XC和HY)和生态恢复区的水质优于对照区,因此优化的养殖系统并没有恶化养殖水体的水质。
3 结论
比较分析了东太湖养殖污染控制区(蟹草养殖区,XC)、湖泊养殖优化区(混合养殖区,HY)、生态恢复区(HF)和对照区(DZ)的水环境因子和营养物质浓度,并利用主成分分析法对4个区域的水质进行了评价。结果表明,溶解氧(DO)、电导率(Cond)、氧化还原电位(ORP)、透明度(SD)以及叶绿素a(Chl a)均随着水温的变化而呈现不同的变化,但是pH值随水温的变化幅度较小;养殖区(XC和HY)和生态恢复区的氮磷营养物质浓度均低于对照区,水质较好;水生植物生长良好是养殖区(XC和HY)和生态恢复区水质状况优于对照区的原因。总体来说,优化的养殖系统(蟹草养殖和混合养殖)对水体的污染低于传统渔业养殖,没有恶化养殖水体的水质。

