养殖活动对超微型浮游生物分布影响的研究*
孙 辉 汪 岷① 汪 俭 宋 雪 邵红兵 甄 毓
(1. 中国海洋大学 海洋生物遗传学与基因资源利用教育部重点实验室 青岛 266003;2. 中国海洋大学 环境科学与工程学院 青岛 266100)
由于长期的过度捕捞和市场需求的扩大使得近海渔业资源日渐枯竭, 自20世纪70年代起, 世界各国都开始大力发展近海养殖业, 而中国的近海养殖经过近三十年的发展, 无论是近海养殖面积还是总产量都已经是世界首位。随着近海养殖业的快速发展,养殖区的生态环境恶化问题日益凸显, 针对这些问题学者们展开了一系列的研究, 包括对养殖区的网采浮游植物分布以及种类鉴定的研究, 发现养殖区网采浮游植物的峰值出现在秋季, 其中赤潮生物有近60种(陈碧鹃等, 2001; 张玉宇等, 2008); 对养殖区异养细菌的研究, 发现其丰度呈现出典型的单峰型周年变化模式, 年度峰值出现在夏季, 而专性或兼性厌氧细菌丰度的增加会导致养殖环境的进一步恶化(刘文华等, 1996; 王文强等, 2006; 吴建平等, 2006;马继波等, 2007); 对养殖区浮游病毒的研究, 发现浮游病毒的峰值出现在夏季, 且养殖区浮游藻类对浮游病毒丰度的影响较大(于佐安等, 2011)。目前对养殖区的各项研究报道主要集中于对单一生物因子的观察和分析, 尚未对多种生物因子进行同时检测和分析, 以探讨人类养殖活动对超微型生物生态环境的影响。
本文利用流式细胞仪对河北省扇贝养殖区聚球藻、微微型真核藻类、异养细菌、浮游病毒4季的丰度分布特征进行了研究。河北省扇贝养殖区自90年代以来一直是我国北方重要的扇贝养殖基地之一,养殖面积超过了400km2。随着养殖密度的逐年增加,养殖区的生态环境越来越脆弱。自2009年起, 每年6—7月间发生由微微型浮游藻类引发的大范围赤潮(Zhanget al, 2012), 表明人类养殖活动给海洋生态环境带来了巨大的影响, 尤其是超微型生物生态系统。本文通过分析养殖区主要的三类超微型生物丰度分布特征以及三者之间的关系、各生物因子与环境因子的相关性, 并与渤海、北黄海非养殖区的相关研究数据进行对比, 以期全面了解人类养殖活动对养殖区超微型生物生态所产生的影响, 为养殖环境的预警及生态修复提供依据。
1 调查海域与站位设定
河北省扇贝养殖主要集中在秦皇岛市沿海, 境内有洋河、戴河、新开河、石河等多条河流入海, 为近海养殖区带来大量丰富的营养盐。这一海域除港区外围的锚地和航道未设养殖区外, 其余近海基本都布有养殖设施, 其中抚宁、昌黎两地从5米等深线一直延伸至外海12海里处均设有扇贝养殖区, 其范围在纬度39°20′—40°00′, 经度119°10′—119°55′。
本文分别于春(2012年4月)、夏(2012年6月)、秋(2012年8月)、冬(2012年12月)4个季节对河北省扇贝养殖区进行采样, 设3个采样点Q1、Q2和Q3,在2012年6月采样期间观察到赤潮暴发; 依托国家自然科学基金委共享航次, 对渤海内和北黄海非养殖区进行春(2012年4月)、夏(2011年7月)、秋(2010年9月)、冬(2012年11月)4季样品采集, 渤海内非养殖区设3个采样点B1、B2和B3; 北黄海非养殖区设3个采样点Y1、Y2和Y3(图1)。
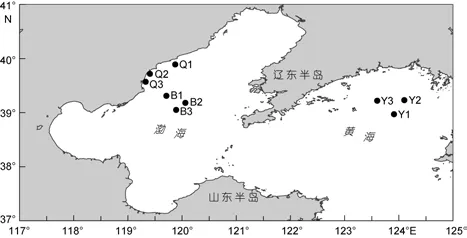
图1 河北省扇贝养殖区与渤海、北黄海非养殖区采样站位图Fig.1 The sampling stations in scallop cultivation and the no-cultured area of the Bohai Sea and the Yellow Sea
2 材料与方法
2.1 样品采集与储存
使用Niskin采水器采集表层海水, 取3mL海水用多聚甲醛进行固定, 终浓度为1%, 液氮速冻, 保存于-80°C, 用于聚球藻和微微型真核浮游藻类的分析; 取5mL海水用戊二醛进行固定, 终浓度为0.5%,液氮速冻, 保存于-80°C, 用于异养细菌和浮游病毒的分析。
2.2 聚球藻、微微型真核浮游藻类、异养细菌和浮游病毒计数
聚球藻与微微型真核浮游生物测定时, 取1mL样品加入10µm内标荧光微球, 利用流式细胞仪(Beckman Coulter FC500-MPL)测定其丰度。
异养细菌与浮游病毒测定时, 取495µL样品加入5µL SYBR Green-I (Molecular Probes)染色剂, 终浓度为10-4, 放置于暗处染色15分钟, 加入1µm内标荧光微球, 使用流式细胞仪(Beckman Coulter FC500-MPL)测定其丰度。
2.3 环境理化参数的测定
养殖区水温、盐度、营养盐等数据由本课题化学组提供; 非养殖区水温、盐度、营养盐等资料由船载SBE19-CTD测得。
2.4 数据分析
用SPSS软件进行独立样本均值的差异性检验,并分析聚球藻、微微型真核藻类、异养细菌和浮游病毒的丰度在季节分布上的差异; 利用Canoca 4.5软件进行养殖区与非养殖区超微型浮游生物与环境因子主成分分析。
3 结果
3.1 聚球藻丰度的分布
养殖区3个站位聚球藻丰度季节变化一致(图2),聚球藻丰度在9.00×102—7.07×105cell/mL之间, 平均值为(1.06±0.36)×105cell/mL (n=24)。聚球藻丰度峰值出现在秋季, 且显著高于其他季节(P<0.01)。
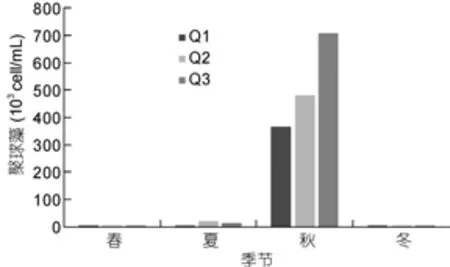
图2 扇贝养殖区聚球藻丰度变化Fig.2 The abundance of Synechococcus in scallop cultivation area
非养殖区6个站位聚球藻丰度季节变化一致(图3), 渤海内非养殖区聚球藻丰度在1.24×103—6.25×105cell/mL之间, 平均值为(1.35±0.67)×105cell/mL(n=12); 北黄海非养殖区聚球藻丰度在1.59×103—4.25×105cell/mL之间, 平均值为(0.92±0.43)×105cell/mL(n=12)。非养殖区聚球藻丰度峰值出现在夏季, 且显著高于其他季节(P<0.01)。与养殖区聚球藻4季丰度变化对比, 发现养殖区与非养殖区在夏、秋季的聚球藻丰度存在显著的差异(P<0.01)。
3.2 微微型真核浮游藻类丰度的分布
养殖区3个站位微微型真核浮游藻类丰度季节变化一致(图4), 微微型真核浮游藻类丰度在5.80×102—3.23×105cell/mL之间, 平均值为(3.06±1.27)×104cell/mL (n=24)。微微型真核浮游藻类丰度峰值出现在夏季, 且显著高于其他季节(P<0.01)。
非养殖区6个站位微微型真核浮游藻类丰度季节变化一致(图5), 渤海内非养殖区微微型真核浮游藻类丰度在1.88×103—7.63×104cell/mL之间, 平均值为(2.64±0.68)×104cell/mL (n=12); 北黄海非养殖区微微型真核浮游藻类丰度在1.47×103—5.24×104cell/mL之间, 平均值为(2.16±0.63)×104cell/mL (n=12)。非养殖区微微型真核浮游藻类丰度在夏季显著高于其他季节(P<0.01)。与养殖区微微型真核浮游藻类4季丰度变化对比, 发现养殖区夏季微微型真核浮游藻类丰度显著高于非养殖区(P<0.01)。
3.3 异养细菌丰度的分布
养殖区3个站位异养细菌丰度季节变化一致(图6), 异养细菌丰度在3.10×105—3.79×106cell/mL之间,平均值为(1.68±0.19)×106cell/mL (n=24)。异养细菌峰值出现在秋季, 且丰度在夏、秋季显著高于春、冬季(P<0.01)。
非养殖区异养细菌丰度季节变化一致(图7), 渤海内非养殖区异养细菌丰度在4.20×104—4.35×105cell/mL之间, 平均值为(2.81±0.50)×105cell/mL(n=12); 北黄海非养殖区异养细菌丰度在5.90×104—8.64×105cell/mL之间, 平均值为(3.45± 0.78)×105cell/mL(n=12)。非养殖区异养细菌丰度无显著的季节变化(P>0.05)。与养殖区异养细菌4季丰度对比, 发现养殖区异养细菌丰度4季均显著高于非养殖区(P<0.01)。
3.4 浮游病毒丰度
养殖区3个站位浮游病毒丰度季节变化一致(图8), 浮游病毒的丰度在2.50×105—2.17×106cell/mL之间, 平均值为(1.02±0.11)×106cell/mL (n=24)。浮游病毒峰值出现在秋季, 但养殖区浮游病毒丰度无显著的季节变化(P>0.05)。

图3 北黄海非养殖区(a)和渤海内非养殖区(b)聚球藻丰度变化Fig.3 The abundance of Synechococcus in no-cultured area(a): Bohai Sea; (b): Yellow Sea
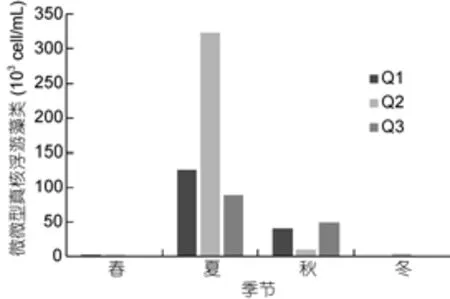
图4 扇贝养殖区微微型真核浮游藻类丰度变化Fig.4 The abundance of Picoeukaryote in scallop cultivation area
非养殖区6个站位浮游病毒丰度季节变化一致(图9), 渤海内非养殖区浮游病毒丰度在2.15×105—8.64×106cell/mL之间, 平均值为(3.31±0.90)×106cell/mL(n=12); 北黄海非养殖区浮游病毒丰度在1.14×105—8.74×106cell/mL之间, 平均值为(3.69±1.05)×106cell/mL (n=12)。非养殖区浮游病毒丰度在夏、秋季显著高于春、冬季且差异显著(P<0.01)。与养殖区浮游病毒4季丰度变化对比, 发现浮游病毒丰度在养殖区与非养殖区各季节均无显著差异(P>0.05)。
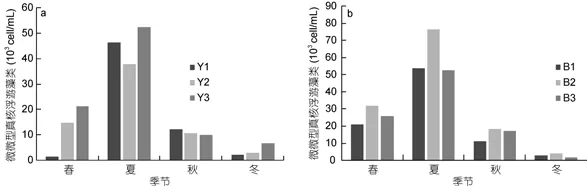
图5 北黄海非养殖区(a)和渤海内非养殖区(b)微微型真核浮游藻类丰度变化Fig.5 The abundance of Picoeukaryote in no-cultured area(a): Yellow Sea ; (b): Bohai Sea
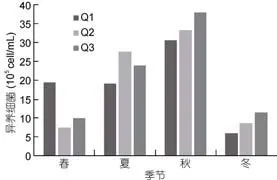
图6 扇贝养殖区异养细菌丰度变化Fig.6 The abundance of heterotrophic bacteria in scallop cultivation area
3.5 养殖区与非养殖区环境因子的对比
对比养殖区与非养殖区的环境因子发现, 养殖区与非养殖区4季的温度和盐度并无显著的差异性(P>0.05), 这可能由于养殖区与非养殖区所处的纬度相近, 因此两者的温度与盐度差异并不显著。但养殖区的营养盐浓度显著高于非养殖区(P<0.01), 这是由于养殖区养殖活动密集造成水体中的有机物浓度以及营养盐浓度升高所致。
3.6 养殖区与非养殖区超微型浮游生物与环境因子主成分分析
本文运用主成分(PCA)分析对养殖区与非养殖区超微型浮游生物与环境因子进行相关性研究(图10)。环境因子主要包括: 温度、盐度、以及营养盐(硝酸盐、亚硝酸盐、磷酸盐、铵盐和活性硅酸盐)浓度。通过PCA分析发现养殖区与非养殖区超微型生物生态环境4季均存在显著差异。养殖区异养细菌4季均为超微型生物的主成分, 而非养殖区4季超微型生物主成分则是微微型浮游植物。超微型浮游生物与环境因子之间的相关性分析表明, 在养殖区, 聚球藻、微微型真核藻类在春、冬季与温度呈显著正相关, 夏、秋季聚球藻与铵盐、硝酸盐、磷酸盐呈显著正相关, 而微微型真核藻类与铵盐、硝酸盐、磷酸盐呈显著负相关;异养细菌在夏季与铵盐、硝酸盐、磷酸盐呈显著负相关, 秋季与铵盐、硝酸盐、磷酸盐呈显著正相关, 而在春、冬季无显著相关性; 浮游病毒在春、冬季与异养细菌呈显著正相关, 与聚球藻及温度呈显著负相关, 在夏季与微微型真核藻类呈显著负相关, 在秋季与聚球藻呈显著负相关。在非养殖区, 聚球藻和微微型真核藻类在春、冬季与温度呈显著正相关, 在夏、秋季与铵盐、硝酸盐、磷酸盐呈显著的负相关; 异养细菌与环境因子无显著相关性; 浮游病毒在夏、秋季与聚球藻和微微型真核藻类显著正相关。
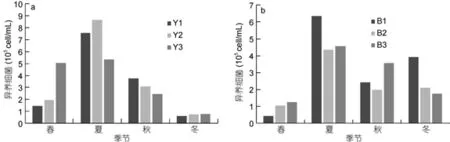
图7 北黄海非养殖区(a)和渤海内非养殖区(b)异养细菌丰度变化Fig.7 The abundance of heterotrophic bacteria in no-cultured area(a): Yellow Sea ; (b): Bohai Sea

图8 扇贝养殖区浮游病毒丰度变化Fig.8 The abundance of virioplankton in scallop cultivation area
4 讨论
微微型浮游植物是海洋初级生产力的主要贡献者(Zubkovet al, 2003), 养殖区的微微型浮游植物在夏、秋季对初级生产力的贡献较大, 由聚球藻和微微型真核藻类组成。对聚球藻的季节分布研究发现, 养殖区聚球藻峰值出现在秋季, 而非养殖区聚球藻峰值出现在夏季。这是由于养殖区夏季微微型真核藻类暴发赤潮, 消耗了大量的营养盐, 抑制了聚球藻的生长。随着赤潮消退, 微微型真核藻类的抑制作用减弱,并且异养细菌分解大量有机物使得养殖区海域营养盐浓度升高, 利于聚球藻大量繁殖, 因此, 秋季的聚球藻丰度显著高于其他季节(P<0.01)。而非养殖区并未暴发赤潮, 聚球藻丰度在春末随温度的升高逐渐增加, 因此夏季丰度达到峰值。对养殖区与非养殖区聚球藻与环境因子之间的相关性研究发现, 秋季, 在养殖区聚球藻与铵盐、硝酸盐等营养盐显著正相关,而非养殖区聚球藻与营养盐呈显著负相关。养殖区赤潮消退后, 异养细菌通过分解有机物使得海水中各营养盐浓度升高, 随着营养盐浓度升高, 聚球藻大量繁殖, 因此, 秋季聚球藻与营养盐呈显著正相关。相比而言, 非养殖区秋季营养盐并未升高, 且聚球藻大量消耗营养盐并保持较高丰度, 因此两者呈显著的负相关。春、冬季, 聚球藻在养殖区与非养殖区生长均主要受到温度的限制。许多研究表明, 聚球藻对温度的变化敏感, 适于较高的温度, 其生长的最适温度为17—25°C(Liet al, 1983; Olsonet al, 1990; Changet al, 1996; Heywoodet al, 2006)。本研究中, 养殖区与非养殖区春、冬季海水平均温度为4.9°C, 远低于聚球藻的最适生长温度, 因此温度成为其生长的主要限制因素。其夏、秋季海水平均温度为20.2°C, 是聚球藻的最适生长温度, 此时, 温度不再是聚球藻生长的限制因素。
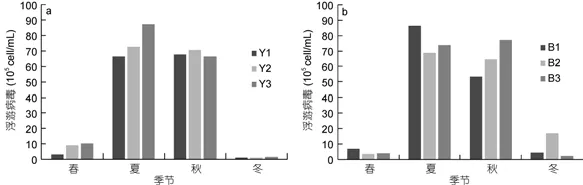
图9 北黄海非养殖区(a)和渤海内非养殖区(b)浮游病毒丰度变化Fig.9 The abundance of virioplankton in no-cultured area(a): Yellow Sea; (b): Bohai Sea

图10 养殖区与非养殖区生物与环境因子主成分分析Fig.10 Principal components analysis of the biological and environmental factors of cultured and no-cultured area
微微型真核藻类物种组成非常复杂, 多样性丰富, 其中存在多种赤潮藻类(焦念志, 2002)。养殖区在2012年与2013年6月间均发生赤潮, 本实验室对微微型真核藻类丰度的检测发现, 其丰度在夏季显著高于其他季节(P<0.01)。Zhang等(2012)对秦皇岛养殖区赤潮的研究发现, 河北省扇贝养殖区赤潮是由抑食金球藻(A. anophagefferens)引发的微微型藻类赤潮。杨红生等(1998)认为春末夏初, 养殖区开始大量放养扇贝, 而扇贝主要摄食硅藻、绿藻等微型浮游植物, 且具有巨大的摄食力, 大范围的养殖活动使得养殖区微型浮游植物对微微型浮游植物的竞争力减弱,因此, 养殖区微微型真核藻类中的赤潮藻暴发。然而,非养殖区微微型真核藻类与其他浮游藻类的生长保持平衡, 因此无赤潮暴发。夏、秋季, 养殖区微微型真核藻类与铵盐、硝酸盐、磷酸盐等营养盐呈显著负相关。夏季, 微微型真核藻类大量繁殖, 消耗大量的营养盐, 使得夏季微微型真核藻类丰度与营养盐呈显著负相关。赤潮消退后, 微微型真核藻类丰度急剧下降, 营养盐浓度由于异养细菌分解大量有机物而升高, 因此, 秋季微微型真核藻类丰度与营养盐丰度也呈显著负相关。相对而言, 非养殖区夏、秋季微微型真核藻类与营养盐也呈负相关, 但均是由于微微型真核藻类繁殖大量消耗营养盐造成的。
异养细菌是海洋生态系统的分解者和二次生产者, 对海洋生态系统中物质循环、能量流动以及微食物环都十分重要。对比养殖区与非养殖区异养细菌丰度的分布发现, 养殖区异养细菌丰度4季均显著高于非养殖区(P<0.01)。这是由于养殖活动使得养殖区海水中的有机物以及营养盐浓度显著高于非养殖区,为异养细菌的生长繁殖提供了更有利的环境。对异养细菌的季节分布研究发现, 养殖区异养细菌在夏、秋季显著高于春、冬季(P<0.01), 而非养殖区异养细菌4季无显著差异(P>0.05)。由于养殖区的养殖活动主要集中在夏、秋两季, 此时海域有机物浓度显著高于春、冬季, 因此养殖区异养细菌丰度在夏、秋季显著高于春、冬季(P<0.01), 这与其他学者的研究结果一致(吴建平等, 2006; 马继波等, 2007)。然而, 在非养殖区有机物浓度的季节变化不显著, 使得异养细菌丰度4季均无显著差异。由异养细菌与环境因子的相关性分析可知, 养殖区异养细菌与营养盐在夏季呈现显著负相关, 在秋季呈现显著正相关, 然而非养殖区异养细菌与营养盐4季均无显著相关性。夏季, 养殖区发生赤潮, 营养盐被大量消耗, 但异养细菌丰度较高, 因此, 异养细菌丰度与营养盐浓度呈现出负相关。随着赤潮的消退, 异养细菌分解有机物产生大量的营养盐, 使得营养盐浓度升高, 因此, 在秋季异养细菌丰度与营养盐浓度呈现出显著正相关。相比而言,异养细菌与营养盐浓度4季均无显著相关性。
浮游病毒是悬浮在水体中各类病毒的总称, 主要为噬菌体和藻类病毒, 对海洋生态系统中营养物质的流动以及生物群落的调控都起到重要的作用(Thingstad, 2000)。对养殖区浮游病毒季节分布的研究发现, 浮游病毒峰值出现在秋季。养殖区夏季微微型真核藻类暴发赤潮, 在赤潮后期浮游病毒通过裂解赤潮藻使得丰度升高, 并在秋季达到峰值。通过浮游病毒与宿主的相关性研究发现, 养殖区春、冬季浮游病毒丰度与异养细菌丰度呈显著的正相关。由养殖区主成分分析可知, 春、冬季异养细菌是养殖区超微型浮游生物的第一主成分, 此时浮游病毒的主要宿主是异养细菌。相比发现, 非养殖区春、冬季浮游病毒与主要宿主之间均无显著相关性。夏季, 养殖区浮游病毒与微微型真核藻类呈显著负相关。夏季, 养殖区微微型真核藻类发生赤潮, 使得微微型真核藻类成为养殖区第一主成分, 由于浮游病毒对微微型真核藻类的裂解作用, 使得赤潮后期微微型真核藻类丰度急剧下降, 浮游病毒丰度上升, 因此两者呈现显著负相关。秋季养殖区浮游病毒丰度与聚球藻丰度呈显著负相关。养殖区赤潮消退后, 聚球藻大量繁殖成为养殖区第一主成分, 在海水中的密度增高, 与噬藻体接触的机率增大, 成为浮游病毒的主要宿主。浮游病毒通过裂解作用控制聚球藻丰度, 因此两者呈现出显著的负相关性。综上可知, 浮游病毒对养殖区的群落结构调控起到重要的作用。相比而言, 非养殖区浮游病毒与微微型真核藻类、聚球藻在夏、秋季均呈显著正相关, 浮游病毒的丰度随着宿主丰度升高而升高。
养殖区与非养殖区不仅在4类超微型浮游生物丰度分布之间存在显著差异, 其4季超微型浮游生物主成分也存在显著差异, 异养细菌在养殖区4季均为超微型浮游生物的主成分, 而非养殖区超微型浮游生物的主成分是微微型浮游植物, 表明养殖活动显著影响了养殖区超微型浮游生物的群落结构和功能。由于海水养殖产生的残饵碎屑、养殖生物的排泄物以及分泌物的影响, 使得养殖区海域颗粒有机物浓度升高, 异养细菌分解颗粒有机物形成溶解有机物, 并利用溶解有机物进行繁殖, 导致异养细菌丰度升高;伴随着细菌生物量的增长, 海水中的大量溶解有机碳通过异养细菌转换为颗粒有机碳, 进入微食物环,再通过原生动物对异养细菌的捕食, 进入经典食物链, 因此, 异养细菌所主导的微食物环是养殖区重要的物质和能量流动的渠道之一。对比发现, 非养殖区超微型浮游生物的主成分是微微型浮游植物, 由其参与的经典食物链在物质和能量流动中可能起到更主要的作用。本文认为异养细菌增多, 可能是自然环境产生的一种代偿和修复机制, 在一定的范围内, 维持生态系统的平衡。然而, 当环境产生的有机物超出异养细菌所能分解的能力时, 生态平衡将被打破, 发生赤潮等环境恶化问题。
于佐安, 李文姬, 张 明, 李华琳, 刘项峰, 李大成, 2011. 大连市长海县虾夷扇贝养殖海区浮游病毒的丰度. 水产学报, 35(6): 911—916
马继波, 董巧香, 黄长江, 2007. 粤东大规模海水增养殖区柘林湾浮游细菌的时空分布. 生态学报, 27(2): 478—482
王文强, 韦献革, 温琰茂, 2006. 哑铃湾网箱养殖对表层沉积物的污染. 热带海洋学报, 25(1): 57—60
刘文华, 叶德赞, 倪纯治等, 1996. 厦门浔江湾牡蛎养殖区弧菌研究. 台湾海峡, 15(4): 413—416
张玉宇, 吕颂辉, 齐雨藻, 2008. 2003—2004年大亚湾澳头养殖区水域浮游植物群落结构及数量变动特征. 海洋环境科学, 27(2): 132—134
吴建平, 蔡创华, 周毅频, 吴灶和, 2006. 大亚湾网箱养殖区异养细菌和弧菌的数量动态. 湛江海洋大学学报, 26(3):22—25
陈碧鹃, 陈聚法, 崔 毅, 李秋芬, 2001. 莱州湾东部养殖区浮游植物的生态特征. 海洋水产研究, 22(3): 65—69
杨红生, 周 毅, 1998. 滤食性扇贝对养殖海区环境的研究进展. 海洋科学, (2): 42—44
焦念志, 2002. 海洋微型生物生态学. 北京: 科学出版社, 129—131
Chang J, Chung C C, Gong G C, 1996. Influences of cyclones on chloropgyllaconcentration and Synechococcus abundance in a subtropical western Pacific coastal ecosystem. Marine Ecology Progress Series, 140: 199—205
Heywood J L, Zubkov M V, Tarran G Aet al, 2006.Prokaryoplankton standing stocks in oligotrophic gyre and equatorial provinces of the Atlantic Ocean: evaluation of inter-annual variability. Deep-Sea Research Part II: Topical Studies in Oceanography, 53(14—16): 1530—1547
Zhang Q C, Qiu L M, Yu R Cet al, 2012. Emergence of brown tides caused byAureococcus anophagefferensHargraves et Sieburth in China. Harmful Algae, 19: 117—124
Li W K W, Subba E D V, Harrison W Get al, 1983. Autotrophic picoplankton in the tropical ocean. Science, 219: 292—295
Olson R J, Chisholm S W, Zettler E Ret al, 1990. Spatial and temporal distributions of prochlorophyte picoplankton in the North Atlantic Ocean. Deep-Sea Research I, 37(6):1033—1051
Thingstad T F, 2000. Elements of a theory for the mechanisms controlling abundance, diversity, and biogeochemical role of lytic bacterial viruses in aquatic systems. Limnol Oceanogr,45(6): 1320—1328
Zubkov M V, Fuchs B M, Tarran G Aet al, 2003. High rate of uptake of organic nitrogen compounds by Prochlorococcus cyanbacteria as a key to their dominance in oligotrophic oceanic waters. Applied and Environmental Microbiology,69: 1299—1304
- 海洋与湖沼的其它文章
- 大菱鲆(Scophthalmus maximus)、星斑川鲽(Platichthys stellatus)及其杂交种的形态学分析*
- 半滑舌鳎(Cynoglossus semilaevis Günther)生长激素体外重组表达及活性分析*
- 香港牡蛎(Crassostrea hongkongensis)与长牡蛎(Crassostrea gigas)种间杂种遗传力评估*
- 三疣梭子蟹(Portunus trituberculatus)胞内氯离子通道蛋白基因克隆及其表达分析*
- 褪黑激素对香港细首纽虫(Cephalothrix hongkongiensis)性腺发育的影响及羟基吲哚-O-甲基转移酶(HIOMT)的测定*
- 饲养空间大小对单体筐养养殖系统中三疣梭子蟹(Portunus trituberculatus)的摄食行为与生长特性的影响研究*

