水痘减毒活疫苗原液生产车间工艺设计分析
(中国航空规划设计研究总院有限公司,北京 100120)
疫苗是以病原微生物或其组成成分、代谢产物为起始材料,采用生物技术制备而成,用于预防、治疗人类相应疾病的生物制品[1]。伴随着人类疾病谱的变化及生物制药技术的发展进步,疫苗在人类社会生活中发挥的作用将越来越大。2019年12月,《中华人民共和国疫苗管理法》正式落地实施,明确要求疫苗生产过程要符合核定的工艺和质量控制标准。为了满足高标准的设计要求,降低生产过程中交叉污染的风险,提高药品的内在质量,生产企业对疫苗生产车间的设计提出了更高的要求。
水痘是由水痘-带状疱疹病毒初次感染引起的急性传染病,主要发生在婴幼儿和学龄前儿童。临床上可通过对12月龄以上的健康儿童、青少年及成人、高危人群及其密切接触者进行接种水痘疫苗的主动免疫,从而达到预防其感染水痘病毒的目的。目前在世界各地广泛使用的水痘疫苗均为减毒活疫苗,其生产用毒种均是1983年被世界卫生组织推荐的V-Oka疫苗株[2]。
1 生产工艺流程分析
目前国内外的水痘疫苗生产一般都采用细胞工厂技术进行细胞培养和病毒培养。相比于传统的转瓶工艺技术,细胞工厂采用静止培养方式,培养表面经特殊处理,大大提高了细胞的吸附性,可以节约操作时间和培养区域空间;并且细胞工厂可实现细胞培养的自动化操作,从而大大地降低劳动强度和密集度,实现大规模的细胞培养[3]。
水痘减毒活疫苗生产工艺流程大致分为原液制备和冻干制剂两个阶段。其中,原液制备阶段又主要分为细胞培养阶段(从细胞种子复苏、传代到细胞培养)和病毒培养阶段(从病毒接种、培养到原液收获)两个阶段。
水痘减毒活疫苗原液生产工艺流程:细胞种子一般冻存在液氮罐内,生产时先进行细胞种子复苏及传代培养,随后进行细胞工厂扩大培养,当培养液中细胞密度达到目标值后,即可转移至病毒操作区进行接毒。这些操作均为敞口操作,需在B+A 单向流下完成。细胞接毒后继续培养,通过多次培养基和缓冲液的洗换,病毒滴度达到要求后即可进行病毒液的收集,最终原液进行超低温冷冻保存。原液制备阶段生产工艺流程如图1所示。
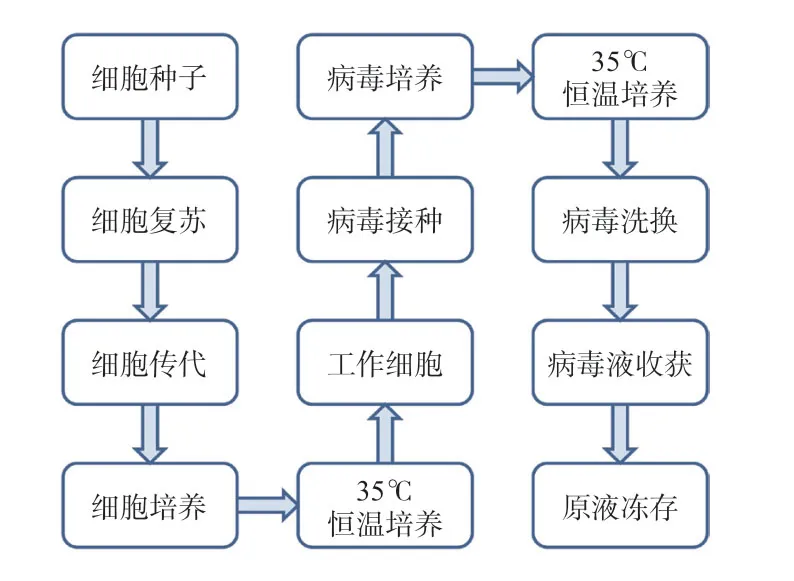
图1 水痘减毒活疫苗原液生产工艺流程Fig.1 Process flow diagram of bulk production of varicella attenuated live vaccine
2 工艺布置分析
《药品生产质量管理规范(2010年修订)》第四十六条明确指出:为降低污染和交叉污染的风险,厂房、生产设施和设备应当根据所生产药品的特性、工艺流程及相应洁净度级别要求合理设计、布局和使用[4]。
结合水痘减毒活疫苗生产工艺流程和相关法规或标准的要求,以及我院多年的工程设计经验,本文以某水痘原液生产车间为例,提出了一种水痘减毒活疫苗原液生产车间的工艺布置方案,并从工艺布局、人物流等方面进行探讨分析。
水痘减毒活疫苗原液生产车间工艺布置案例如图2所示。

图2 水痘减毒活疫苗原液生产车间工艺布置Fig.2 Process layout of bulk production workshop of varicella attenuated live vaccine
2.1 工艺布局
按照生产工艺和使用功能,水痘减毒活疫苗原液生产车间的功能分区可划分为细胞操作区、病毒操作区、清洗区和配液区四个区域,其中病毒操作区为有毒区。本案例在工艺布局设计时合理组合上述几个区,做到有毒区与无毒区严格分开设置。每一工作区设置独立的人、物流出入口,并同其他区域严格分开,并且有毒区设置退更设施。
水痘疫苗为非最终灭菌产品,且其原液不可除菌过滤,涉及到敞口操作的生产环境必须为无菌环境。本案例中将生产操作中涉及产品敞口非密闭的操作均设置为在B级背景环境的A级单向流下进行,而且培养完成的细胞悬液从细胞操作区通过传递柜直接进入病毒操作区,实现无菌区之间传递,避免频繁进出无菌区带来的污染风险。
恒温培养是细胞传代培养和病毒培养的必需要求。以往的设计中一般采用B级恒温房间,通过空调的送风来实现温度控制。本案例中采用恒温培养设备代替恒温房间的设计,恒温培养设备开门设置在B级区,而设备本身可放置在低级别区域,这样可大大降低B级区的面积,降低能耗;恒温培养设备在保证恒温方面具有更精确的控制,而且恒温培养设备更容易通过验证,在未来需满足高标准的认证需求时具有很大的优势。
现代化的生产车间除了满足生产要求外,兼具参观性也是需要考虑的。本案例在生产车间外围设置CNC 环形走廊,为车间洁净环境提供保障,同时也为参观提供便利条件。在生产工艺流程顺畅合理设置的前提下,将大部分核心操作间尽量贴环形走廊布置,使参观活动在不进入生产车间内部不影响生产的情况下进行,也是透明化工厂设计的需要。
2.2 人物流路线
人物流路线的设计应尽量降低交叉污染的风险,在满足生产流程顺畅合理的前提下,考虑尽量将人、洁物、污物分开,有毒区和无毒区的人、物流各自有独立的净化通道。本案例中,各功能区均设置单独的人员净化通道,人员需经净化更衣程序进入各自生产区域。对于有毒区,更衣采用单向控制,即人员分通道进入和退出,避免人员进出引起交叉污染。各功能区待使用的工器具经过严格的清洗灭菌流程后进入洁净区内,再通过缓冲或传递窗传递至使用区域。无毒区污物通过缓冲退出至CNC 走廊,有毒区污物
需消杀后方可传出,需要循环使用的物品通过CNC走廊进入粗洗间,经过清洗、灭菌后回流至使用区域,废弃物则运送出车间。
3 生物安全分析
根据《药典》中常用生物制品生产用菌毒种危害程度分类,水痘减毒活疫苗使用的V-Oka 疫苗株定义为四类,所以在工艺设计时应该按照生物安全1级(BSL1)要求进行设计。在水痘减毒活疫苗原液生产车间,病毒操作区涉及到病毒操作,定义为有毒区,需与其他功能区域严格分开设置,并且病毒操作区需考虑一定的防护措施,来满足生物安全要求。
(1)病毒操作区的空调系统要独立设置,不可与无毒区空调共用。病毒操作区排风需要经过高效过滤器处理后高空排放。病毒操作区相对于其他相邻区域应该是负压,形成负压陷阱,防止活病毒逸出。
(2)病毒操作区人员更衣采用单向控制,即人员分通道进入和退出,以避免人员退出时衣服上所带的微粒和微生物污染更衣区,或者生产操作时产生的有害物质通过更衣区外溢。病毒操作区污物需经高压灭菌柜消杀后方可传出,保证活病毒不外逸。
(3)工艺用纯水和注射水系统采用有毒区单独设置系统的方式,病毒操作区单独设置水罐和循环系统,可有效避免压力异常时对无毒区的污染。
(4)设置生物活性废水处理间,将病毒操作区的排水管道接入生物活性废水处理间的灭活罐,活毒废水经高温灭菌处理后方可同其他废水排入厂区污水处理站进行后续处理[5]。
4 结束语
综上所述,在进行水痘减毒活疫苗原液生产车间工艺设计时,需要从生产工艺流程、相关设计规范和标准以及生物安全控制等方面综合考虑,对有毒区和无毒区进行合理划分,合理设计人物流流线。在满足生产流程和操作需求的情况下,合理布局工艺平面,将交叉污染的风险降至最低。随着生物制药技术的发展和设备自动化程度的提高,现代化、高标准的疫苗生产车间对工艺设计提出了更高的要求,需不断优化设计方案,在实践中加以检验并逐步提高。

