弥漫大B细胞淋巴瘤中CD27的表达及临床意义
葛晓雯,朱 娜,姚家美,高 峰,曾海英,栾丽娟,纪 元,谭云山,侯英勇
淋巴瘤分为霍奇金淋巴瘤(Hodgkin’s lymphoma/Hodgkin’s disease, HL)和非霍奇金淋巴瘤(non-Hodgkin’s lymphoma, NHL)。B细胞型非霍奇金淋巴瘤(B cell non-Hodgkin’s lymphoma, B-NHL)发病率占淋巴瘤的90%以上,其中弥漫大B细胞淋巴瘤(diffuse large B cell lymphoma, DLBCL)发病率占B-NHL的30%~60%[1-2],常见于成人。DLBCL分为生发中心细胞(germinal center B-cell like, GCB)型和非生发中心细胞(non-germinal center B-cell like, non-GCB)型。CD27是肿瘤坏死因子受体超家族的一员,是相对分子质量为5.5×104的Ⅰ型跨膜糖蛋白,与其配体CD70相互作用[3],参与B细胞成熟过程,表达于记忆B细胞和产免疫球蛋白(Ig)的B细胞等细胞表面[3-4]。文献报道其在多种B细胞淋巴瘤表面均有不同程度的表达[3],但其表达的临床意义仍不明确。本文采用免疫组化EnVision法检测DLBCL组织中CD27等蛋白的表达,同时采用FISH技术检测肿瘤组织中MYC、BCL-2、BCL-6基因的重排情况,以进一步明确CD27表达的临床意义。
1 材料与方法
1.1 临床资料收集2015~2018年复旦大学附属中山医院确诊且临床资料完整的143例DLBCL作为研究对象。其中男性77例,女性66例。≤60岁者72例,>60岁者71例,中位年龄60岁。所有DLBCL均依据WHO(2008)诊断标准和2016年修订标准[5]确诊,并应用Hans法则进行分型,其中GCB型68例,non-GCB型75例。Ann Arbor分期:Ⅰ期16例,Ⅱ期28例,Ⅲ期16例,Ⅳ期83例。国际预后指数(international prognostic index, IPI)评分:0分9例,1分29例,2分31例,3分37例,4分患25例,5分12例。HE、免疫组化均由两位经验丰富的病理医师阅片证实,FISH结果由3名实验员分别计数,取其平均值。本实验经复旦大学附属中山医院医学伦理委员会批准(B2018-073R)。
1.2 方法
1.2.1免疫组化 组织芯片经切片后行HE染色及免疫组化EnVision染色。一抗包括CD20、PAX-5、CD10、BCL-6、BCL-2、MUM1、C-MYC、CD3、CD5、Ki-67等,购自北京中杉金桥公司,CD27抗体购自美国Proteintech公司。免疫组化试剂盒购自罗氏诊断产品(上海)有限公司,利用全自动免疫组化染色仪(罗氏公司的BenchMark XT)进行染色。结果判定:CD27阳性定位于细胞膜。>75%的细胞无着色为0分,>75%的细胞浅黄色着色为1分,>75%的细胞黄色着色为2分,>75%的细胞棕黄色着色为3分。0~1分为阴性,2~3分为阳性。
1.2.2FISH检测 所用探针均购于美国雅培公司(Vysis BCL-2 Break Apart FISH Probe Kit、Vysis BCL-6 Break Apart FISH Probe Kit、Vysis MYC Break Apart FISH Probe Kit)。石蜡切片脱蜡后放入蒸馏水,在82 ℃的蒸馏水中预处理25~30 min,37 ℃胃蛋白酶(Sigma公司)溶液中消化后梯度乙醇脱水、风干,利用Thermo Brite杂交仪(Abbott公司)按探针说明书提供的方法进行操作。在荧光显微镜(BX5l,Olympus公司)下观察。结果判定:正常细胞显示2个红色、2个绿色信号。根据本实验探针属性,红、绿信号分离为阳性信号。在CD27免疫组化切片上划出阳性区域,FISH读片时依据CD27阳性区域观察该区域内BCL-2、BCL-6和MYC基因的重排情况,以该区域内肿瘤细胞平均出现15%阳性信号为阳性阈值。每个标本由3名实验员分别计数,取其平均值。本实验未将“双打击”或“三打击”高级别B细胞淋巴瘤病例纳入研究对象。
1.3 随访随访以门诊或电话方式进行,所有患者随访5~57个月,随访内容包括患者生活质量、一般情况、近期复查等。总生存期(overall survival, OS)指自病理确诊至因任何原因死亡的时间。
1.4 统计学分析采用SPSS 19.0软件进行统计学分析,DLBCL中CD27表达与临床病理特征的关系行Pearson χ2检验,若理论频数T<5且T≥1,采用χ2检验的连续校正公式,若理论频数T<1,采用χ2检验的Fisher精确概率法。生存分析采用Kaplan-Meier分析。以双侧P<0.05为差异有统计学意义。
2 结果
2.1 DLBCL组织中CD27的表达CD27蛋白的表达定位于细胞膜,代表性FISH阳性结果见图1。3种FISH探针阳性信号均为红绿分离。本组实验中MYC、BCL-2和BCL-6基因易位发生率分别为8.4%、8.4%和25.2%,本实验未将“双打击”或“三打击”高级别B细胞淋巴瘤病例纳入研究对象。143例DLBCL中CD27的0分者27例(18.9%),1分者70例(49.0%),2分者32例(22.4%),3分者14例(9.8%)(图2)。按本实验0~1分定义为CD27阴性,2~3分定义为CD27阳性,CD27蛋白阳性者46例,阳性率为32.2%。
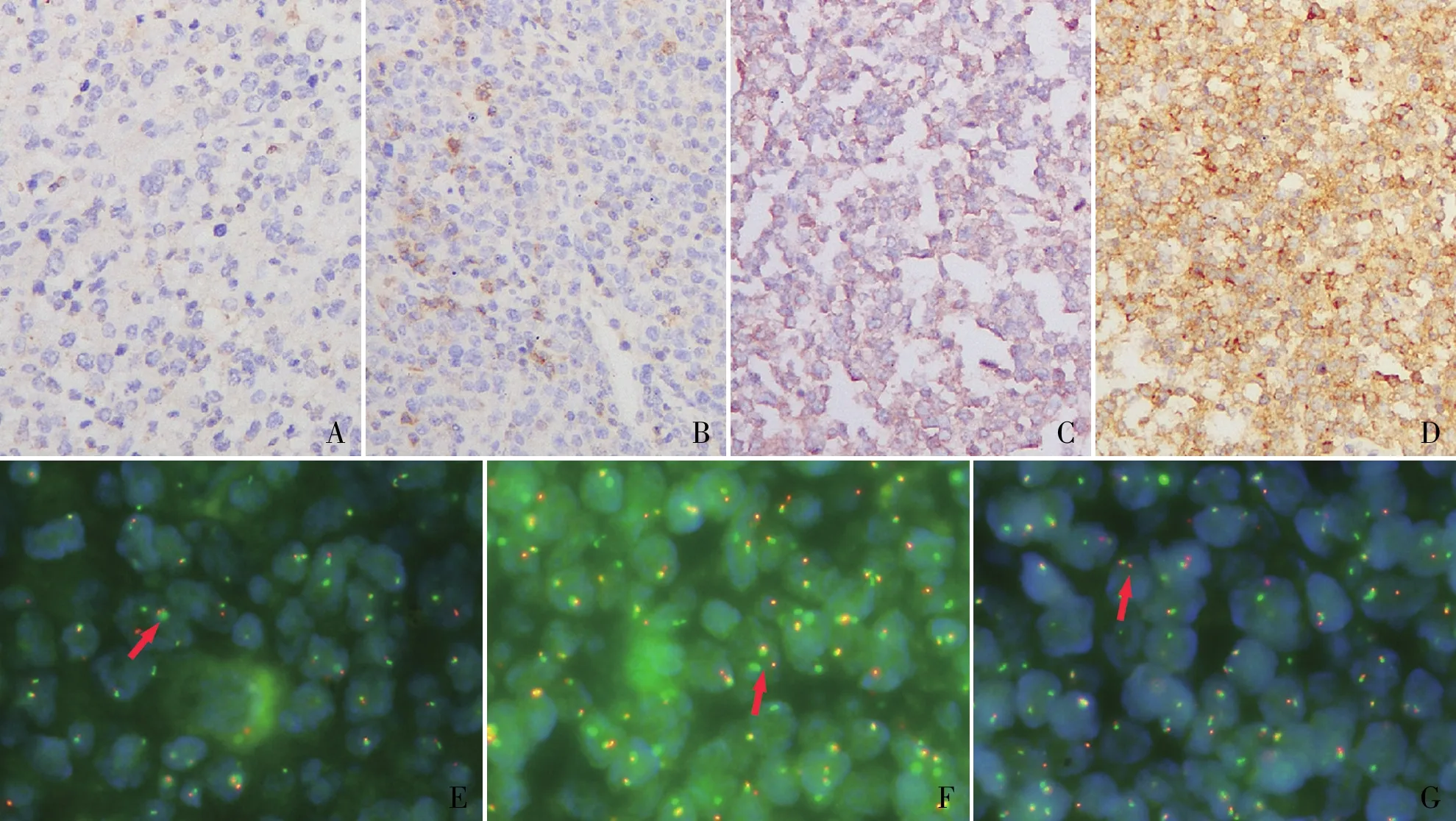
图1 CD27在DLBCL中的表达,EnVision法:A.0分;B.1分;C.2分;D.3分;E.FISH检测MYC基因重排阳性(箭头);F.FISH检测BCL-2基因重排阳性(箭头);G.FISH检测BCL-6基因重排阳性(箭头)
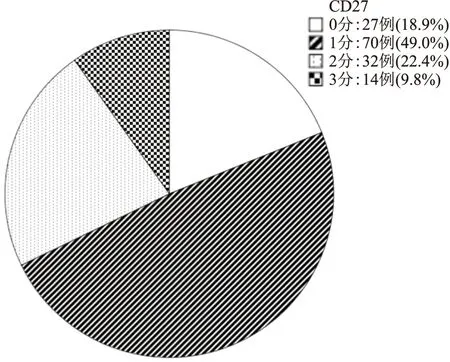
图2 CD27在DLBCL中的表达分布
2.2 DLBCL中CD27表达与临床病理特征的关系χ2检验发现,CD27阳性组中BCL-2基因重排阳性率(17.4%)明显高于CD27阴性组(4.1%),差异有统计学意义(P<0.05)。CD27蛋白阴性组及CD27蛋白阳性组的患者年龄、性别、Hans分型、Ann Arbor分期、IPI评分、MYC基因重排及BCL-6基因重排等相比差异无统计学意义(P>0.05,表1)。
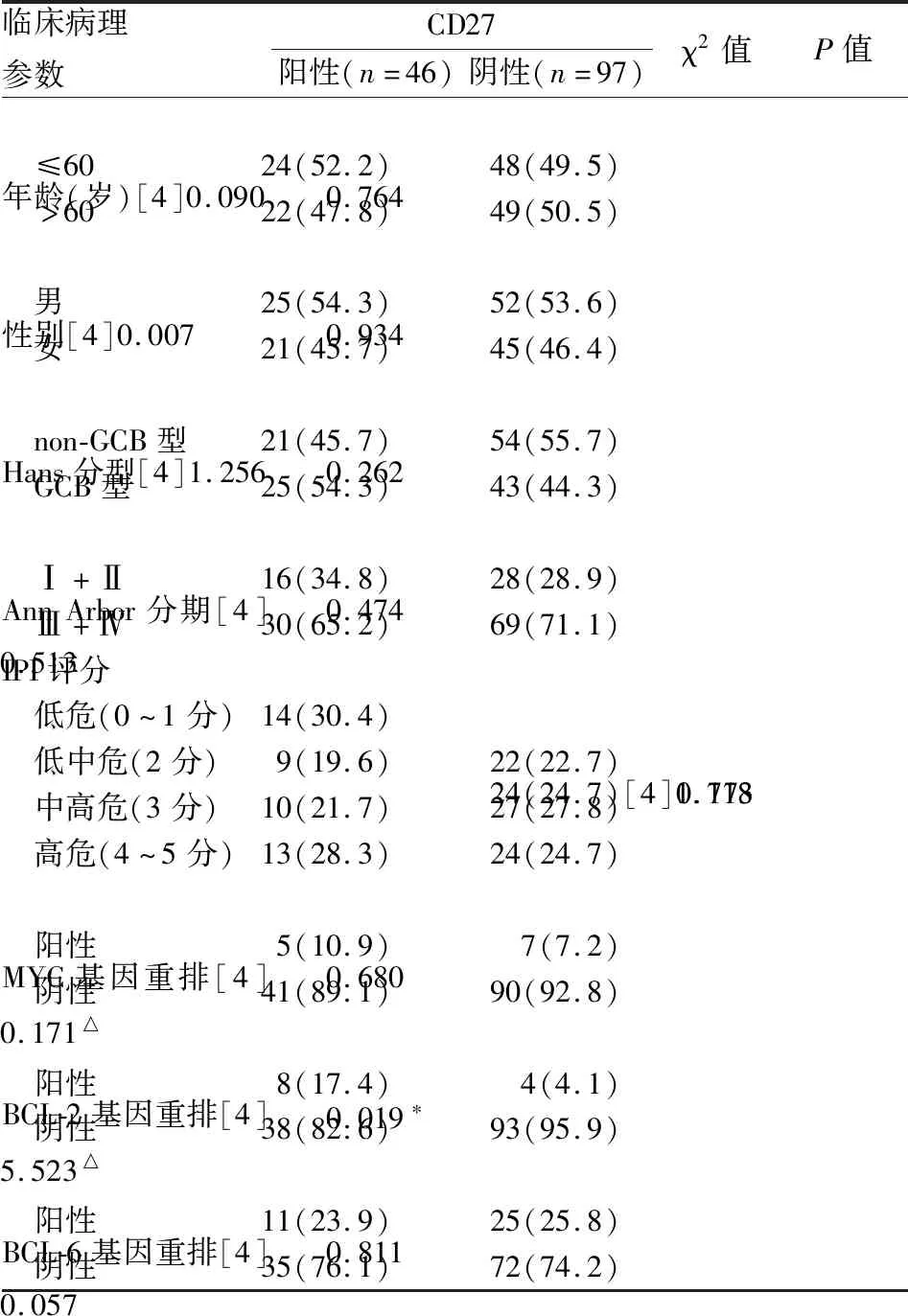
表1 DLBCL中CD27表达与临床病理特征的关系[n(%)]
*P<0.05;△连续性校正的χ2检验
2.3 DLBCL组织中CD27蛋白表达与预后的关系本组143例DLBCL患者随访5~57个月,其中46例CD27阳性患者中14例因疾病死亡,32例至随访结束仍生存;97例CD27阴性组患者中15例因疾病死亡,82例患者至随访结束仍生存。CD27阳性组患者病死率(30.4%,14/46)明显高于CD27阴性组(15.5%,15/97),差异有统计学意义(χ2=4.326,P=0.038)。CD27阳性组OS为(33.8±2.5)个月(95%CI=28.8~38.8个月)。CD27阴性组OS为(49.4±1.8)个月(95%CI=45.8~53.0个月)。Kaplan-Meier生存曲线示,CD27阳性者与阴性者的生存曲线差异有显著性(χ2=4.485,P=0.034),阳性组OS较短(图3)。
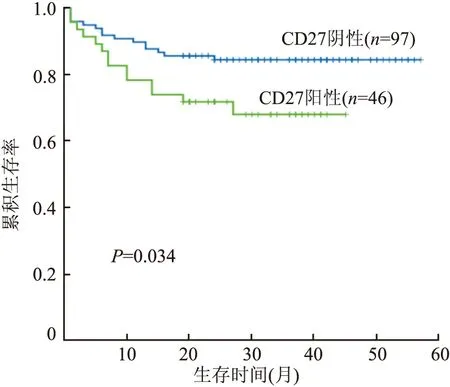
图3 CD27阳性组和CD27阴性组DLBCL患者的生存曲线
3 讨论
CD27主要表达于记忆性B细胞、生发中心的B细胞、幼稚T细胞、记忆性T细胞、自然杀伤细胞等细胞表面[3]。正常淋巴组织中CD27表达于滤泡边缘区和生发中心的B淋巴细胞,不表达于套区。CD27与其配体CD70结合后促进T细胞的活化与增殖,诱导效应T细胞与记忆T细胞的分化与形成[3]。原始B细胞不表达CD27,然而当B细胞受体被激活后,CD27可以长时间表达于B细胞表面,并且在B淋巴细胞的生长、分化等活动中起重要作用。CD27蛋白也可以在B细胞淋巴瘤的细胞表面表达。有研究显示广泛的B细胞淋巴瘤表达CD27,如慢性淋巴细胞白血病/小淋巴细胞淋巴瘤、套细胞淋巴瘤、Burkitt淋巴瘤、边缘区B细胞淋巴瘤、浆细胞瘤/多发性骨髓瘤、滤泡性淋巴瘤和弥漫大B细胞淋巴瘤等[3],前体B淋巴母细胞淋巴瘤/白血病未见CD27的表达。虽然CD27被认为是幼稚和记忆B细胞的表面标志物[6],表达于淋巴瘤细胞表面时,不能提示其细胞来源。越来越多的研究证明,CD27表达与淋巴瘤细胞生存、免疫逃逸等密切相关。可溶性CD27(sCD27)在Waldenström巨球蛋白血症肿瘤细胞中表达上调,应用CD27配体CD70的单抗后,肿瘤细胞生长受到抑制[7]。Jak等[8]研究发现慢性淋巴细胞白血病/小淋巴细胞淋巴瘤组织中通过CD70诱导的调节性T细胞(Tregs)数量增多,且这种Tregs不易凋亡,提示CD27/CD70通路能诱导肿瘤的免疫逃逸。本组143例DLBCL患者中,CD27蛋白阳性者46例,阳性率为32.2%,CD27阳性者与阴性者的Kaplan-Meier生存曲线差异有显著性(χ2=4.485,P=0.034),阳性组生存期较短,提示CD27高表达与DLBCL的不良预后有关。
研究发现DLBCL患者中,MYC基因易位发生率约为14%,BCL-2基因易位发生率约为21%,而BCL-6基因易位发生率约为31%[9]。本组中MYC、BCL-2和BCL-6基因易位发生率分别为8.4%、8.4%和25.2%,略低于文献报道的水平,可能与人群的地区差异及样本量差异有关。根据WHO(2016)淋巴组织肿瘤分类[5],将以往的介于Burkitt淋巴瘤与DLBCL形态之间的“灰区”淋巴瘤归为高级别B细胞淋巴瘤,其中发生MYC、BCL-2和(或)BCL-6基因重排的高级别B细胞淋巴瘤划分为新的独立类型,称为“双打击”或“三打击”高级别B细胞淋巴瘤,其发生率为6%~13%[10],而未发生者称为高级别B细胞淋巴瘤,非特指型。目前有研究表明,发生MYC、BCL-2和(或)BCL-6基因重排的“双打击”或“三打击”高级别B细胞淋巴瘤患者预后较差,不管临床上给予任何治疗方案,其中位生存期仅2个月~1.5年[11-13]。为了避免“双打击”或“三打击”对患者预后的影响,本实验未将“双打击”或“三打击”高级别B细胞淋巴瘤纳入分析对象。据统计,约65%的双打击淋巴瘤发生的是MYC和BCL-2易位,约14%的双打击淋巴瘤发生的是MYC和BCL-6易位[14]。BCL-2是抗凋亡的原癌基因,位于染色体18q21,编码抗凋亡蛋白,可抑制肿瘤细胞凋亡,发生染色体(14;18)(q32;q21)易位后,会导致BCL-2与IgH基因融合,使BCL-2蛋白异常高表达。已知BCL-2在多种肿瘤中过表达,并且与耐药相关[15]。BCL-2蛋白表达与DLBCL患者肿瘤的Ann Arbor分期有关[16]。有研究显示,BCL-2的过表达与DLBCL的不良预后有关[17]。进一步分析发现,单独的BCL-2重排可以作为DLBCL患者OS较低的预后指标[9,18]。本实验发现,CD27阳性组BCL-2重排阳性率(17.4%)明显高于CD27阴性组(4.1%),差异有统计学意义(P<0.05),但本组实验样本量有限,在大样本中是否存在这样的内在联系及其内在机制有待进一步更深入的探讨。
DLBCL患者的预后随着治疗方案的优化已经取得了明显的改善,但仍有约1/3的患者最终死于耐药或疾病复发[19],其耐药的具体分子机制目前尚不明确。在精准医学时代,研究影响DLBCL预后的因素有助于对不同患者制定更具有针对性的精准治疗方案。本实验结果提示,CD27高表达与DLBCL的不良预后有关,CD27有望成为评估DLBCL预后的生物学标志物之一。

