利用Trim-Away技术降低人胰岛淀粉样多肽在大鼠胰岛素瘤细胞中的毒性
龚葭薇,孔德麟,杨琳,聂玉哲,梁洋,滕春波
研究报告
利用Trim-Away技术降低人胰岛淀粉样多肽在大鼠胰岛素瘤细胞中的毒性
龚葭薇,孔德麟,杨琳,聂玉哲,梁洋,滕春波
东北林业大学生命科学学院,哈尔滨 150040
人胰岛淀粉样多肽(human islet amyloid polypeptide, hIAPP)又称胰淀素(Amylin),是胰岛β细胞中胰岛素的共分泌蛋白,与胰岛素共同包裹在囊泡中被分泌出细胞。正常生理条件下,hIAPP有助于胰岛素分泌并调节机体血糖平衡;但其蛋白错误折叠或过量积累则会对细胞造成毒性,进而影响β细胞功能,导致机体罹患2型糖尿病(type 2 diabetes mellitus, T2DM)。为了清除细胞内过度积累的hIAPP,且不影响其正常的合成功能,本研究选用一种新的蛋白质降解技术——Trim-Away,该技术可以在短时间内降解目标蛋白质,且不会对靶蛋白的mRNA转录、翻译等功能产生影响。首先在大鼠()胰岛素瘤细胞(insulinoma cells, INS1)中过表达模拟其过度累积的情况,并通过乳酸脱氢酶(lactate dehydrogenase, LDH)的释放、CCK8 (cell counting kit-8)的活性以及PI-Annexin V流式检测的阳性比例变化,证明hIAPP的过度积累造成β细胞的凋亡;通过实时定量PCR及ELISA检测发现胰岛素的合成和分泌都受到了阻碍;最后利用Trim-Away技术在过表达的INS1细胞中特异性清除了过度积累的hIAPP蛋白。细胞活性实验证实清除hIAPP蛋白可以减少细胞的死亡,ELISA实验证实INS1细胞恢复了胰岛素的分泌能力。本研究验证了hIAPP过度积累对INS1细胞的毒性作用,并且证明Trim-Away技术在清除胰腺β细胞中hIAPP毒性具有效果,为利用Trim-Away治疗糖尿病提供了新的策略。
Trim-Away;人胰岛淀粉样多肽;β细胞;胰岛素分泌
人胰岛淀粉样多肽(human islet amyloid polypeptide, hIAPP)是一种由37 aa构成的神经内分泌多肽激素[1],也被称为胰淀素(amylin)[2]。由89 aa构成的前激素原preproIAPP经历蛋白水解及翻译后修饰在内质网和高尔基体上被加工成熟[1],随后处于分泌泡外围,与核心的胰岛素、锌离子共分泌[3]。正常生理条件下,hIAPP协助胰岛素调节胃排空和饱腹感来维持血糖平衡[4]。hIAPP的自身结构特点导致其极易产生错误折叠,不断累积的错误折叠的hIAPP在机体胰岛素抵抗情况下抑制胰岛素分泌[5],并且hIAPP本身分泌量远远大于胰岛素,在细胞内外累积形成淀粉样多肽沉积[6]。1901年,Opie等[7]首次观察到hIAPP累积现象,这种现象被描述为“胰岛透明样化”。最初并非所有糖尿病患者体内都能观察到hIAPP累积,目前超过90%的2型糖尿病(type 2 diabetes mellitus,T2DM)患者体内存在该现象[8]。对动物模型的研究发现,hIAPP的累积先于β细胞功能紊乱和其他T2DM临床症状的发生[9]。研究表明,hIAPP累积会在脂质双分子层上形成非选择性离子通道,破坏脂质膜的稳定性,产生β细胞毒性[10]。在hIAPP聚集过程中也会产生活性氧自由基,引起DNA损伤[11];hIAPP的寡聚体会引起内质网应激、对线粒体造成损伤[12],使细胞功能受损、数量减少,从而诱导人体罹患T2DM。在T1DM胰腺移植失败患者体内的大多数胰岛中也检测到hIAPP的累积,表明hIAPP累积是导致移植失败的因素之一[13]。
目前在细胞水平上降低目的蛋白表达主要有两种方式:一种是利用CRISPR对基因组DNA进行敲除;另一种是利用shRNA、siRNA等对mRNA进行敲低。而Trim-Away技术则是在蛋白水平上直接降解目标蛋白质,该技术既不需要对内源蛋白质做任何修饰,还可以在短时间内完成目的蛋白降解[14~16]。Trim21是TRIM家族成员之一,它具有E3泛素连接酶活性,是细胞内抗体的特异性受体。在细胞里表达并转入目的蛋白的抗体后,抗体会与目的蛋白结合,Trim21去识别抗体的Fc端,并能通过自身的RING结构域连接泛素蛋白酶体,形成蛋白酶体复合物,对细胞内的目的蛋白质进行降解[17~19]。
为了保护胰腺β细胞免受hIAPP诱导的细胞损伤,本研究在大鼠()胰岛素瘤细胞(insulinoma cells, INS1)中过表达建立β细胞功能障碍模型,利用Trim-Away技术清除细胞内外累积的hIAPP。通过碘化丙啶(propidium iodide, PI)、CCK8 (cell counting kit-8)以及胰岛素ELISA试剂盒检测等,发现清除累积的hIAPP可以抑制细胞死亡,恢复细胞增殖能力、胰岛素合成和分泌能力。由此证明利用Trim-Away技术可以清除细胞内外累积的hIAPP,并且该技术不影响新生的hIAPP和胰岛素,这对于调节由hIAPP累积引发的T2DM的血糖水平具有重要的临床应用价值。
1 材料与方法
1.1 hIAPP和Trim21过表达载体构建
提取人胰腺组织(哈尔滨医科大学惠赠) RNA,反转录为cDNA作为模板,PCR扩增获得片段;选用I或R I酶切位点,通过同源重组连接的方法,将片段连接到lv3-copGFP或pcDNA3.1载体(苏州吉玛基因公司)上,lv3- hIAPP-copGFP中与融合表达。
分别以人肝癌细胞HepG2和大鼠INS1细胞(美国ATCC细胞库)的cDNA为模板,PCR扩增获得相应片段与,选用R I酶切位点,通过同源重组连接的方法,将与分别连接到pcDNA3.1载体上。
序列合成及载体测序由吉林库美生物公司完成,PCR扩增引物序列见表1。
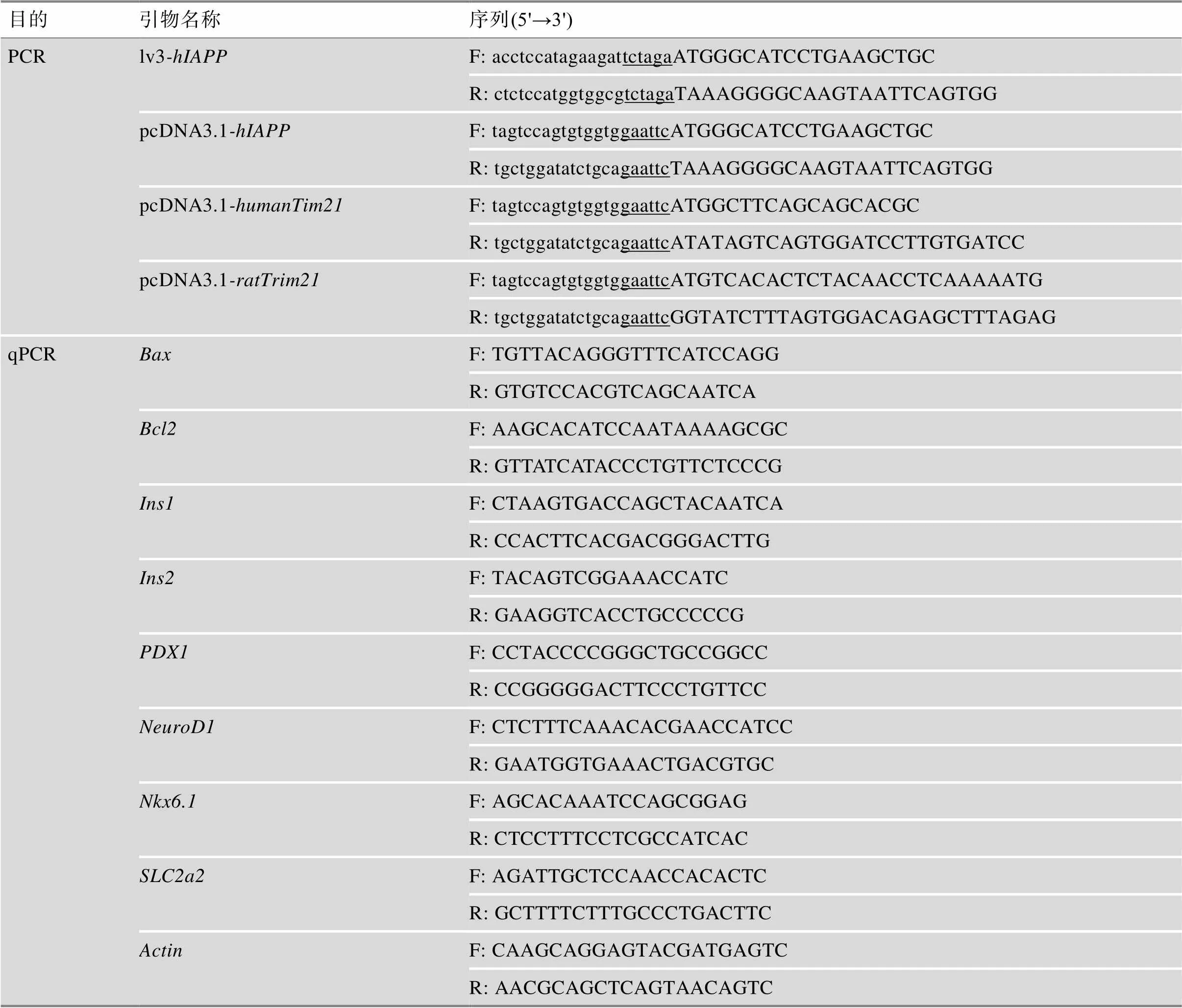
表1 本研究使用的引物序列
PCR扩增引物序列中,大写字母表示目的基因的cDNA序列,小写字母表示基础载体的同源臂序列,下划线表示酶切位点识别序列。
1.2 细胞培养及载体转染
大鼠INS1细胞培养在RPMI-1640培养基(美国HyClone公司) 中,添加10%胎牛血清(以色列Biological Industries公司)、2 mmol/L谷氨酰胺、10 mmol/L HEPES(美国Gibco公司)、1 mmol/L丙酮酸钠、100 U/mL青霉素和100 mg/mL链霉素(美国HyClone公司)、50 mmol/L巯基乙醇(美国Sigma公司),在37℃ (95%相对湿度,5% CO2)下培养。
人肝癌细胞HepG2培养在RPMI-1640培养基中,添加10%胎牛血清、2 mmol/L谷氨酰胺、100 U/mL青霉素和100 mg/mL链霉素,在37℃(95%相对湿度,5% CO2)下培养。
转染前将细胞按照5×104/孔密度铺在24孔内,转染过表达载体时,换成无双抗培养基,用lipo2000 (英潍捷基上海贸易有限公司)进行载体转染。
1.3 外源基因的电转化
使用Neon Transfection System电转化仪器(英潍捷基上海贸易有限公司)进行抗体的电转。对目的细胞用lipo2000转染过表达载体,48 h后,将细胞消化后计数。取106个细胞吸取120 μL R液重悬,同时加入2.5 μg抗体,轻轻混匀,电极外槽中加入E2液。设置1100 V 30 ms 2 pulse,将电转枪头插入外槽中,点击开始,结束后重新将细胞铺到孔板中,在Delta Vision高分辨率成像显微镜(美国通用电气公司)下进行观察。
1.4 PI-Annexin V染色以及流式细胞仪检测
INS1细胞过表达基因48 h后,经PBS清洗、胰酶消化、PBS重悬后计数,取5×104个细胞,加入195 μL Annexin V-FITC结合液,混匀后再加入5 μL Annexin V-FITC染色液,轻轻混匀,加入10 μL PI染色液,混匀后室温避光孵育20 min,期间混匀2~3次,20 min后上机检测。数据结果用软件GraphPad Prism v.7.0进行差异显著性分析。
1.5 蛋白免疫印迹(Western blot)
电转抗体4 h后,在RIPA (细胞强裂解液)中添加PMSF (蛋白酶抑制剂)裂解细胞并收集裂解液。用BCA (上海碧云天公司)测量蛋白浓度,加入上样缓冲液煮沸变性后,加入等量蛋白(可用1×上样缓冲液补齐)进行SDS-PAGE凝胶电泳,5%封闭液37℃封闭1 h,hIAPP一抗(武汉三鹰公司,cat# 22305-1-AP) 1:500 4℃孵育过夜;copGFP一抗(美国Origene公司,cat# TA150041) 1:1000 37℃孵育1 h;Actin一抗(美国Sigma Aldrich公司, cat# A5441) 1:5000 37℃孵育1 h;二抗(美国Thermo Fisher公司) 1:3000 37℃孵育1 h。抗体剥离时将膜置于剥离液中,52℃旋转孵育30 min。用ECL试剂(上海天能公司)检测目的蛋白免疫反应条带,使用软件Image J进行蛋白条带灰度分析以及用软件GraphPad Prism v.7.0进行数据统计及分析。
1.6 实时定量PCR (qPCR)检测凋亡及胰岛素分泌相关基因表达量
过表达载体转染48 h后,用RNAiso Plus (宝日医生物技术北京有限公司)收集细胞,提取细胞总RNA,用One-Step gDNA Removal试剂盒(北京全式金公司)将1 μg总RNA反转录成cDNA,加入Green qPCR SuperMix (北京全式金公司),用定量PCR仪(瑞士Roche公司)检测凋亡相关基因如、,以及胰岛素分泌相关基因如、和的mRNA相对表达量。引物由吉林库美生物公司合成,qPCR扩增引物序列见表1。数据用软件GraphPad Prism v.7.0进行统计及分析。
1.7 葡萄糖刺激胰岛素分泌
在经过电转化抗体入细胞,细胞恢复48 h后,用KRB (Krebs–Ringer bicarbonate buffer)缓冲液孵育细胞30 min,然后用2.8或16.7 mmol/L葡萄糖在37℃下刺激1 h。取细胞培养上清液,采用胰岛素ELISA试剂盒(南京建成生物工程研究所公司)利用酶标仪(瑞士Tecan公司)测定胰岛素含量。将细胞胰酶消化后计数,胰岛素含量数据利用总细胞数进行校正,用软件GraphPad Prism v.7.0进行统计及分析。
1.8 刚果红染色
采用刚果红检测hIAPP[20],PBS洗涤后,INS1细胞在室温下用4%多聚甲醛孵育15 min,用0.2% Triton-X 100打孔5 min。用无水酒精配置1.2%的刚果红染液,用氢氧化钠调节pH值为13.57,加入适量刚果红染液于细胞培养板中,室温下孵育20 min,用PBS洗去多余的染液。镜下观察后使用软件Image J进行染色强度分析,软件Graphpad prism 7整理数据得出统计结果,并进行差异显著性分析。
1.9 药物处理
根据实验需要,细胞转染后6 h,添加药物处理。按照20 μmol/L凋亡抑制剂Z-VAD-FMK和1 μmol/L坏死抑制剂NSA (美国Selleck Chemicals公司)的浓度,先将各药品加到50 μL新鲜培养基中,混合均匀后再分别添加到细胞培养孔板中,轻轻摇晃混匀后,继续培养。DMSO用作阴性对照。
1.10 统计分析
统计结果均采用GraphPad Prism v.7.0软件进行数据统计及分析,每组数据包含3次或以上独立实验,根据数据类型选择两组样本的“unpaired two-tailed Student's-test”或多组样本的“one-way ANOVA”算法进行差异显著性分析,<0.05被视为有显著性差异。
2 结果与分析
2.1 hIAPP累积对INS1细胞的毒性作用
向INS1细胞中转染pcDNA3.1-hIAPP,qPCR检测结果显示过表达效率达到2000倍(图1A),同时刚果红染色表明hIAPP在细胞内聚集(图1B),统计结果显示过表达后刚果红染色强度增强2.25倍(图1C)。转染后72 h,INS1细胞活力降低,显微镜下可直接观察到细胞密度和数目明显减少(图1D),CCK8检测结果表明过表达显著抑制细胞增殖能力(图1E)。此外,过表达后检测LDH的释放量增加1.33倍,表明其积累对细胞膜产生损伤(图1F)。通过PI染色及统计结果(图1,G和H)得出,在添加凋亡抑制剂Z-VAD-FMK和坏死抑制剂NSA后,PI染色阳性率细胞减少,说明抑制剂可以部分回复细胞死亡表型,同时表明hIAPP累积引起的细胞死亡包括凋亡和坏死两种类型。通过直接观察细胞形态(图1I)及CCK8检测(图1J)细胞活性,可以观察到添加Z-VAD-FMK组细胞数目明显增多、细胞活性增强,表明Z-VAD-FMK对细胞活性的回复程度比NSA大,说明细胞凋亡是hIAPP累积引起的细胞死亡主要类型。综上所述,的过表达抑制INS1细胞的增殖,hIAPP的累积对细胞膜产生毒性,并主要通过凋亡引起细胞死亡。
2.2 Trim-Away系统的构建与验证
本研究首先在HepG2和INS1细胞系中验证Trim- Away系统的可行性。分别扩增人和大鼠,连接到pcDNA3.1载体上,构建过表达载体,lv3基础载体用于过表达,copGFP绿色荧光蛋白用于待敲除蛋白,载体示意图见图2A。在HepG2或INS1细胞中转染pcDNA3.1-Trim21及lv3-copGFP载体,显微镜下观察。HepG2细胞中电转入copGFP抗体20 min后,荧光强度开始变化,在40 min内显著下降达50%,4 h后荧光基本消失(图2B)。统计结果也显示,荧光强度随时间而下降,4 h时降到最低(图2C)。在INS1细胞中也观察到类似的copGFP降解,并且在转入抗体24 h及48 h后,copGFP的荧光仍处于部分消失的情况(图2D),说明Trim-Away系统降解目的蛋白且能维持一段时间。因此,本研究成功地建立了Trim-Away系统,并在HepG2和INS1细胞中表现出快速、高效的性能。
2.3 Trim-Away系统减少hIAPP的累积
为了确定Trim-Away系统是否可以通过降解hIAPP来减少其毒性,本研究首先通过直接观察hIAPP-copGFP融合蛋白的荧光变化来检测其降解效率。在过表达大鼠和(载体示意图见图2A和图3A)的INS1细胞中,电转入hIAPP抗体后,观察到hAPP-copGFP的荧光几乎全部淬灭(图3B),统计结果显示荧光强度显著下降 83% (图3C),表明hIAPP抗体结合并降解了hIAPP- copGFP融合蛋白。Western blot检测hIAPP和copGFP蛋白水平,结果表明,hIAPP和copGFP蛋白表达水平均明显减少(图3D),统计结果也验证了hIAPP-copGFP融合蛋白含量减少50% (图3,E和F)。这表明hIAPP抗体、hIAPP-copGFP和rTrim21被募集到泛素蛋白酶体中并被降解。考虑到hIAPP- copGFP融合蛋白可能会影响Trim-Away的敲除效率,随后将pcDNA3.1-rTrim21过表达载体和无标签的pcDNA3.1-hIAPP过表达载体(载体构建示意图见图2A和图3A)转入INS1细胞中,Western blot检测hIAPP蛋白表达水平(图3,G和H),结果显示,在转入hIAPP抗体后外源hIAPP蛋白表达水平减少92%,此外与NC组对比,内源性的IAPP也有70%被降解。利用Trim-Away系统清除hIAPP时,加入IgG作为hIAPP抗体的对照,Western blot检测hIAPP蛋白表达水平,结果表明,加入IgG抗体组的hIAPP蛋白表达水平并未改变(图3I),结合统计结果(图3J),IgG抗体并未对hIAPP造成明显影响,也说明该系统严格进行了抗体与目标蛋白间的特异结合。
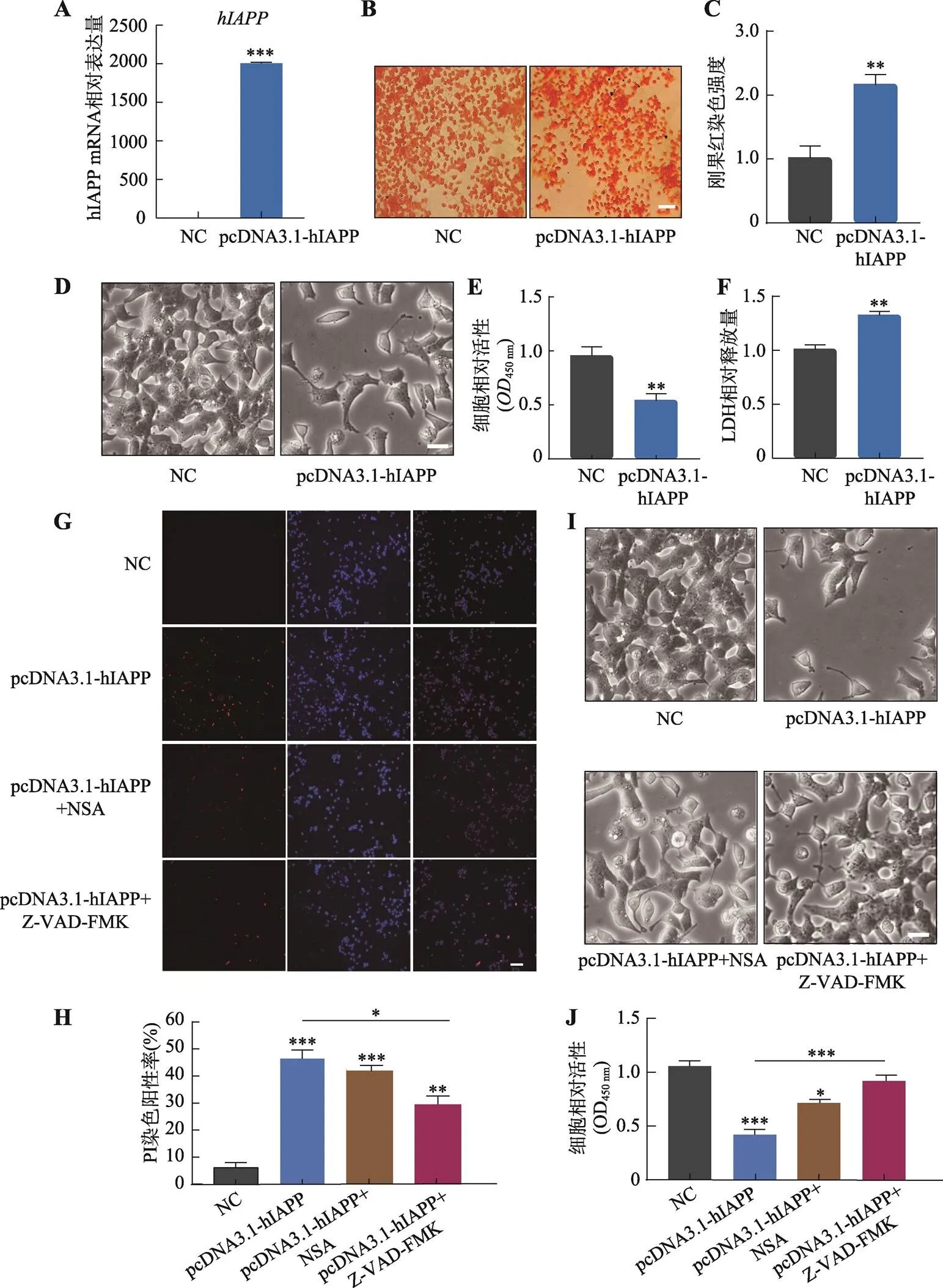
图1 hIAPP累积对INS1细胞的毒性作用
A:qPCR检测过表达。B、C:刚果红染色及染色强度统计过表达后的积累情况。D:显微镜下观察过表达后INS1细胞形态变化。E:CCK8检测过表达后的细胞活力。F:检测过表达后细胞LDH的释放量。G:显微镜下观察过表达及加入抑制剂后PI染色结果。其中红色为PI阳性细胞,蓝色为细胞核。H:PI染色统计分析结果。I:显微镜下观察加入抑制剂后细胞的形态变化。J:CCK8检测加入抑制剂后细胞的活性。B、G 图中标尺为100 μm,D、I图中标尺为50 μm;*:<0.05;**:<0.01;***:<0.001;A~F图中NC表示转入pcDNA3.1空白载体作为阴性对照,G~J图中NC表示转入pcDNA3.1空白载体后加入等体积DMSO作为阴性对照。
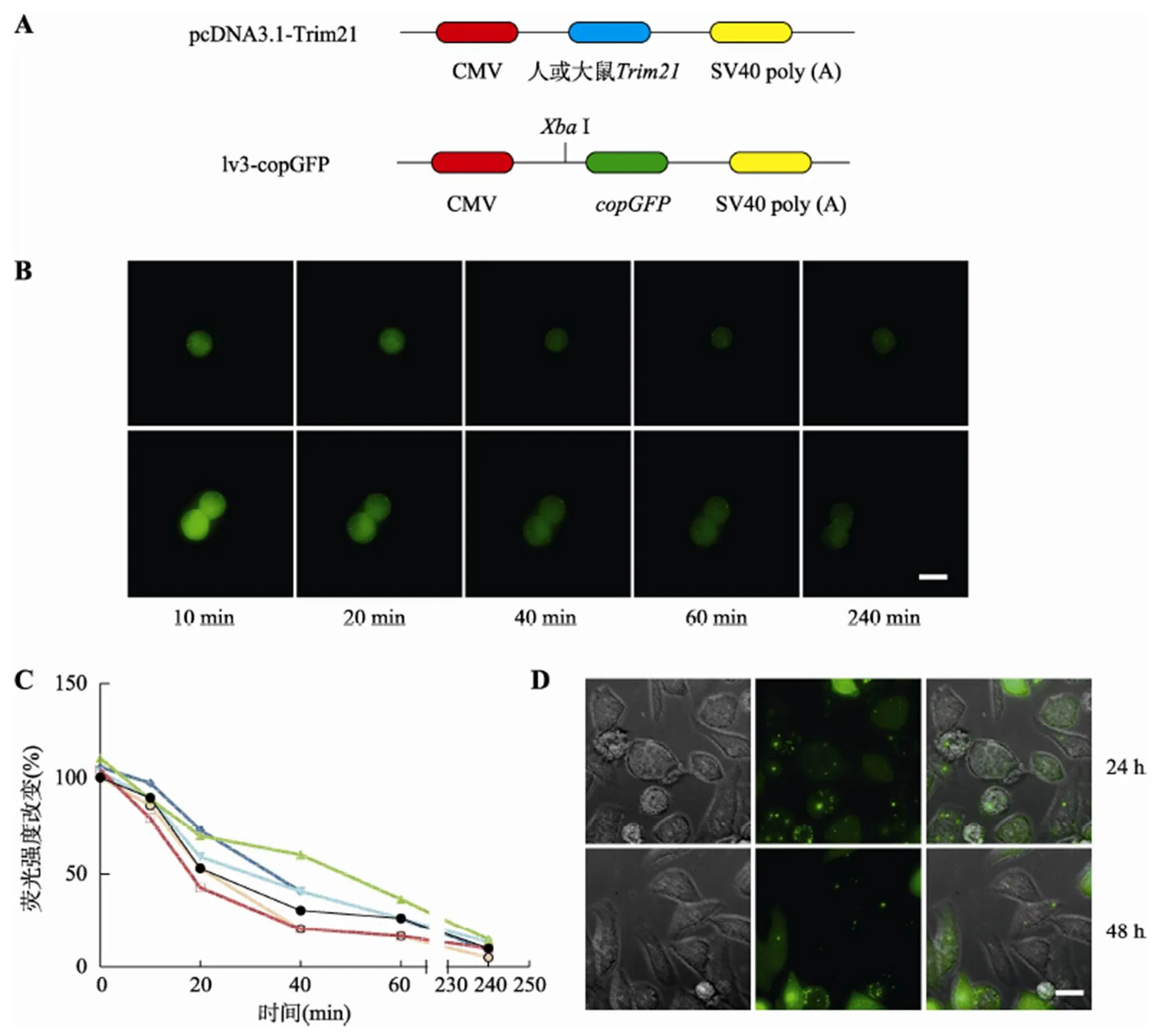
图2 Trim-Away系统的构建与验证
A:Trim-Away系统载体示意图。B:转入Trim-Away系统后HepG2细胞在两个不同视野下copGFP的荧光强度变化。C:转入Trim-Away系统后HepG2细胞中不同视野下检测到的荧光强度变化统计。不同颜色的6条折线表示所统计的6个不同视野随时间变化(横坐标)而降低的荧光强度(纵坐标)。D:转入Trim-Away系统24 h及48 h后显微镜下观察INS1细胞中copGFP的荧光变化。图中标尺为20 μm。
2.4 Trim-Away系统改善hIAPP诱导的INS1细胞死亡
如前所述,Trim-Away系统可以有效减少hIAPP的积累,因此推测该系统能对过表达导致的INS1细胞毒性起到改善作用。在向过表达的INS1细胞中转入hIAPP抗体后细胞的形态和数量发生显著恢复(图4A);同样,CCK8实验结果也显示,转入抗体能有效回复过表达引起的细胞活力下降(图4B)。与CCK8结果一致,hIAPP抗体转入后,LDH的释放量下降至与对照组相同(图4C),进一步证实了Trim-Away系统可以减弱hIAPP对细胞产生的毒性。这些结果表明,Trim-Away系统有效地抑制了hIAPP诱导的细胞死亡。由于凋亡是hIAPP诱导的INS1细胞死亡的主要类型,本研究采用流式细胞术检测细胞的凋亡情况。Annexin V-FITC单阳性细胞被认为是早期凋亡细胞,Annexin V-FITC和PI双阳性细胞被认为是晚期凋亡细胞或死亡细胞(图4D)。结果显示,Trim-Away系统可减少早期凋亡(由24.2%下调为14.9%)和晚期凋亡细胞(由12.2%下调为8.87%) (图4,E和F)。此外,本研究还利用qPCR检测了抗凋亡因子和促凋亡因子mRNA的相对表达量。当过表达时,表达升高,表达降低,比值升高(图4,G和H),表示细胞有发生凋亡的倾向,与图1G检测到的凋亡表型现象一致。在Trim-Away系统降低hIAPP积累水平后,比值回复(图4,G和H)。这些结果证明,Trim-Away系统靶向hIAPP的积累减少细胞凋亡,具有保护作用。
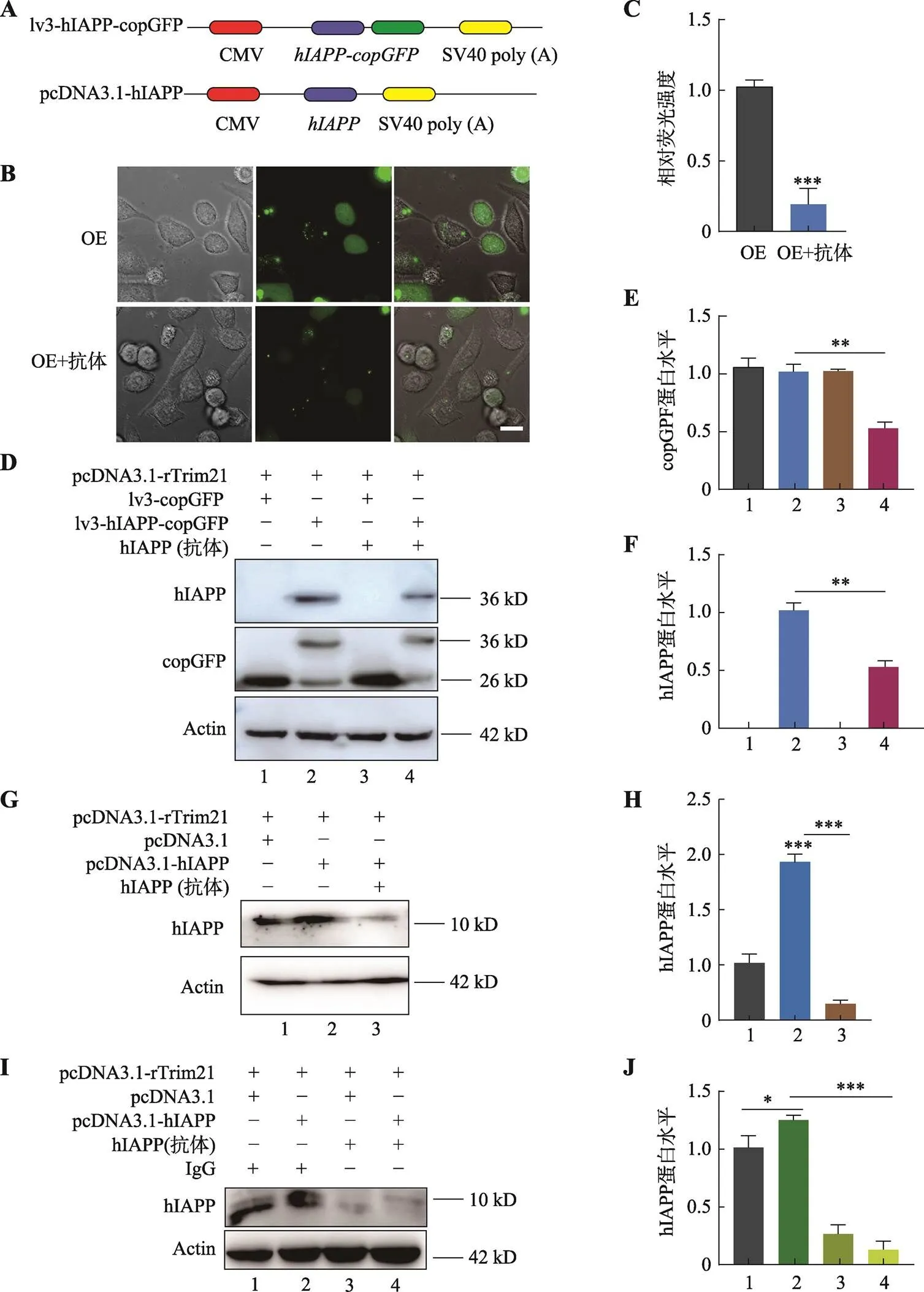
图3 Trim-Away系统减少hIAPP的累积
A:过表达载体示意图。B:转入Trim-Away系统后INS1细胞中hIAPP-copGFP融合蛋白的荧光变化。C:转入Trim-Away系统后荧光强度变化统计结果。D:Western blot检测转入Trim-Away系统后hIAPP-copGFP蛋白的表达水平。E、F:copGFP和hIAPP蛋白表达水平统计结果。G:Western blot检测转入Trim-Away系统后hIAPP蛋白的表达水平。H:G图中hIAPP蛋白表达水平统计结果。I:Western blot检测IgG作为hIAPP抗体对照实验条件下hIAPP的蛋白表达水平;J:I图中hIAPP蛋白表达水平的统计结果。B,C图中OE表示向INS1细胞中转入pcDNA3.1-rTrim21及lv3-hIAPP-copGFP,H图中OE表示向INS1细胞中转入pcDNA3.1-rTrim21及pcDNA3.1-hIAPP,OE+抗体表示过表达后转入hIAPP抗体,应用Trim-Away系统;图中标尺为20 μm;*:<0.05;**:<0.01;***:<0.001。

图4 Trim-Away系统可改善hIAPP诱导的INS1细胞死亡
A:显微镜下观察转入Trim-Away系统后INS1细胞数目的变化。B:CCK8检测转入Trim-Away系统后的细胞活性。C:转入Trim-Away系统后检测LDH的释放量。D:流式细胞仪检测PI-Annexin V染色的结果。E,F:D图中早期凋亡和晚期凋亡细胞数目的统计结果。G,H:qPCR检测转入Trim-Away系统后和mRNA的相对表达量。图中NC表示向INS1细胞中转入pcDNA3.1-rTrim21及pcDNA3.1空白载体作为阴性对照,OE表示向INS1细胞中转入pcDNA3.1-rTrim21及pcDNA3.1-hIAPP,OE+抗体表示过表达后转入hIAPP抗体,应用Trim-Away系统;标尺为50 μm;*:<0.05;**:<0.01;***:<0.001;:>0.05。
2.5 Trim-Away系统可减轻hIAPP累积对β细胞功能的损害
正常情况下,hIAPP与胰岛素共同分泌,hIAPP的过量或错误折叠会导致其在细胞膜内外积累和聚集,引起细胞毒性,影响β细胞分泌胰岛素。本研究使用刚果红染色检测hIAPP的积累,结果显示转入Trim-Away系统组较对照组hIAPP染色强度下降,说明减少了hIAPP的聚集(图5,A和B)。此外,qPCR结果显示,过表达组β细胞分泌胰岛素的相关基因如和的表达量减少,但Trim-Away系统转入后可以回复这些基因的表达水平(图5C)。随后,用ELISA试剂盒检测胰岛素的分泌能力,结果显示Trim- Away系统也回复了hIAPP抑制的胰岛素分泌(图5D)。这些结果表明,hIAPP累积会抑制胰岛素分泌,而Trim-Away系统通过减少hIAPP的积累减轻了β细胞功能的损伤。
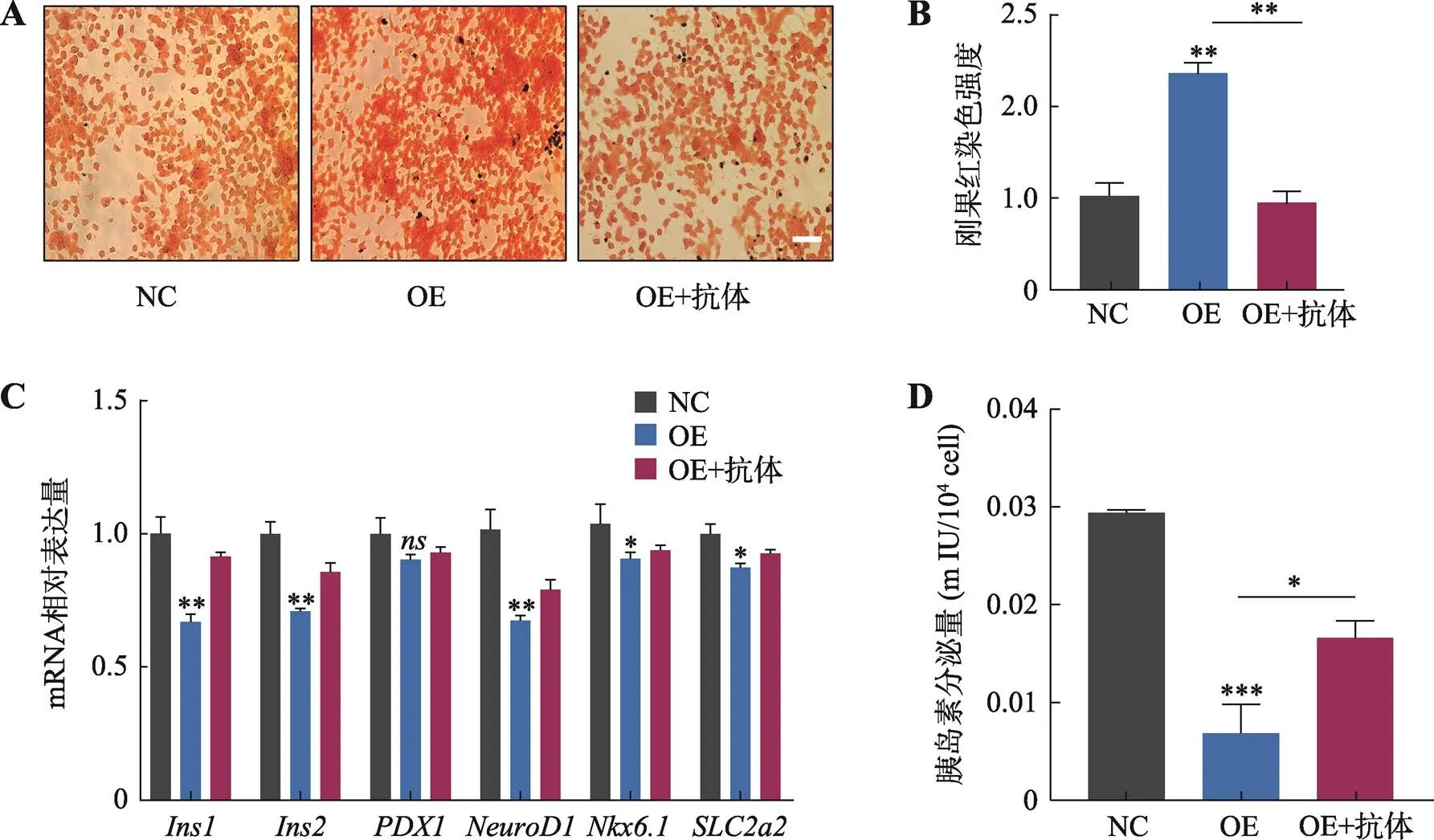
图5 Trim-Away系统可减轻hIAPP累积对β细胞功能的损害
A:显微镜下观察转入Trim-Away系统后刚果红染色结果。B:刚果红染色强度统计结果。C:qPCR检测转入Trim-Away系统后等胰岛素分泌相关基因mRNA的相对表达量变化。D:ELISA检测转入Trim-Away系统后的胰岛素分泌量变化。NC表示向INS1细胞中转入pcDNA3.1-rTrim21及pcDNA3.1空白载体作为阴性对照,OE表示向INS1细胞中转入了pcDNA3.1-rTrim21及pcDNA3.1-hIAPP,OE+抗体表示过表达后转入hIAPP抗体,应用Trim-Away系统;标尺为100 μm;*:<0.05;**:<0.01;***:<0.001;:>0.05。
3 讨论
在人()、猫()和非灵长类动物中 IAPP 的累积会导致糖尿病,但在啮齿类动物中不会导致糖尿病。已有研究报道IAPP在人、小鼠()、大鼠、猫和豚鼠()体内的20~29位氨基酸残基在不同物种间存在差异[21,22],这可能是在人类、猫和非灵长类动物细胞内外聚集而在啮齿动物体内不存在的原因。本研究利用大鼠胰岛素瘤细胞INS1过表达人源进行研究,证实过量的hIAPP可导致INS1细胞死亡,损害细胞功能。大鼠与人的IAPP蛋白除20~29位氨基酸不同外,其余氨基酸序列相似性很高,本研究所用抗体也可以识别INS1细胞中表达的rIAPP,如图3中Western blot结果显示对照组中出现hIAPP条带也属正常。由于INS1中不表达hIAPP,所以在转入hIAPP过表达载体后,qPCR检测结果显示高倍数的过表达效率(图1A)。
淀粉样变性是淀粉样物质在细胞内造成沉积,使细胞功能受损的一种临床症状。其特征有蛋白质的错误折叠,或淀粉样纤维的严重累积。研究表明许多疾病都与淀粉样变性相关,例如hIAPP与T2DM[23],淀粉样β肽(Aβ)、Tau蛋白与阿尔茨海默症(Alzheimer disease, AD)[24,25]以及朊蛋白(PrP)与海绵状脑病[26]等。其中hIAPP一般先形成毒性寡聚体,α螺旋结构增多,能够穿透细胞膜,然后进一步聚集形成成熟纤维,以β折叠结构为主,在细胞内外累积[27]。多种淀粉样蛋白聚集小分子抑制剂多为多酚类化合物,其中咖啡酸和绿原酸可以延缓α螺旋向β折叠结构的转变,并改变hIAPP最终形态的二级结构;水飞蓟宾可与hIAPP疏水表面结合抑制其聚集;丹酚酸B延缓α螺旋向β折叠结构的转变[28]。小分子抑制剂多是从中药或其他植物提取,因为人体产生hIAPP累积是个漫长的过程,日常摄入可以有效减少hIAPP的聚集,但是这些药物其他成分的长期摄入是否会产生副作用还未知。并且多酚类小分子的透膜性很差,目前还未很好解决[29]。此外小分子抑制剂的抑制作用主要依靠芳香烃结构,是否会对细胞内其他类似结构的化合物产生不利影响目前还不清楚,但抗体的特异性能很大程度地降低这些潜在的影响。一些自行设计并合成的短肽类也可以抑制淀粉样蛋白沉积,如短肽FLPNF可以通过增强脑啡肽酶活性进而抑制hIAPP聚集[30],但是增强脑啡肽酶活性是否会对多种肽类底物水解造成影响目前还不清楚。
应用CRISPR/Cas9、RNAi等技术可以在DNA或RNA水平上降低的表达,但这些技术降低其表达的同时也会抑制其正常生理功能,产生非特异性的缺陷,因此这些技术不适合清除已经合成的蛋白质[31]。Trim-Away利用抗体特异性和胞内泛素蛋白酶体系统去除过量的hIAPP蛋白,将对细胞其他成分产生的不良影响降到最低,并能正常转录和翻译。另外Trim-Away系统可以在60 min内降解80%左右的蛋白水平,比传统的敲除技术快得多。因此,该技术在提高细胞活力和改善胰岛素产生功能方面表现出良好的性能。
由于现在的培养技术尚不支持本研究对人类胰腺β细胞进行离体平面培养,所以本研究选择在大鼠细胞中进行模拟。但随着科学技术的进步,该技术定会对清除人β细胞里hIAPP累积有所帮助。在实际临床运用中最大的问题是如何将hIAPP抗体在需要的时候引入患者体内并靶向胰岛细胞。目前,通过转入特异性抗体的cDNA在小鼠、牛、家蚕等生物体内表达抗体的技术已经比较成熟[32,33]。可以利用腺病毒诱导特定细胞表达特异性抗体Fc结构域,克服长期引入抗体的限制。此外,应用纳米技术或其他科技手段可以加载hIAPP抗体,并能根据胰岛细胞的特异性标志物靶向胰岛细胞。而且针对内源性hIAPP的特异性抗体已经被研发出来,可以区别前体hproIAPP及成熟的hIAPP、寡聚及聚集的、纤维状和非纤维状的hIAPP,所以精确调控内源性hIAPP指日可待。综上所述, Trim-Away技术可以改善由于hIAPP累积而对β细胞产生的毒性及功能损伤,为β细胞功能损伤导致的2型糖尿病提供基础依据。
[1] Westermark P, Wernstedt C, Wilander E, Hayden DW, O'Brien TD, Johnson KH. Amyloid fibrils in human insulinoma and islets of Langerhans of the diabetic cat are derived from a neuropeptide-like protein also present in normal islet cells., 1987, 84(11): 3881–3885.
[2] Cooper GJ, Leighton B, Dimitriadis GD, Parry-Billings M, Kowalchuk JM, Howland K, Rothbard JB, Willis AC, Reid KB. Amylin found in amyloid deposits in human type 2 diabetes mellitus may be a hormone that regulates glycogen metabolism in skeletal muscle., 1988, 85(20): 7763–7766.
[3] Westermark P, Li ZC, Westermark GT, Leckstrom A, Steiner DF. Effects of beta cell granule components on human islet amyloid polypeptide fibril formation., 1996, 379(3): 203–206.
[4] Westermark P, Andersson A, Westermark GT. Islet amyloid polypeptide, islet amyloid, and diabetes mellitus.,2011, 91(3): 795–826.
[5] Akesson B, Panagiotidis G, Westermark P, Lundquist I. Islet amyloid polypeptide inhibits glucagon release and exerts a dual action on insulin release from isolated islets., 2003, 111(1–3): 55–60.
[6] Westermark P, Wernstedt C, O'Brien TD, Hayden DW, Johnson KH. Islet amyloid in type 2 human diabetes mellitus and adult diabetic cats contains a novel putative polypeptide hormone., 1987, 127(3): 414– 417.
[7] Opie EL. On the relation of chronic interstitial pancreatitis to the islands of Langerhans and to diabetes melutus., 1901, 5(4): 397–428.
[8] Jurgens CA, Toukatly MN, Fligner CL, Udayasankar J, Subramanian SL, Zraika S, Aston-Mourney K, Carr DB, Westermark P, Westermark GT, Kahn SE, Hull RL. β-cell loss and β-cell apoptosis in human type 2 diabetes are related to islet amyloid deposition.,2011, 178(6): 2632–2640.
[9] Guardado-Mendoza R, Davalli AM, Chavez AO, Hubbard GB, Dick EJ, Majluf-Cruz A, Tene-Perez CE, Goldschmidt L, Hart J, Perego C, Comuzzie AG, Tejero ME, Finzi G, Placidi C, La Rosa S, Capella C, Halff G, Gastaldelli A, DeFronzo RA, Folli F. Pancreatic islet amyloidosis, β-cell apoptosis, and α-cell proliferation are determinants of islet remodeling in type-2 diabetic baboons.,2009, 106(33): 13992–13997.
[10] Merikallio H, Turpeenniemi-Hujanen TT, Paakko P, Makitaro R, Kaarteenaho R, Lehtonen S, Salo S, Salo T, Harju T, Soini Y. Slug is associated with poor survival in squamous cell carcinoma of the lung., 2014, 7(9): 5846–5854.
[11] Gurlo T, Ryazantsev S, Huang CJ, Yeh MW, Reber HA, Hines OJ, O'Brien TD, Glabe CG, Butler PC. Evidence for proteotoxicity in beta cells in type 2 diabetes: toxic islet amyloid polypeptide oligomers form intracellularly in the secretory pathway., 2010, 176(2): 861–869.
[12] Li XL, Chen TF, Wong YS, Xu G, Fan RR, Zhao HL, Chan JC. Involvement of mitochondrial dysfunction in human islet amyloid polypeptide-induced apoptosis in INS-1E pancreatic beta cells: An effect attenuated by phycocyanin., 2011, 43(4): 525– 534.
[13] Clift D, McEwan WA, Labzin LI, Konieczny V, Mogessie B, James LC, Schuh M. A method for the acute and rapid degradation of endogenous proteins.,2017, 171(7): 1692–1706.
[14] Leon Fradejas M, Kandil D, Papadimitriou JC, del Pino Florez Rial M, Prieto Sanchez E, Drachenberg CB. Islet amyloid in whole pancreas transplants for type 1 Diabetes Mellitus (DM): possible role of type 2 DM for graft failure., 2015, 15(9): 2495–2500.
[15] Clift D, Schuh M. A three-step MTOC fragmentation mechanism facilitates bipolar spindle assembly in mouse oocytes.,2015, 6: 7217.
[16] Clift D, Schuh M. Restarting life: fertilization and the transition from meiosis to mitosis., 2013, 14(9): 549–562.
[17] James LC, Keeble AH, Khan Z, Rhodes DA, Trowsdale J. Structural basis for PRYSPRY-mediated tripartite motif (TRIM) protein function., 2007, 104(15): 6200–6205.
[18] Mallery DL, McEwan WA, Bidgood SR, Towers GJ, Johnson CM, James LC. Antibodies mediate intracellular immunity through tripartite motif-containing 21 (TRIM21).,2010, 107(46): 19985–19990.
[19] Rhodes DA, Isenberg DA. TRIM21 and the function of antibodies inside cells.,2017, 38(12): 916–926.
[20] Dong HR, Wang YY, Yang M, Sun LJ, Cheng H, Shen YP. An evaluation of various congo red staining and different microscopic observation for the diagnosis of renal amyloidosis.2016, 17(11): 956–958.董鸿瑞, 王艳艳, 杨敏, 孙丽君, 程虹, 谌贻璞. 不同刚果红染色及观察方法对肾脏淀粉样变病诊断的研究. 中国中西医结合肾病杂志, 2016, 17(11): 956–958.
[21] Nishi M, Chan SJ, Nagamatsu S, Bell GI, Steiner DF. Conservation of the sequence of islet amyloid polypeptide in five mammals is consistent with its putative role as an islet hormone., 1989, 86(15): 5738–5742.
[22] Betsholtz C, Christmanson L, Engstrom U, Rorsman F, Jordan K, O'Brien TD, Murtaugh M, Johnson KH, Westermark P. Structure of cat islet amyloid polypeptide and identification of amino acid residues of potential significance for islet amyloid formation.,1990, 39(1): 118–122.
[23] Kahn SE, Andrikopoulos S, Verchere CB. Islet amyloid: a long-recognized but underappreciated pathological feature of type 2 diabetes., 1999, 48(2): 241–253.
[24] Nakamura A, Kaneko N, Villemagne VL, Kato T, Doecke J, Dore V, Fowler C, Li QX, Martins R, Rowe C, Tomita T, Matsuzaki K, Ishii K, Ishii K, Arahata Y, Iwamoto S, Ito K, Tanaka K, Masters CL, Yanagisawa K. High performance plasma amyloid-β biomarkers for Alzheimer's disease.,2018, 554(7691): 249–254.
[25] Lo AC, Iscru E, Blum D, Tesseur I, Callaerts-Vegh Z, Buee L, De Strooper B, Balschun D, D'Hooge R. Amyloid and Tau neuropathology differentially affect prefrontal synaptic plasticity and cognitive performance in mouse models of Alzheimer's Disease.,2013, 37(1): 109–125.
[26] Imran M, Mahmood S. An overview of animal prion diseases., 2011, 8(6): 493.
[27] Haataja L, Gurlo T, Huang CJ, Butler PC. Islet amyloid in type 2 diabetes, and the toxic oligomer hypothesis.,2008, 29(3): 303–316.
[28] Cheng B. Research on inhibitors of toxic aggregation of human islet amyloid peptide [Dissertation]. Huazhong University of Science and Technology, 2014.程彪. 人胰岛淀粉样多肽毒性聚集的抑制剂研究[学位论文]. 华中科技大学, 2014.
[29] Wang QQ, Guo JJ, Jiao PZ, Liu HX, Yao XJ. Exploring the influence of EGCG on the β-sheet-rich oligomers of human islet amyloid polypeptide (hIAPP1-37) and identifying its possible binding sites from molecular dynamics simulation., 2014, 9(4): e94796.
[30] Shi Y, Jiao A, Lin JZ, Zhang CS, Sun N, Zhang JL. Study of reduction of hIAPP aggregation by short peptide FLPNF in INS-1 cells., 2019, 39(6): 377–382.石悦, 焦奥, 林建贞, 张城硕, 孙宁, 张佳林. 短肽FLPNF抑制大鼠胰岛素瘤INS-1细胞内hIAPP聚集的研究. 国际内分泌代谢杂志, 2019, 39(6): 377–382.
[31] Niu XR, Yin SM, Chen X, Shao TT, Li DL. Gene editing technology and its recent progress in disease therapy., 2019, 41(7): 582–598.牛煦然, 尹树明, 陈曦, 邵婷婷, 李大力. 基因编辑技术及其在疾病治疗中的研究进展. 遗传, 2019, 41(7): 582–598.
[32] Reis U, Blum B, von Specht BU, Domdey H, Collins J. Antibody production in silkworm cells and silkworm larvae infected with a dual recombinant bombyx mori nuclear polyhedrosis virus., 1992, 10(8): 910–912.
[33] Zu Putlitz J, Kubasek WL, Duchene M, Marget M, von Specht BU, Domdey H. Antibody production in baculovirus- infected insect cells., 1990, 8(7): 651– 654.
Toxicity reduction of human islet amyloid polypeptide by Trim-Away technique in insulinoma cells
Jiawei Gong, Delin Kong, Lin Yang, Yuzhe Nie, Yang Liang, Chun-Bo Teng
Human islet amyloid polypeptide (hIAPP, also known as amylin) is a co-secreting protein of insulin in human pancreatic β-cells. It is encapsulated in vesicles and secreted out of the cells with insulin. hIAPP can promote insulin secretion and regulate blood glucose homeostasis in the body under the normal physiological conditions. However, hIAPP misfolding or excessive accumulation can cause toxic effects on the β cells, which in turn affect cell function, resulting in type 2 diabetes mellitus (T2DM) for the affected individuals. In order to eliminate the excessive accumulation of hIAPP in the cell and to maintain its normal synthetic function, we have adopted a new protein degradation technology called Trim-Away, which can degrade the target protein in a short time without affecting the mRNA transcription and translation synthesis function of the target protein. First, we overexpressed hIAPP in the rat insulinoma cells (INS1) to simulate its excessive accumulation and analyzed its effect in INS1 cells by measuring the release of LDH (lactate dehydrogenase), CCK8 activity and PI-Annexin V positive ratio. Results showed that excessive accumulation of hIAPP caused β cell apoptosis. Second, real-time quantitative PCR analysis and ELISA detection showed that the synthesis and secretion of insulin were hindered. We used Trim-Way technology to specifically eliminate the excessive accumulation of hIAPP protein in hIAPP overexpressing INS1 cells. Cell activity experiments confirmed that clearance of hIAPP reduced the cell death phenotype. Further ELISA experiments confirmed that INS1 cells restored insulin secretion ability. This study examined the toxic effect of hIAPP excessive accumulation in INS1 cells and demonstrated the cytotoxicity clearance effect of Trim-Way technology in pancreatic β-cells. Our research has provided a new strategy for using Trim-Away technology for treatment of diabetes.
Trim-Away; human islet amyloid polypeptide (hIAPP); β-cell; insulin secretion
2020-03-07;
2020-06-06
国家自然科学基金项目(编号:31472159)和黑龙江省自然科学基金重点项目(编号:ZD2017001)资助[Supported by the National Natural Science Foundation of China (No. 31472159), and the Natural Science Foundation of Heilongjiang Province (No. ZD2017001)]
龚葭薇,在读硕士研究生,专业方向:发育生物学。E-mail: 869268764@qq.com
滕春波,教授,博士生导师,研究方向:细胞生物学。E-mail: chunboteng@nefu.edu.cn
10.16288/j.yczz.20-061
2020/6/10 10:06:43
URI: kns.cnki.net/kcms/detail/11.1913.R.20200609.1526.002.html
(责任编委: 陈雁)

