氢气对野生型及Nrf2基因敲除型脓毒症小鼠血脑屏障损伤和认知功能障碍的影响
徐 革, 于 洋, 杨 曼, 于泳浩
脓毒症是一种严重的全身炎症反应综合征,主要表现为炎症分子过度释放、微静脉白细胞积聚增多、微血栓形成和微血管收缩,进而导致多器官功能衰竭[1]。许多脓毒症患者表现出认知障碍,称为脓毒症相关脑病(SAE)[2]。SAE的病理生理机制非常复杂,已有研究表明其与脑损伤有关,其中血脑屏障损伤是其主要原因之一[2-4]。研究表明,吸入氢气或摄入富氢水对预防脓毒症和其所致器官(包括肝、肠、肺和脑)损害有防治作用[5-8]。核因子E2相关因子2(nuclear factor erythroid-2 related factor 2,Nrf2)及其下游信号通路在氢气治疗脓毒症机制中有重要作用[9-10]。本研究旨在通过野生型及Nrf2基因敲除小鼠脓毒症模型探讨Nrf2在氢气治疗脓毒症所致SAE中的作用机制。
1 材料与方法
1.1 主要试剂与仪器 兔单克隆抗体VE钙黏蛋白(1∶1000, Cat#ab205336,),兔多克隆抗体 ZO-1(1∶1000, Cat#ab216880)均购自英国Abcam公司;鼠单克隆抗体β-actin(1∶2000, Cat#A5441),EB(Cat#E2129)均购自美国Sigma公司;山羊抗鼠抗体(1∶5000,Cat#31430),山羊抗兔抗体(1∶5000,Cat#31466),ECL化学发光液(Cat#34577)均购自美国Invitrogen公司,复方利多卡因乳膏(Cat#H20063466,北京紫光),高纯氢气发生器(CGH-300,天津同普分析仪器科技有限公司,中国),TF-1气体流量计(Yutaka Engineering,日本),氢气浓度检测器(HY-ALERTA手持探测器500型;H2扫描,Valencia,CA),电泳仪(DYY-6C,中国北京六一公司);垂直电泳槽、转膜槽均购自美国Bio-Rad公司;化学发光凝胶成像系统(FluorChem FC3,Protein Simple公司,美国)。
1.2 实验动物 本实验已获天津医科大学实验动物管理委员会批准。SPF级健康成年雌性野生型(WT)和Nrf2敲除型(Nrf2-/-)C57BL/6J小鼠各152只(6~8周龄,20~25 g体重)购自南京君科生物工程有限公司,动物合格证号:SYXC(宁)2018-005。所有动物在受控环境(温度21~23℃、湿度50%~60%、光暗循环12∶12小时)中用标准食物和足量水笼养(每笼5只小鼠)。
1.3 模型制备 采用盲肠结扎穿刺法(CLP)制备小鼠脓毒症模型:用2%戊巴比妥钠溶液(50 mg/kg)麻醉动物,俯卧消毒。切开皮肤,通过腹部中线切口(约1cm)显露盲肠。盲肠在回盲瓣下1/4处用外科缝线结扎,用20G消毒针穿刺。将小肠内容物挤出约0.3 mL,然后将盲肠返回腹腔,缝合腹膜和皮肤。术后采用复方利多卡因乳膏减轻疼痛。术后即刻皮下注射单剂量抗生素(西司他丁,0.5 mg/小鼠)。假手术组除盲肠结扎、穿刺外,均采用相同的治疗方法。
1.4 动物分组及H2治疗方法 将WT和Nrf2-/-小鼠各152只按随机数字表法分为4×2组(WT小鼠4组,Nrf2-/-小鼠4组):假手术组、假手术+氢气组、脓毒症模型组、氢气治疗组。术后1 h和6 h,H2处理组(假手术+氢气组和氢气治疗组)的小鼠被放在一个带有入口和出口的树脂盒中,给予2%氢气处理60 min。H2由TF-1气体流量计进行调控,以4 L/min的速率与空气混合。箱子中的H2浓度由氢气浓度检测器持续监测,并在整个治疗过程中保持在2%的浓度。假手术组和脓毒症组小鼠仅吸入空气。
1.5 小鼠存活情况观察 在假手术或CLP术后24 h,每组随机挑选20只小鼠观察并计算各组的7天存活率。
1.6 EB外渗法检测血脑屏(BBB)通透性 假手术或CLP术后24 h,每组随机挑选4只小鼠麻醉,经尾静脉注射溶于生理盐水浓度为2%的EB,剂量为3 mL/kg,扩散2 h,生理盐水灌注后处死小鼠。取大脑皮质,分别称重,用甲酰胺(1 mL)匀浆,37℃孵育48 h,离心后,用分光光度计检测上清液在625 nm处的光密度(OD)值。在线性标准曲线的基础上,定量各样本的EB值(μg/g湿重)。
1.7 Western blotting法检测小鼠皮层黏附连接蛋白(VE-cadherin)和紧密连接蛋白(ZO-1)的水平 脱臼处死小鼠,开颅分离切取大脑皮层,匀浆离心后取上清。将等量蛋白(50μg)加入SDS上样缓冲液中,100 ℃恒温加热5 min使其变性。经SDS-PAGE电泳分离、转膜、封闭后并用以下蛋白质的主要抗体检测:VE-cadherin、ZO-1和β-actin。在4℃漂洗过夜后,加入山羊抗鼠抗体或山羊抗兔抗体,37 ℃孵育1 h。洗涤后滴入ECL化学发光液,用Bio-Rad图像分析系统进行扫描和拍照。靶蛋白的表达水平由靶带与β-actin带的灰度值之比来反映。
1.8 Morris水迷宫检测小鼠认知功能 各组余10只小鼠于术后第4天至第10天行Morris水迷宫实验评价小鼠认知功能。水迷宫(Haslings公司,美国)为直径150 cm、高50 cm黑色圆柱形水池,池壁上以4个等距点将水池平均分为Ⅰ、Ⅱ、Ⅲ和Ⅳ象限,在第Ⅰ象限中央放置一圆形隐藏平台,直径10 cm,低于水面1 cm。水池周围设有参照物且保持不变,在水中加入白色染料拌匀。水温保持在25 ℃。定位航行实验:连续7天,4次/天,每次将小鼠从不同象限面向池壁放入池中,记录小鼠找到平台的时间(逃避潜伏期)。当超过90 s小鼠还未寻到平台,记为90 s并引导小鼠上台,停留10 s。空间探索实验:定向航行实验结束后,立即将平台撤去,第Ⅰ象限作为入水点,记录小鼠90 s内穿越平台次数。
1.9 统计学方法 采用SPSS 21.0软件进行分析,计数资料以例(%)表示,计量资料以均数±标准差()表示。多组比较采用单因素方差分析,组间进一步两两比较采用LSD-t检验。用时序检验(Long-rank Test)比较小鼠7天存活率,以P<0.05为差异有统计学意义。
2 结果
2.1 H2对WT和Nrf2-/-脓毒症小鼠存活率的影响 与假手术组相比,脓毒症组WT和Nrf2-/-型小鼠的7天存活率均显著降低(均P<0.01)。吸入2%H2后,氢气治疗组的WT小鼠存活率显著升高(P<0.01)。在Nrf2-/-小鼠中,氢气治疗组和脓毒症模型组间的小鼠存活率无显著差异(P>0.05)。见图1。

图1 各组小鼠7天存活率比较
2.2 H2对WT和Nrf2-/-脓毒症小鼠EB外渗量的影响 与假手术组比,脓毒症模型组WT和Nrf2-/-型小鼠的EB外渗量均显著升高(P<0.01)。吸入2% H2后,氢气治疗组WT小鼠的EB外渗量较脓毒症模型组显著降低(P<0.01)。在Nrf2-/-小鼠中,氢气治疗组和脓毒症模型组间的小鼠EB外渗量无显著差异(P>0.05)。见图2。

图2 各组小鼠EB外渗量的比较
2.3 H2对WT和Nrf2-/-脓毒症小鼠逃避潜伏期的影响 与假手术组相比,脓毒症模型组WT和Nrf2-/-型小鼠造模后第6天起逃避潜伏期均显著延长(P<0.01)。吸入2%H2后,氢气治疗组WT小鼠逃避潜伏期较脓毒症模型组显著降低(P<0.01)。在Nrf2-/-小鼠中,氢气治疗组和脓毒症模型组间的小鼠逃避潜伏期无显著差异(P>0.05)。见图3。

图3 各组小鼠定位航行实验中逃避潜伏期的比较
2.4 H2对WT和Nrf2-/-脓毒症小鼠穿越平台次数的影响 与假手术组相比,脓毒症模型组WT和Nrf2-/-型小鼠造模后第10天穿越平台次数均显著减少(P<0.01)。吸入2% H2后,脓毒症+氢气治疗组WT小鼠较脓毒症模型组穿越平台次数显著增多(P<0.01)。在Nrf2-/-小鼠中,氢气治疗组和脓毒症模型组小鼠穿越平台次数无显著差异(P>0.05)。见图 4。

图4 各组小鼠穿越平台次数的比较
2.5 各组小鼠大脑皮质VE-cadherin和ZO-1表达与假手术组相比,脓毒症模型组WT和Nrf2-/-型小鼠大脑皮质VE-cadherin水平及ZO-1水平均显著降低(P<0.05)。吸入2%H2后,氢气治疗组WT小鼠皮质VE-cadherin水平及ZO-1水平显著升高(P<0.05)。在Nrf2-/-小鼠中,氢气治疗组和模型组间VE-cadherin及ZO-1水平无显著差异(P>0.05)。见图5~7。
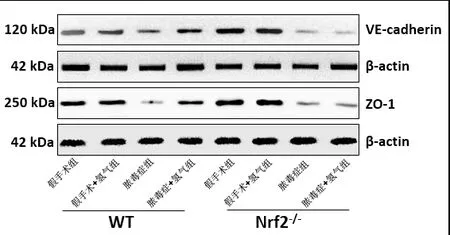
图5 蛋白免疫印迹法检测各组小鼠皮质VE-cadherin和ZO-1表达水平

图6 各组小鼠大脑皮质VE-cadherin/β-actin水平的比较
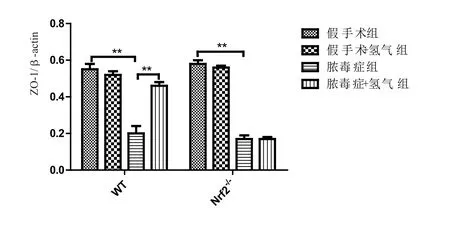
图7 各组小鼠大脑皮质ZO-1/β-actin水平的比较
3 讨论
脓毒症是一种由多种感染因子引起的严重全身炎症反应综合征[1]。既往认为脓毒症可通过损伤血脑屏障进而导致脑损伤,表现为认知障碍和行为缺陷,即SAE[3,11]。课题组既往研究表明,H2能有效预防脓毒症和SAE,并能减轻脓毒症引起的认知障碍[8,12]。CLP模型是一种被广泛认可和应用于脓毒症研究的动物模型[13]。本项研究结果显示H2对严重脓毒症引起的BBB损伤及SAE有保护作用,且Nrf2在其中发挥重要作用。
研究表明BBB损伤是SAE的主要原因之一[4]。BBB破坏可导致血管源性/细胞衍生的脑水肿、组织代谢失衡、兴奋性毒性、周围巨噬细胞和淋巴细胞浸润、促进炎症反应和抑制神经修复,从而影响相应脑的功能,导致长期认知功能障碍[11,14]。本研究检测EB外渗量以反映BBB的损伤程度。血管外EB外渗量与BBB损伤呈正相关,在WT和Nrf2-/-小鼠中模型组均高于假手术组。H2治疗可降低脓毒症所致WT小鼠脑组织EB外渗量,但不能降低Nrf2-/-小鼠脑组织EB外渗量。在认知评估方面,吸入氢气降低了WT脓毒症小鼠的逃避潜伏期,增加了平台穿越次数,但H2没有相应降低Nrf2-/-脓毒症小鼠的逃避潜伏期,增加平台穿越次数。结果表明,在WT小鼠中,H2可提高脓毒症小鼠存活率,并通过保护BBB减轻SAE,而对Nrf2-/-小鼠则无此作用。
本实验进一步研究了H2对BBB的保护作用机制。BBB的通透性与血管内皮细胞间紧密连接蛋白变化有关[11]。本研究结果发现,脓毒症WT和Nrf2-/-小鼠皮层中黏附相关蛋白VE-cadherin和紧密连接蛋白ZO-1表达降低。在WT小鼠中,氢气治疗组小鼠皮质中的VE-cadherin和ZO-1水平均高于模型组,但在Nrf2-/-小鼠中则未出现类似结果。这些数据表明脓毒症可以损伤紧密连接蛋白和黏附相关蛋白,使BBB的通透性增加,导致BBB的破坏,从而引起认知损伤,而H2可以逆转WT小鼠的BBB破坏。
上述结果发现H2对Nrf2缺陷的脓毒症小鼠无明显保护作用。Nrf2是一种亮氨酸拉链(BZIP)转录因子,其调节抗氧化蛋白的水平并保护细胞免受氧化损伤,被广泛认为是多器官保护剂[15]。在氧化应激或其他刺激下,Nrf2可以被激活并从细胞质转移到细胞核,并结合到ES基因来控制抗氧化剂的表达和激活,包括SOD和CAT,以及II期基因,包括血红素加氧酶-1(HO-1)、谷胱甘肽S-转移酶(GSTs)和NAD(P)H奎宁氧化还原酶[6,8]。结果表明,H2对Nrf2缺陷型脓毒症小鼠无明显的脑保护作用。证明Nrf2通路参与并调节了H2对脓毒症和SAE的保护作用。

